Imágenes en vivo de alto rendimiento de microcolonias para medir la heterogeneidad en crecimiento y expresión génica
Summary
Los fenotipos de crecimiento de levadura se miden con precisión a través de imágenes de lapso de tiempo altamente paralelas de células inmovilizadas que crecen en microcolonías. Simultáneamente, se puede monitorear la tolerancia al estrés, la expresión proteica y la localización de proteínas, generando conjuntos de datos integrados para estudiar cómo las diferencias ambientales y genéticas, así como la heterogeneidad de la expresión génica entre las células isogénicas, modulan el crecimiento.
Abstract
Las mediciones precisas de la heterogeneidad entre cepas y dentro de la cepa en las tasas de crecimiento microbiano son esenciales para comprender los insumos genéticos y ambientales en la tolerancia al estrés, la patogenicidad y otros componentes clave de la aptitud física. Este manuscrito describe un ensayo basado en microscopios que rastrea aproximadamente 10 microcoloníassaccharomyces cerevisiae por experimento. Después de la toma automatizada de imágenes de lapso de tiempo de levadura inmovilizadas en una placa multipobajo, las tasas de crecimiento de microcolonía se analizan fácilmente con software de análisis de imágenes personalizado. Para cada microcolonía, también se puede controlar la expresión y localización de proteínas fluorescentes y la supervivencia del estrés agudo. Este ensayo permite una estimación precisa de las tasas de crecimiento promedio de las cepas, así como una medición integral de la heterogeneidad en el crecimiento, la expresión génica y la tolerancia al estrés dentro de las poblaciones clonales.
Introduction
Los fenotipos de crecimiento contribuyen críticamente a la aptitud de la levadura. La selección natural puede distinguir eficientemente entre linajes con tasas de crecimiento diferentes por la inversa del tamaño efectivo de la población, que puede superar los 108 individuos1. Además, la variabilidad de las tasas de crecimiento entre los individuos dentro de una población es un parámetro relevante para la evolución, ya que puede servir como base para estrategias de supervivencia como la cobertura de apuestas2,3,4,5,6. Por lo tanto, los ensayos que permiten mediciones altamente precisas de fenotipos de crecimiento y sus distribuciones son fundamentales para el estudio de microorganismos. El ensayo de crecimiento de microcolonía descrito aquí puede generar mediciones individuales de la tasa de crecimiento para ~105 microcolonies por experimento. Por lo tanto, este ensayo proporciona un poderoso protocolo para estudiar la genética evolutiva y la genómica de la levadura. Se presta particularmente bien para probar cómo se genera, mantiene y contribuye a la variabilidad dentro de las poblaciones de células individuales genéticamente idénticas, y contribuye a la aptitud de la población7,8,9,10.
El método descrito aquí (Figura 1) utiliza imágenes de campo brillante capturadas periódicamente y de baja ampliación de células que crecen en medios líquidos en una placa inferior de vidrio de 96 o 384 pozos para rastrear el crecimiento en microcolonías. Las células se adhieren a la lectina concanavalina A, que recubre la parte inferior de la placa del microscopio, y forman colonias bidimensionales. Debido a que las microcolonías crecen en una monocapa, el área de microcolonía está altamente correlacionada con el número de celda7. Por lo tanto, se pueden generar estimaciones precisas de la tasa de crecimiento de la microcolonía y el tiempo de retraso con software de análisis de imágenes personalizado que realiza un seguimiento de la tasa de cambio del área de cada microcolonía. Además, la configuración experimental puede monitorear las abundancias e incluso las localizaciones subcelulares de proteínas etiquetadas fluorescentemente expresadas en estas microcolonías. El procesamiento descendente de los datos de este ensayo de crecimiento de microcolonía se puede lograr mediante análisis personalizado o mediante software de análisis de imágenes existente, como Procesamiento de imágenes fácilmente (PIE)11, un algoritmo para el reconocimiento robusto del área de colonias y un análisis de crecimiento de alto rendimiento a partir de imágenes de bajo aumento y campo brillante, que está disponible a través de GitHub12.
Debido a que las estimaciones de la tasa de crecimiento derivadas del ensayo de crecimiento de microcolonía se generan a partir de un gran número de mediciones de una sola colonia, son extremadamente precisas, con errores estándar varios órdenes de magnitud más pequeños que las propias estimaciones para un experimento de tamaño razonable. Por lo tanto, el poder del ensayo para detectar diferencias de ritmo de crecimiento entre diferentes genotipos, tratamientos o condiciones ambientales es alto. El formato multiwell-plate permite comparar numerosas combinaciones diferentes de entornos y genotipos en un solo experimento. Si las cepas expresan constitutivamente diferentes marcadores fluorescentes, pueden mezclarse en el mismo pozo y distinguirse por un análisis de imagen posterior, lo que podría aumentar aún más la potencia al permitir una normalización de los datos bien por pozo.
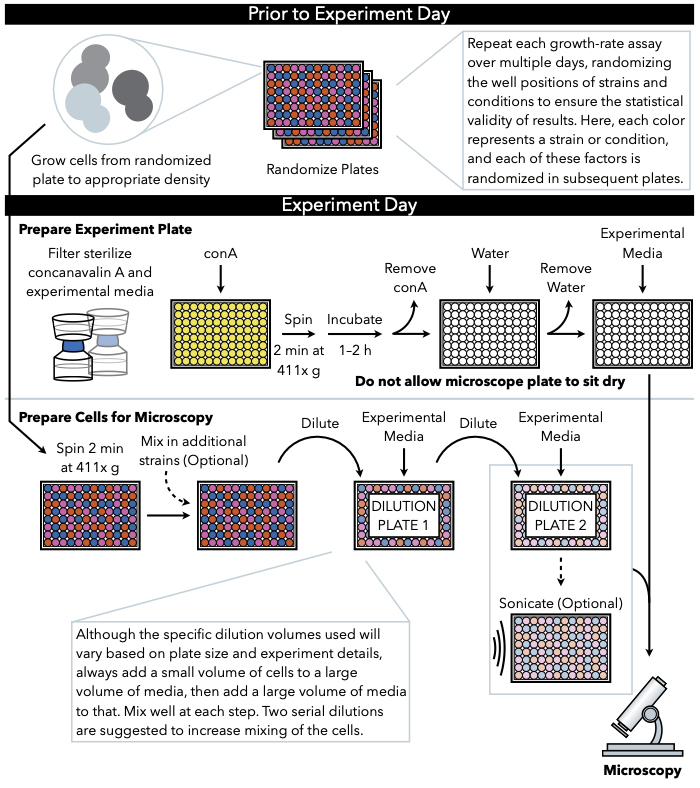
Figura 1: Representación esquemática del protocolo. Este protocolo sigue dos pasos principales, que son la preparación de la placa experimental y la preparación de las células para la imagen. La aleatorización de las placas y el crecimiento de las células deben llevarse a cabo antes y antes del día del experimento. La mezcla repetida de células en cada paso durante la dilución es imperativa en los pasos hasta el chapado, y por lo tanto se recomienda primero preparar la placa experimental para que esté lista para el chapado inmediatamente después de la finalización de la dilución celular. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El protocolo descrito aquí es un ensayo versátil que permite monitorear simultáneamente el crecimiento celular y la expresión génica a nivel de microcolonías individuales. La combinación de estas dos modalidades produce conocimientos biológicos únicos. Por ejemplo, trabajos anteriores han utilizado este ensayo para mostrar una correlación negativa entre la expresión del gen TSL1 y la tasa de crecimiento de microcolonía en células de tipo salvaje isogénico midiendo ambas simultáneamente<sup class="…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Naomi Ziv, Sasha Levy y Shuang Li por sus contribuciones al desarrollo de este protocolo, David Gresham por equipos compartidos y Marissa Knoll por su ayuda con la producción de video. Este trabajo fue apoyado por la subvención R35GM118170 de los Institutos Nacionales de Salud.
Materials
| General Materials | |||
| 500 mL Bottletop Filter .22 µm PES Sterilizing, Low Protein Binding, w/45mm Neck | Fisher | CLS431154 | used to filter the media |
| BD Falcon*Tissue Culture Plates, microtest u-bottom | Fisher | 08-772-54 | 96-well culture tubes used to freeze cells, pre-grow cells, and dilutions |
| BD Syringes without Needle, 50 mL | Fisher | 13-689-8 | Used to filter the Concanavalin A |
| Costar Sterile Disposable Reagent Reservoirs | Fisher | 07-200-127 | reagent reservoirs used to pipette solutions with multichannel pipette |
| Costar Thermowell Aluminum Sealing Tape | Fisher | 07-200-684 | 96-well plate seal for pre-growth and freezing |
| lint and static free Kimwipes | Fisher | 06-666A | lint and static free wipes to keep microscope plate bottom free of debris and scratches |
| Nalgene Syringe Filters | ThermoFisher Scientific | 199-2020 | 0.2 μm pore size, 25 mm diameter; used to filter concanavalin A solution |
| Media Components | |||
| Minimal chemically defined media (MD; 2% glucose) | alternative microscopy media used for yeast pre-growth and growth during microscopy | ||
| Synthetic Complete Media (SC; 2% glucose) | microscopy media used for yeast pre-growth and growth during microscopy | ||
| Yeast extract-peptone-dextrose (YEPD; 2% glucose) medium | cell growth prior to freezing down randomized plates | ||
| Microscopy Materials | |||
| Breathe-Easy sealing membrane | Millipore Sigma | Z380059-1PAK | breathable membranes used to seal plate during microscopy experiment. At this stage breathable membranes are reccomended because they prevent condensation in the wells and allow for better microscopy images |
| Brooks 96-well flat clear glass bottom microscope plate | Dot Scientific | MGB096-1-2-LG-L | microscope plate |
| Concanavalin A from canavalia ensiformis (Jack Bean), lyophilized powder | Millipore Sigma | 45-C2010-1G | Make 5x concanavalin A solution and freeze 5ml of 5x concanavalin A in 50 mL conical tubes at -80 °C |
| Strains Used | |||
| MAH.5, MAH.96, MAH.52, MAH.66, MAH.11, MAH.58, MAH.135, MAH.15, MAH.44, MAH.132 | Haploid mutation accumulation strains in a laboratory background, described in Hall and Joseph 2010 | ||
| EP026.2A-2C | Progeny of the ancestral Hall and Joseph 2010 mutation accumulation strain, transformed with YFR054cΔ::Scw11P::GFP | ||
| Equipment | |||
| Misonix Sonicator S-4000 with 96-pin attachment | Sonicator https://www.labx.com/item/misonix-inc-s-4000-sonicator/4771281 | ||
| Nikon Eclipse Ti-E with Perfect Focus System | Inverted microscope with automated stage and autofocus system |
References
- Geiler-Samerotte, K. A., Hashimoto, T., Dion, M. F., Budnik, B. A., Airoldi, E. M., Drummond, D. A. Quantifying condition-dependent intracellular protein levels enables high-precision fitness estimates. PloS one. 8 (9), 75320 (2013).
- Kussell, E., Leibler, S. Phenotypic diversity, population growth, and information in fluctuating environments. Science. 309 (5743), 2075-2078 (2005).
- Thattai, M., van Oudenaarden, A. Stochastic gene expression in fluctuating environments. 遗传学. 167 (1), 523-530 (2004).
- King, O. D., Masel, J. The evolution of bet-hedging adaptations to rare scenarios. Theoretical population biology. 72 (4), 560-575 (2007).
- Acar, M., Mettetal, J. T., van Oudenaarden, A. Stochastic switching as a survival strategy in fluctuating environments. Nature genetics. 40 (4), 471-475 (2008).
- Avery, S. V. Microbial cell individuality and the underlying sources of heterogeneity. Nature reviews. Microbiology. 4 (8), 577-587 (2006).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS biology. 10 (5), 1001325 (2012).
- van Dijk, D., et al. Slow-growing cells within isogenic populations have increased RNA polymerase error rates and DNA damage. Nature communications. 6, 7972 (2015).
- Ziv, N., Shuster, B. M., Siegal, M. L., Gresham, D. Resolving the Complex Genetic Basis of Phenotypic Variation and Variability of Cellular Growth. 遗传学. 206 (3), 1645-1657 (2017).
- Li, S., Giardina, D. M., Siegal, M. L. Control of nongenetic heterogeneity in growth rate and stress tolerance of Saccharomyces cerevisiae by cyclic AMP-regulated transcription factors. PLoS genetics. 14 (11), 1007744 (2018).
- Plavskin, Y., Li, S., Ziv, N., Levy, S. F., Siegal, M. L. Robust colony recognition for high-throughput growth analysis from suboptimal low-magnification brightfield micrographs. bioRxiv. , (2018).
- Ziv, N., Siegal, M. L., Gresham, D. Genetic and nongenetic determinants of cell growth variation assessed by high-throughput microscopy. Molecular biology and evolution. 30 (12), 2568-2578 (2013).
- Hall, D. W., Joseph, S. B. A high frequency of beneficial mutations across multiple fitness components in Saccharomyces cerevisiae. 遗传学. 185 (4), 1397-1409 (2010).
- Saleemuddin, M., Husain, Q. Concanavalin A: a useful ligand for glycoenzyme immobilization–a review. Enzyme and microbial technology. 13 (4), 290-295 (1991).
- Geiler-Samerotte, K. A., Bauer, C. R., Li, S., Ziv, N., Gresham, D., Siegal, M. L. The details in the distributions: why and how to study phenotypic variability. Current opinion in biotechnology. 24 (4), 752-759 (2013).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biological reviews of the Cambridge Philosophical Society. 85 (4), 935-956 (2010).
- Bolker, J. A. Exemplary and surrogate models: two modes of representation in biology. Perspectives in biology and medicine. 52 (4), 485-499 (2009).

