초기 단계 무척추 디스크 질환을 시뮬레이션하는 선동적이고 퇴행성 장기 문화 모델.
Summary
이 프로토콜은 초기 단계 무척추 디스크 퇴행성을 시뮬레이션하기 위해 염증, 퇴행성 소 장기 문화의 새로운 실험 모델을 제시합니다.
Abstract
증상 간무성 디스크(IVD) 변성(IDD)은 사회경제적 부담이 주요이며 염증 및 조직 저하를 특징으로 합니다. 인과 치료의 부족으로 인해 질병의 진행에 관련된 메커니즘을 연구하고 치료 목표를 찾고 동물 모델의 필요성을 줄이기 위한 혁신적인 실험 기관 배양 모델이 절실히 필요합니다. 우리는 여기에 IDD 동안 존재하는 염증성 및 이발성 미세 환경을 모방하는 새로운 3 차원 장기 배양 모델 프로토콜을 제시합니다.
처음에, 소 caudal IVDs는 조직 배양 배지에서 해부, 청소 및 배양되었다. 동적 생리학적 또는 병리학적 적재는 하루에 2시간 동안 맞춤형 생물반응기에서 적용되었다. IVDs는 4일 동안 대조군(고포도당 배지, 생리적 적재, 인산염 완충식염 주입) 및 병리학적 군(저포도당 배지, 병리학 적재, 종양 괴사 인자-알파 주입)에 할당되었다. 조절된 장기 배양 배지의 효소 연계 면역소벤트 분석의 수집된 핵 펄포서스 세포로부터의 유전자 발현 분석이 수행되었다.
우리의 데이터는 대조군에 비해 병리학 적 단에 적재 한 후 염증 성 마커의 높은 발현과 감소 된 디스크 높이를 밝혔다. 이 프로토콜은 IVD 염증 및 변성을 시뮬레이션할 수 있으며 적용 범위를 넓히기 위해 더욱 확장될 수 있습니다.
Introduction
요통(LBP)은 모든 연령대의 개인에게 영향을 미칠 수 있으며 전 세계적으로 장애의 주요원인인 1,2,3. LBP와 관련된 총 비용은연간4,5를초과합니다. 염증 및 조직 분해를 특징으로 하는 질환인 증상 추간판(IVD) 변성(IDD)은 LBP6,7의주요 원인이다. 구체적으로, IDD는 IVD의 세포외 매트릭스(ECM)의 점진적으로 진화하는 고장을 특징으로 하며, 가속병리학, 신경장애 및 결국 장애로 이어지는 여러 요인에 의해 유도되고 유발된다. 더욱이, IDD는 염증성 사이토카인의 방출과 연관되어, 변경된 척추 생체역학, 혈관신생 및 신경성장, 통증 감각을 증가시켜 만성 LBP(활성 디스코파시증)6,8을유발한다. 현재까지, 치료 옵션은 인접한 척추의 내분 및 후속 융합, IVD 보철물의 이식, 또는 비스테로이드 항염증제 약물, 오피오이드 및 IDD9환자를 위한 근육 이완제와 같은 비수술적 접근법을 포함한다. 현재 표준 치료 옵션, 외과 및 비 수술, 부분적으로 효과적이며 근본적인 생물학적 문제를 해결하지 못합니다9,10. 초기 단계 퇴행성 디스크 질환은 초기 염증 조직 반응, 특히 종양 괴사 인자-알파(TNF-alpha)발현(11)의증가를 특징으로 한다. 이러한 초기 디스크 변화는 주로 디스크 아키텍처를 방해하지 않고 세포 수준에서 발생하며 이전에 는 염증성 조건12에서영양 결핍에 의해 모방 될 수 있습니다. 따라서 이러한 변성 메커니즘을 조사하고 적절한 치료 목표를 찾기 위해 생체 내 상황을 정밀하게 시뮬레이션하는 것이 중요하다. 또한 이러한 분자 특성 시뮬레이션에 대해 디스크의 기계적 적재 환경은 IVD의 병리학적 및 생리적 변화에 중요한 역할을 합니다. 따라서 이러한 접근 방식을 결합하면 생체 내에서 IVD의 복잡한 미세 환경을 모방하기 위해 한 걸음 앞으로 나아갈 수 있습니다. 현재 우리의 지식의 최선을 프로 염증 및 영양 설정과 함께 동적 로딩의 측면을 고려 하는 연구는 없습니다.
대형 동물 모델은 생체 내 상호 작용에서 잠재적 인 관련조사를 허용하지만 비용이 많이 들고 집약적입니다. 더욱이, 연구에서 동물 모델의 사용은 오랫동안 논쟁의 문제이기 때문에 중요한 연구 질문에 대답하는 데 필요한 동물의 수가 감소하는 것은 큰 관심사입니다. 마지막으로, 현재 IVD 연구13,14에서IDD를 모방하는 이상적인 동물 모델은 없습니다. 따라서 IDD 및 관련 염증 및 퇴행성 공정을 시뮬레이션하기 위해 장기 배양 모델과 같은 비용 효율적이고 신뢰할 수 있는 대체품을 확립할 필요가 있다. 최근에는 초기 단계 추간판 질환을 시뮬레이션하기 위해 염증성 및 퇴행성 장기 배양 모델의 확립에 관한 본 프로토콜의 적용을 통해 IDD 장기배양(15)에서항염증제의 효과를 조사할 수 있게 되었다.
여기서, 우리는 소 간장 디스크를 얻고 종양 괴사 인자-알파 (TNF-α)의 직접 무분별한 주입에 의한 이화 및 염증성 미세 환경을 통해 초기 단계 IDD의 상태를 유도하고 낮은 영양 중간 조건하에서 생물 반응기에서 퇴행성 적재하는 방법을 설명합니다. 도 1은 실험 모델을 나타내고 퇴행성 및 생리적 적재 조건을 시뮬레이션하는 데 사용되는 생물 반응기를 보여줍니다.
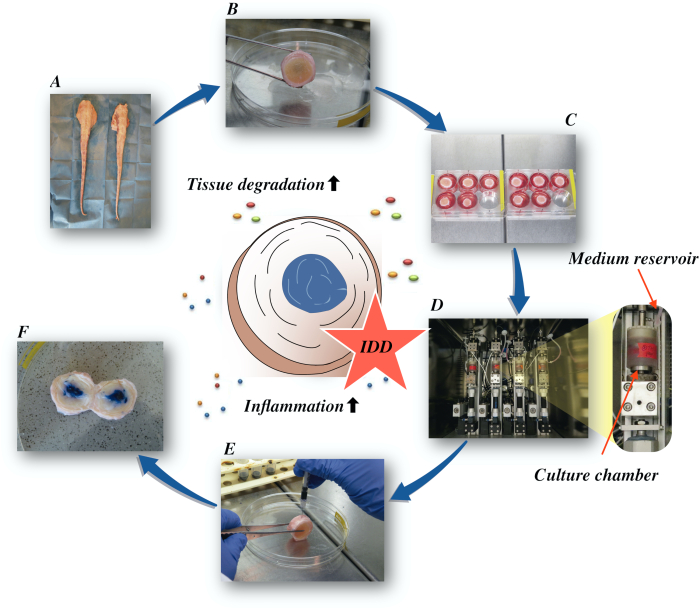
그림 1: 실험 설정의 그림입니다. A: 소 꼬리; B: 해부된 소 상호 디스크; C: 문화 배지가 있는 잘 플레이트에 디스크를 전송; D: 생물 반응기에서 시뮬레이션을 적재; E: 무내 분사 기술; F: PBS/트라이판 블루 염료를 주입한 후 IVD가 분포를 드러냅니다. IDD: 추간판 변성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
우리는 여기에 퇴행성 및 염증 성 IVDD를 시뮬레이션하는 상세한 프로토콜을 제공했다. 이 프로토콜은 디스크에 파괴적인 효과로 이어지는 염증 경로의 상세한 검사를 신청할 수 있습니다. 더욱이, 프로토콜은 질병의 진행에 관련시키는 유망한 치료 표적을 결정하는 것을 도울 수 있습니다.
최근에는 인간 재조합 TNF-α 소와 인간 NP세포(21)의염증을 유발할 수 …
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 작품은 AO 재단과 AOSpine 인터내셔널에 의해 지원되었다. 바박 사라비는 독일 척추 재단과 독일 골관절염 재단으로부터 펠로우십 지원을 받았다. 게르노 랭은 고급 임상의 과학자를위한 베르타 – 오텐슈타인 프로그램에 의해 지원되었다, 의학 학부, 프라이부르크 대학, 독일.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
References
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

