שימוש במנתח שטף מטבולי של תאים בזמן אמת לניטור ביו-אנרגיה של אוסטאובלסט
Summary
בדיקת שטף מטבולי של תאים בזמן אמת מודדת את קצב צריכת החמצן ואת קצב ההחמצה החוץ-תאית, המתאים לייצור אדנוזין טריפוספט מיטוכונדריאלי וגליקוליטי, באמצעות חיישני pH וחמצן. כתב היד מסביר שיטה להבנת מצב האנרגיה של אוסטאובלסטים ואפיון ופרשנות של המצב הביו-אנרגטי התאי.
Abstract
היווצרות עצם על ידי אוסטאובלסטים היא תהליך חיוני לרכישת עצם נכונה ותחלופת עצם כדי לשמור על הומאוסטזיס שלד, ובסופו של דבר, למנוע שבר. מתוך אינטרס הן לייעל את מסת העצם והן להילחם במחלות שלד-שריר שונות (כלומר, אוסטאופורוזיס לאחר גיל המעבר, אנורקסיה נרבוזה, סוכרת מסוג 1 ו-2), נעשו מאמצים מדהימים בתחום הביולוגיה של העצם לאפיין באופן מלא את האוסטאובלסטים לאורך תהליך ההתמיינות שלהם. בהתחשב בתפקידם העיקרי של אוסטאובלסטים בוגרים להפריש חלבוני מטריצה ושלפוחיות מינרליזציה, צוין כי תהליכים אלה לוקחים כמות מדהימה של אנרגיה תאית, או אדנוזין טריפוספט (ATP). מצב האנרגיה התאית הכולל מכונה לעתים קרובות ביו-אנרגיה תאית, והוא כולל סדרה של תגובות מטבוליות שחשות את זמינות המצע כדי להפיק ATP כדי לענות על הצרכים התאיים. לכן, השיטה הנוכחית מפרטת את התהליך של בידוד תאים סטרומליים ראשוניים, מח עצם מורין (BMSCs) וניטור מצבם הביו-אנרגטי באמצעות מנתח השטף המטבולי של התא בזמן אמת בשלבים שונים בהתמיינות אוסטאובלסט. חשוב לציין, נתונים אלה הראו כי הפרופיל המטבולי משתנה באופן דרמטי במהלך התמיינות אוסטאובלסט. לפיכך, שימוש בסוג תא רלוונטי מבחינה פיזיולוגית זה נדרש כדי להעריך באופן מלא כיצד המצב הביו-אנרגטי של התא יכול לווסת את התפקוד הכולל.
Introduction
היווצרות העצם על ידי האוסטאובלסט מלווה בהרס מתואם או ספיגה מחדש של עצמות על ידי אוסטאוקלסטים. האיזון בין היווצרות עצם אוסטאובלסטית לבין ספיגת אוסטאוקלסט הוא תהליך מצומד המתאר תחלופת עצם או שיפוץ, החיוני להומאוסטזיס של השלד. תפקוד לקוי של אוסטאובלסט מוביל לפגיעה ביצירת העצם וגורם למחלות שונות, כולל אוסטאופורוזיס 1,2,3. התמיינות Ex vivo/in vitro של תאי גזע סטרומליים של מח עצם (BMSCs) למבשרי אוסטאובלסטים ואוסטאובלסטים בוגרים גורמת להיווצרות ותצהיר של מטריצת העצם המינרלית בכלי התרבית לאורך זמן 4,5,6. היווצרות עצם זו על ידי האוסטאובלסט דורשת כמות משמעותית של אנרגיה תאית. באופן ספציפי, הוכח כי סינתזה והפרשת קולגן מסתמכות במידה רבה על ATP תאי: יחסי ADP, וככל הנראה, סחר בשלפוחית מינרלית והפרשתם דורשים תוספת ATP 7,8,9,10,11. חוקרים רבים הראו כי התהליך של אוסטאובלסטוגנזה ותפקוד אוסטאובלסט דורש אספקה מספקת של אנרגיה כדי לענות על הדרישה המטבולית של היווצרות עצם 12,13,14,15,16. לכן, המטרה של שיטה זו היא לאפיין את המצב הביו-אנרגטי של תאים סטרומליים ראשוניים, מורין, לאורך התמיינות אוסטאובלסט באמצעות מנתח השטף המטבולי של התא בזמן אמת. טכניקות אלה מסייעות בפיתוח הבנה טובה יותר של הומאוסטזיס שלד, אשר עשוי להוביל בסופו של דבר לפיתוח של אפשרויות טיפוליות חדשניות המסוגלות לשפר את הפרעות השלד.
ניתן להשתמש במנתח השטף המטבולי של התאים בזמן אמת כדי למדוד את קצב צריכת החמצן (OCR) ואת קצב ההחמצה החוץ-תאית (ECAR) של אוסטאובלסטים חיים, המתאימים לייצור ATP מיטוכונדריאלי וגליקוליטי, בהתאמה. היסוד למתודולוגיה זו הוא העובדה כי יון H+ אחד לכל לקטט משתחרר במהלך הגליקוליזה בהמרה של גלוקוז לקטט, מה שמשנה את ה- pH המדיה המשתקף בערכי ECAR. לעומת זאת, במהלך מחזור TCA (חומצה טריקרבוקסילית), זרחון חמצוני באמצעות המיטוכונדריה מייצר CO2 על ידי שימוש או צריכת חמצן, ולכן ניטור OCR משקף את התהליך המטבולי הזה. המנתח מודד הן את ה-OCR והן את ה-ECAR במיקרו-סביבה החוץ-תאית בו-זמנית ובזמן אמת, מה שמאפשר פוטנציאל עצום בחקר ביו-אנרגיה תאית 6,17. בנוסף, ביצוע בדיקות אלה הוא פשוט יחסית וניתן להתאמה אישית בקלות בהתאם למטרת הניסוי. טכניקות דומות הופעלו כדי להבין עוד יותר את הוויסות המטבולי של תאי T של מערכת החיסון18,19, התחלת סרטן והתקדמות20, יחד עם סוגי תאים רבים אחרים התורמים לתסמונות מטבוליות21,22.
היתרונות של מנתח שטף מטבולי בזמן אמת על פני טכניקות חלופיות כוללים (1) את היכולת למדוד ביו-אנרגיה תאית של תאים חיים בזמן אמת, (2) יכולת לבצע בדיקה עם מספר קטן יחסית של תאים (דורשת עד 5,000 תאים), (3) יציאות הזרקה כדי לתמרן במקביל טיפולים מרובים במערכת בעלת תפוקה גבוהה של 96 קידוחים, (4) שימוש בדימוי תאים אוטומטיים נטולי תוויות רדיואקטיביות לנורמליזציה18, 23,24. השיטות הבאות נועדו לספק תיאור כללי אך מפורט של ניטור ביו-אנרגיה תאית ב-Murine BMSCs לאורך התמיינות אוסטאובלסט באמצעות המנתח. הוא יכלול בדיקות המבוצעות באופן שגרתי; עם זאת, כמו בטכניקות ושיטות רבות, מומלץ מאוד שמעבדות בודדות יקבעו פרטים ספציפיים לניסויים שלהן.
מבחר של בדיקות וסוגים שונים של בדיקות זמינות: מגוון רחב של ערכות בדיקה וריאגנטים זמינים כדי לחקור את הביו-אנרגיה של התאים תוך הבטחת האמינות והעקביות של תוצאות הניסוי. בנוסף, תוכנת שולחן העבודה מציעה גם תבניות בדיקה שניתן להתאים אישית בקלות. ניתן להגדיר את הבדיקה על סמך צרכי המשתמש למדוד פרמטרים מטבוליים שונים. ניתן לשנות מבחנים אלה בדרכים שונות על סמך המטרה הניסויית ו/או השאלה המדעית. לדוגמה, עם ארבע יציאות הזרקה, ניתן להזריק מספר תרכובות למדיית הבדיקה כדי לנתח את התגובה התאית הספציפית לכל מסלול מטבולי.
בדיקת פנוטיפ של אנרגיית התא: בדיקה זו מודדת את הפנוטיפ המטבולי של התאים החיים ואת הפוטנציאל המטבולי שלהם. בדיקה זו מומלצת גם כצעד ראשון לקבלת מושג כללי על חילוף חומרים ספציפי למסלול. תערובת של אוליגומיצין A-מעכב של ATP סינתאז וקרבוניל ציאניד 4-(טריפלואורומתוקסי) פניל-הידרזון (FCCP)-סוכן מיטוכונדריאלי ללא שיתוף פעולה מוזרק כדי להבין את פוטנציאל האנרגיה של התא. הזרקת אוליגומיצין A מעכבת את הסינתזה של ATP, וכתוצאה מכך עלייה בקצב הגליקוליזה (ECAR) כדי לאפשר לתאים לעמוד בדרישות האנרגיה שלהם; מצד שני, הזרקה של FCCP גורמת ל- OCR גבוה יותר עקב דה פולריזציה של הממברנה המיטוכונדרית. בעיקרו של דבר, מבחן זה מתאר נשימה מטבולית בסיסית, ובעקבות הזריקות הכפולות, דוחף או מדגיש, את התגובה המטבולית. בהתבסס על פרמטרים אלה, התוכנה מתווה OCR ו- ECAR של התאים על ידי סיווג התאים כמצב אירובי, שקט, גליקוליטי או אנרגטי לאורך זמן25,26.
בדיקת קצב ייצור בזמן אמת של ATP: זה מודד את ייצור ה-ATP התאי בו-זמנית מגליקוליזה ונשימה מיטוכונדריאלית. בדיקה זו מודדת באופן כמותי את השינויים המטבוליים משני מסלולי האנרגיה ומספקת נתונים על קצב הייצור של ATP המיטוכונדריה והגליקוליטי לאורך זמן. הבדיקה מקבלת נתוני OCR ו-ECAR בסיסיים ולאחר מכן חישוב קצב הייצור של ATP מיטוכונדריאלי באמצעות הזרקת אוליגומיצין A וקצב ייצור ATP גליקוליטי באמצעות הזרקת תערובת רוטנון + אנטימיצין A (עיכוב כולל של תפקוד המיטוכונדריה), וכתוצאה מכך החמצה מיטוכונדריאלית17,27.
מבחן מאמץ למיטוכונדריה של תאים (או מבחן מאמץ מיטו תאי): זה מודד את תפקוד המיטוכונדריה באמצעות נשימה הקשורה ל-ATP, מכמת ביו-אנרגיה תאית, מזהה תפקוד לקוי של המיטוכונדריה ומודד את תגובת התאים ללחץ. פרמטרים שונים, כולל יכולת נשימה בסיסית ורזרבית, נשימה הקשורה ל-ATP, נשימה מקסימלית וצריכת חמצן לא מיטוכונדריאלית, ניתן לקבל בבדיקה אחת. בדיקה זו כוללת זריקות עוקבות של אוליגומיצין A, FCCP (חומר מיטוכונדריאלי לא מיתוכונדריה), תערובת של מעכבי רוטנון/אנטימיצין A כדי לנתח ביעילות את ההשפעה של אלה על תפקוד המיטוכונדריה28.
גמישות מיטו דלק flex מבחן: זה מודד את קצב הנשימה המיטוכונדרית על ידי חמצון של שלושת הדלקים המיטוכונדריים העיקריים על ידי נוכחות והיעדר המעכבים שלהם. העיכוב הרציף של גלוקוז, גלוטמין וחומצות שומן מסייע במדידת התלות, הקיבולת והגמישות של התאים והתלות של התאים במסלולים תאיים שונים כדי לענות על הביקוש לאנרגיה. כאשר המיטוכונדריה אינה יכולה לעמוד בדרישות של מסלול העניין החסום על ידי חמצון דלקים אחרים, התאים נכנסים למצב תלות. יכולתם של התאים מחושבת על ידי עיכוב של שני המסלולים החלופיים האחרים ולאחר מכן עיכוב מסלול העניין. הגמישות של התאים מסייעת בהבנת היכולת של המיטוכונדריה לפצות ולענות על צורכי הדלק של המסלול המעוכב. הוא מחושב על ידי הפחתת התלות של תאים מקיבולת התאים. שלושה מעכבים שונים משמשים באופן עצמאי או כתערובת של שניים כדי לחשב ביעילות את הפרמטרים הבדיקה. 2-ציאנו-3-(1-פניל-1H-אינדול-3-yl)-2-חומצה פרופנואית (UK5099) מעכב את חמצון הגלוקוז על ידי חסימת נשא הפירובט בגליקוליזה. Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl) (BPTES) אתיל סולפיד מעכב את מסלול החמצון של גלוטמין, ואטומוסיר מעכב את החמצון של חומצות שומן ארוכות שרשרת29.
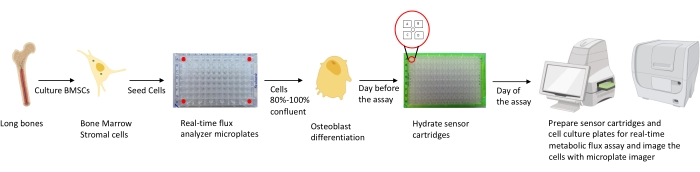
איור 1: ייצוג סכמטי של המתודולוגיה לגידול והכנת אוסטאובלסטים לניתוח. ה-BMSCs של מורין מבודדים מעצמות ארוכות, מתרבית ונזרעים בצלחות של 96 בארות בצפיפות של 25,000 תאים/בארות. התרבות תאים אלה במדיה הספציפית של אוסטאובלסט מתחילה כאשר הם מגיעים למפגש של 80%-100% כדי להתחיל את התמיינותם. הבדיקות מבוצעות בשלבים שונים של בידול. צלחות המחסניות מיובשות יום אחד לפני הבדיקה. ביום הבדיקה מוזרקים מעכבים שונים ליציאות של מחסניות החיישנים על סמך דרישות הבדיקה, ונוסף מאגר כיול ללוחית הכיול של 96 הבארות. לאחר הכיול, מתבצעת בדיקת השטף המטבולי של התא בזמן אמת, ולאחר מכן הדמיה של המיקרו-פלטה של תרבית התא באמצעות הדמיית המיקרו-פלטה כדי לנרמל את נתוני מנתח השטף המטבולי של התא בזמן אמת עם ספירת תאים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
מנתח השטף המטבולי של התא בזמן אמת יכול לשמש כדי לחקור את האנרגטיקה התאית בתנאים שונים. הפרוטוקול ממחיש את הבידוד היעיל של BMSCs, תאי התרבות בלוחות תרבית תאים מתאימים, ואת התמיינותם לאוסטאובלסטים בוגרים, אשר יכולים לשמש לבדיקות שונות באמצעות מנתח השטף החוץ-תאי. יתר על כן, השלבים הקריטיים של בד…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לבריאות (NIH) המכון הלאומי לדלקת פרקים ומחלות שריר-שלד ועור (NIAMS) מענק AR072123 והמכון הלאומי להזדקנות (NIA) מענק AG069795 (ל- ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

