Preparação de Aziridinas Não Ativadas Enantiopure e Síntese de Biemamida B, D e epiallo-Isomuscarina
Summary
Neste estudo, preparamos tanto os enantiomers de aziridina-2-carboxilato, que são usados na síntese assimétrica de alcaloides, incluindo biemamida B e D, e (-)-epiallo-isomuscarina.
Abstract
As aziridinas heterocicas contendo nitrogênio são sinteticamente muito valiosas para a preparação de moléculas azacíclicas e aciíticas. No entanto, é muito difícil e trabalhoso fazer aziridinas em formas opticamente puras em grande escala para aplicar síntese assimétrica de compostos aza. Felizmente, conseguimos com sucesso tanto os enantiomers (2R)- quanto (2S)-aziridina-2-carboxilatos com o grupo de α-metilbenzyl doados por elétrons no nitrogênio do anel como aziridinas não ativadas. Estas aziridinas iniciais têm dois grupos funcionais distintos- anel de três membros altamente reativo e carboxilato versátil. Eles são aplicáveis na abertura de anel ou transformação de anel com aziridina e na transformação funcional de grupo para outros de carboxilato. Ambos os enantiomers foram utilizados na preparação de compostos amino acicláclicos e/ou aza-heterocíclicos biologicamente importantes de forma assimétrica. Especificamente, este relatório descreve a primeira síntese assimétrica expediente de ambos os enantiomers de 5, 6-dihidrouracil-tipo produtos naturais marinhos biemamida B e D como potenciais inibidores TGF-β. Esta síntese consistia em regio- e a reação de abertura de anel estereoselétrico de aziridina-2-carboxilato e formação subsequente de 4-aminoteterahydropyrimidine-2,4-dione. Mais um exemplo neste protocolo deu uma reação mukaiyama altamente estereosetária de aziridina-2-carboxilato e éter silyl enol, seguindo a abertura intramolecular do anel de aziridina para fornecer acesso fácil e fácil à (-)-epiallo-isomuscarina.
Introduction
Pequenos anéis compostos por ciclopropanos, oxiranes e aziridinas são encontrados em vários compostos, como produtos naturais e drogas 1,2. Eles são usados principalmente como materiais iniciais explorando sua tensão do anel. Entre os compostos de três anéis, a aziridina tem sido estudada menos extensivamente devido à sua instabilidade e reatividade incontrolável3. Como mostrado nos mapas potenciais eletrostáticos (Figura 1), um grupo ligado ao aziridina anel-nitrogênio, seja doando elétrons ou atraindo elétrons, torna a basicidade do nitrogênio diferente. Essa diferença proporciona um contraste marcante com a reatividade e seletividade das aziridinas correspondentes.
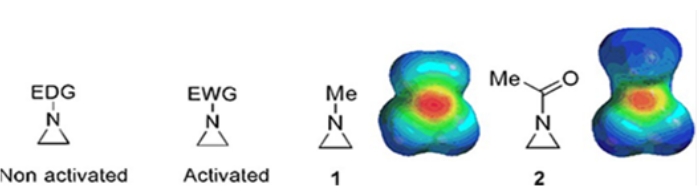
Figura 1: Estruturas químicas de aziridinas “ativadas” e “não ativadas” e mapas potenciais eletrostáticos de seus exemplos representativos N-metilaziridina, e N-acetylaziridine4. Este número foi modificado com permissão de Ranjith et al.4. Clique aqui para ver uma versão maior desta figura.
Quando o nitrogênio do anel tem um grupo de retirada de elétrons, como sulfonato, fosfonato e carbamate, chamamos de aziridina “ativada”. Isso é prontamente reativo com nucleófilos para compensar sua instabilidade com um escopo limitado de regioquímica. Estas aziridinas ativadas são preparadas através de vários métodos catalíticos e usadas como material inicial. Grande parte da recente química de aziridina tem lidado com essas aziridinas ativadas. No entanto, as aziridinas ativadas sofrem certas restrições resultantes de sua instabilidade e escopo de reação limitado da abertura do anel. Por outro lado, as aziridinas que possuem substitutos doados por elétrons, como alquila ou grupos alquilos substituídos, no nitrogênio do anel chamado “não ativado”4, são relativamente estáveis na maioria das circunstâncias e podem ser deixadas no banco por um longo tempo sem decomposição significativa. As reações nucleofílicas de abertura de anel de aziridina não ativadas ocorrem através da formação de íons aziridinium. A maioria das reações de aziridina a abertura de anel e transformações de anel prosseguem de uma maneira altamente regioquímica. No entanto, pouquíssimos relatórios de literatura discutem a preparação de aziridinas opticamente puras não ativadas com substituidores nas posições C2 ou C3 5,6.
Este artigo mostra a preparação bem sucedida de derivados quiral aziridine-2-carboxilato contendo α-metilbenzyl, especificamente (-)-mentholyl (1R)-fenilethylaziridine-2-carboxilatos como sua mistura diastereomeric, a partir da reação de 2,3-dibromopropionato e (1R)-feniltilamina. A partir desta mistura diastereomemérica, os esters enantiopure (1R)-feniltil-(2R)- e (2S)-aziridine-2-carboxilatos como seus ésteres (-)-mentholyl foram obtidos de forma opticamente pura por recrissartalização seletiva do MeOH e n-pentane em escalas de várias centenas de quilos (Figura 1)7. Estes ésteres (-)-mentholyl podem ser facilmente convertidos em seus ésteres etílicos ou metil por transesterificação na presença de magnésio ou carbonato de potássio7. Esses compostos também podem ser preparados facilmente em escala laboratorial a partir das reações de alquila 2,3-dibromopropionatos ou do triflate de vinil de α-cetester com quiral 2-feniltilamina seguida pela separação da mistura diastereomemérica usando cromatografia de coluna flash simples8.
Uma vez que tenhamos aziridina quiral enantiopure-2-carboxilato, podemos sintetizar várias reações de abertura de nitrogênio cíclico e acíclico com base em transformações funcionais de grupo de carboxilato e reações de abertura altamente regio-e estereoselétricas aziridina-anel 6,9,10. A primeira síntese assimétrica expediente foi aplicada para ambos os enantiomers de 5, 6-dihidrouracil-tipo produtos naturais marinhos biemamida B e D como potenciais inibidores TGF-β11,12. Em segundo lugar, a síntese diastereoselectiva de β-(aziridin-2-yl)-β-hidroxiles foi alcançada pela reação aldol mukaiyama de 1-(1-feniltil)-aziridine-2-carboxaldeído e vários silanes enol na presença de ZnCl2, em alto rendimento (>82%) com estereoseletividade quase perfeita (98:2 dr) através de um estado de transição controlado pela quelação. Estes foram utilizados para a síntese assimétrica de alcaloides epiallo-isomuscarina 13,14,15.
Protocol
Representative Results
Discussion
As aziridinas como heterociclos de três membros contendo nitrogênio têm um enorme potencial para marciais ou intermediários sintéticos para preparar moléculas orgânicas ricas em nitrogênio. Com base no grupo que leva ao nitrogênio do anel, eles são classificados como aziridinas “ativadas” e “não ativadas”, cuja reatividade química e seletividade são diferentes. No entanto, métodos muito limitados estão disponíveis para preparar esta valiosa aziridina de forma opticamente ativa.
<p class="jove_content…Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta pesquisa foi apoiada pela National Research Foundation of Korea (NRF-2020R1A2C1007102 e 2021R1A5A6002803) com o Centro para Novas Direções em Síntese Orgânica e um HufS Grant 2022.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

