Modellazione delle metastasi cerebrali mediante iniezione interna di cellule tumorali nell'arteria carotide
Summary
Le metastasi cerebrali sono una causa di grave morbilità e mortalità nei pazienti oncologici. La maggior parte dei modelli murini di metastasi cerebrali sono complicati da metastasi sistemiche che confondono l’analisi della mortalità e dei risultati dell’intervento terapeutico. Presentato qui è un protocollo per l’iniezione carotidea interna di cellule tumorali che produce tumori intracranici coerenti con tumori sistemici minimi.
Abstract
Le metastasi cerebrali sono una causa di grave morbilità e mortalità nei pazienti oncologici. Gli aspetti critici delle malattie metastatiche, come il complesso microambiente neurale e l’interazione delle cellule stromali, non possono essere completamente replicati con saggi in vitro ; Pertanto, i modelli animali sono fondamentali per studiare e comprendere gli effetti dell’intervento terapeutico. Tuttavia, la maggior parte dei metodi di xenotrapianto di tumori cerebrali non produce metastasi cerebrali in modo coerente in termini di lasso di tempo e carico tumorale. I modelli di metastasi cerebrali generati dall’iniezione intracardiaca di cellule tumorali possono provocare un carico tumorale extracranico non intenzionale e portare a morbilità e mortalità metastatiche non cerebrali. Sebbene l’iniezione intracranica di cellule tumorali possa limitare la formazione di tumori extracranici, ha diversi avvertimenti, come le cellule iniettate spesso formano una singola massa tumorale nel sito di iniezione, un elevato coinvolgimento leptomeningeo e danni alla vascolarizzazione cerebrale durante la penetrazione dell’ago. Questo protocollo descrive un modello murino di metastasi cerebrali generate dall’iniezione interna dell’arteria carotide. Questo metodo produce tumori intracranici in modo coerente senza il coinvolgimento di altri organi, consentendo la valutazione di agenti terapeutici per le metastasi cerebrali.
Introduction
Le metastasi cerebrali sono un tumore maligno prevalente associato a una prognosi molto sfavorevole 1,2. Lo standard di cura per i pazienti sottoposti a metastasi cerebrali è multimodale, costituito da neurochirurgia, radioterapia cerebrale completa e/o radiochirurgia stereotassica a seconda dello stato di salute generale dei pazienti, del carico di malattia extracranica e del numero e della posizione dei tumori nel cervello 3,4. I pazienti con un massimo di tre lesioni intracraniche sono eleggibili per la resezione chirurgica o la radiochirurgia stereotassica, mentre la radioterapia dell’intero cervello è raccomandata per i pazienti con lesioni multiple per evitare il rischio di infezione correlata alla chirurgia ed edema5. Tuttavia, la radioterapia dell’intero cervello può infliggere danni alle strutture cerebrali radiosensibili, contribuendo alla scarsa qualità della vita6.
La terapia sistemica è un approccio logico alternativo e non invasivo per il trattamento di pazienti con lesioni multiple7. Tuttavia, è meno considerato a causa della nozione di lunga data che le terapie sistemiche hanno scarsa efficacia perché la somministrazione passiva di farmaci citotossici attraverso il flusso sanguigno non può raggiungere livelli terapeutici nel cervello senza il rischio di tossicità pericolosa8. Questo paradigma sta iniziando a cambiare con la terapia sistemica recentemente approvata dalla Food and Drug Administration (FDA) degli Stati Uniti (tucatinib con trastuzumab e capecitabina indicato per metastasi cerebrali del carcinoma mammario HER2+)9,10,11,12 e l’aggiornamento delle linee guida per il trattamento per includere la considerazione delle opzioni di terapia sistemica per i pazienti con metastasi cerebrali13,14.
In questo contesto, gli sviluppi nel campo della terapia molecolare mirata, dell’immunoterapia e dei sistemi alternativi di somministrazione di farmaci, come un vettore di nanofarmaci mirato, possono potenzialmente superare le sfide del trattamento delle metastasi cerebrali15,16,17,18. Inoltre, sono in fase di studio anche approcci chimici e meccanici per migliorare la somministrazione di farmaci attraverso la permeabilizzazione della barriera cervello-tumore19,20. Per studiare e ottimizzare tali approcci in modo che siano adatti allo scopo, è fondamentale utilizzare modelli preclinici che non solo rispecchino la complessa fisiologia delle metastasi cerebrali, ma consentano anche un’analisi obiettiva della risposta intracranica ai farmaci.
In generale, gli attuali approcci per modellare le metastasi cerebrali in vivo coinvolgono l’iniezione intracardiaca (ventricolo sinistro), endovenosa (di solito vena della coda), intracranica o intracarotidea (arteria carotide comune) di cellule tumorali nei topi 21,22,23,24,25,26,27 . Oltre alle strategie di attecchimento tumorale, i modelli murini geneticamente modificati in cui la formazione del tumore è innescata dalla rimozione dei geni oncosoppressori o dall’attivazione di oncogeni sono utili per la modellazione del tumore. Tuttavia, solo pochi modelli murini geneticamente modificati sono segnalati per produrre tumori secondari e ancora meno che producono in modo affidabile metastasi cerebrali28,29,30.
I metodi di attecchimento come l’iniezione intracardiaca (ventricolo sinistro) e endovenosa (di solito vena della coda) imitano la diffusione sistemica del cancro. Questi modelli producono tipicamente lesioni in più organi (ad esempio, cervello, polmoni, fegato, reni, milza) a seconda del letto capillare che intrappola la maggior parte delle cellule tumorali durante il loro “primo passaggio” circolatorio31. Tuttavia, tassi incoerenti di attecchimento cerebrale richiederanno più animali per raggiungere la dimensione del campione per la potenza statistica desiderata. Il numero di cellule tumorali che alla fine si stabiliscono nel cervello attraverso questi metodi di iniezione intracardiaca e endovenosa è variabile. Quindi, il carico tumorale delle metastasi cerebrali può variare tra gli animali e la differenza di progressione può rendere difficile standardizzare la tempistica sperimentale e l’interpretazione dei risultati. Il carico tumorale extracranico può portare alla mortalità per metastasi non cerebrali, rendendo questi modelli inadatti per valutare l’efficacia intracranica. Le linee cellulari cervello-tropico sono state stabilite utilizzando processi artificiali di selezione clonale per ridurre l’insediamento extracranico, ma i tassi di assunzione sono stati incoerenti e il processo di selezione clonale può ridurre l’eterogeneità normalmente riscontrata nei tumori umani32.
I metodi di attecchimento specifici del cervello come l’iniezione intracranica e intracarotidea consentono una modellazione delle metastasi cerebrali più coerente ed efficiente. Nel metodo intracranico33, le cellule tumorali vengono tipicamente iniettate nella corteccia cerebrale frontale, che genera una crescita tumorale rapida e riproducibile con un basso coinvolgimento sistemico. Mentre la procedura è ben tollerata con bassa mortalità33, le avvertenze sono che si tratta di un approccio relativamente grezzo che introduce rapidamente un bolo (localizzato) di cellule nel cervello e non modella la patogenesi precoce delle metastasi cerebrali. L’ago danneggia la vascolarizzazione del tessuto cerebrale, che quindi causa infiammazione localizzata 5,34. Dall’esperienza, c’è una tendenza per l’iniezione di cellule tumorali al reflusso durante la rimozione dell’ago, portando al coinvolgimento leptomeningeo. In alternativa, il metodo intracarotideo trasporta le cellule nell’arteria carotide comune con microvascolarizzazione cerebrale come primo letto capillare da incontrare, modellando la sopravvivenza in circolazione, stravaso e colonizzazione24. In accordo con altri25, la nostra esperienza con questo metodo ha scoperto che può provocare tumori facciali a causa della consegna involontaria di cellule tumorali attraverso l’arteria carotide esterna ai letti capillari in questi tessuti (dati non pubblicati). È possibile prevenire i tumori facciali legando prima l’arteria carotide esterna prima dell’iniezione comune dell’arteria carotide (Figura 1). Nel resto dell’articolo, questo metodo è indicato come “iniezione interna di arteria carotide”. Per esperienza, il metodo di iniezione dell’arteria carotidea interna genera costantemente metastasi cerebrali con pochissimi eventi sistemici e ha avuto successo nel generare modelli di metastasi cerebrali di diversi tumori primari (ad esempio, melanoma, mammella e tumori polmonari) (Figura 1). Gli svantaggi sono che è tecnicamente impegnativo, richiede tempo, invasivo e richiede un’attenta ottimizzazione del numero di celle e una tempistica di monitoraggio. In sintesi, entrambi i metodi di iniezione intracranica e interna dell’arteria carotide producono modelli murini adatti a valutare l’impatto terapeutico sul beneficio di sopravvivenza correlato al tumore cerebrale.
Questo protocollo descrive il metodo di iniezione dell’arteria carotide interna per produrre un modello murino di metastasi cerebrali con quasi nessun coinvolgimento sistemico e quindi adatto per la valutazione preclinica della distribuzione dei farmaci e dell’efficacia delle terapie sperimentali.
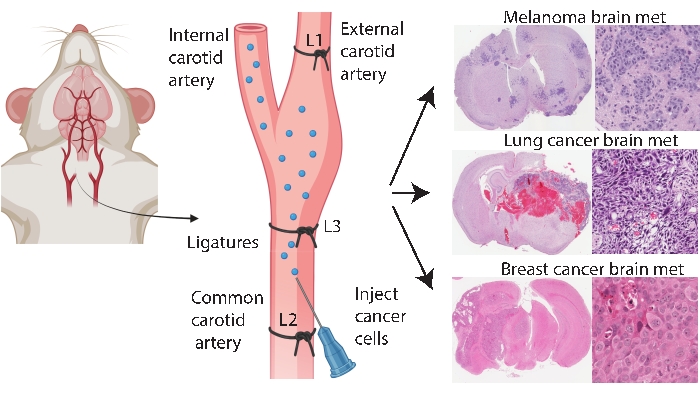
Figura 1: Rappresentazione schematica del protocollo di iniezione dell’arteria carotide interna per le metastasi cerebrali. L’iniezione interna dell’arteria carotide con legatura esterna dell’arteria carotide può produrre in modo affidabile un modello di metastasi cerebrale da vari tumori primari. In questo protocollo, tre legature sono posizionate sull’arteria carotide (annotate come L1-L3 nella figura). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
Le metastasi cerebrali sono un processo complesso di cellule tumorali che si diffondono dal loro sito primario al cervello. Sono disponibili diversi modelli animali che rispecchiano alcune fasi di questo processo a più fasi e ci sono considerazioni fisiologiche e pratiche per la progettazione di studi preclinici sulle metastasi41,42. La maggior parte degli studi pubblicati che studiano l’uso della nanomedicina per il trattamento delle metastasi cerebrali hanno u…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata finanziata dall’Australian National Health and Medical Research Council (NHMRC), numero di sovvenzione APP1162560. ML è stato finanziato da una borsa di studio di ricerca post-laurea UQ. Vorremmo ringraziare tutti coloro che hanno contribuito con la zootecnia e l’imaging in vivo degli animali. Ringraziamo il Royal Brisbane and Women’s Hospital per aver donato aliquote di zirconio per questo studio.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. 癌症研究. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. 癌症研究. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. 癌症研究. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

