זיהוי של חלבון פריון חריג על ידי אימונוהיסטוכימיה
Summary
תיוג חיסוני של חלבון פריון חריג באמצעות פרוטוקולים אימונוהיסטוכימיים דורש דגימה ספציפית ומתודולוגיות להכנת נוגדנים נגד PrP. הפרוטוקול הנוכחי מתאר את השלבים העיקריים בהסרת אפיטופים כדי להבטיח תיוג חיסוני תקין של PrP ולמזער כתמי רקע לא ספציפיים. כמו כן, גישה זו לוקחת בחשבון אמצעי בטיחות ביולוגית בעת ביצוע מחקרים אימונוהיסטוכימיים עם רקמות נגועות פריון.
Abstract
חלבוני פריון חריגים (PrPSc) הם איזופורם הקשור למחלה של חלבון פריון תאי וסמנים אבחנתיים של אנצפלופתיות ספוגיפורמיות מועברות (TSEs). מחלות נוירודגנרטיביות אלה פוגעות בבני אדם ובמספר מינים של בעלי חיים וכוללות סקראפי, אנצפלופתיה ספוגית זואונוטית של בקר (BSE), מחלת בזבוז כרונית של צוואר הרחם (CWD) ומחלת פריון הגמלים שזוהתה לאחרונה (CPD). אבחון TSEs מסתמך על זיהוי חיסוני של PrPSc על ידי יישום של שיטות אימונוהיסטוכימיה (IHC) ושיטות אימונובלוט מערביות (WB) על רקמות אנצפלון, כלומר, גזע המוח (רמת obex). IHC היא שיטה נפוצה המשתמשת בנוגדנים ראשוניים (חד שבטיים או רב-שבטיים) כנגד אנטיגנים בעלי עניין בתאים של חתך רקמה. ניתן לדמיין את קשירת הנוגדן-אנטיגן על ידי תגובת צבע שנשארת מקומית באזור הרקמה או התא שבו הנוגדן היה ממוקד. לכן, במחלות פריונים, כמו בתחומי מחקר אחרים, טכניקות האימונוהיסטוכימיה אינן משמשות אך ורק למטרות אבחון אלא גם במחקרי פתוגנזה. מחקרים כאלה כוללים זיהוי דפוסי PrPSc וסוגים מאלה שתוארו קודם לכן כדי לזהות את זני הפריונים החדשים. מכיוון ש- BSE יכול להדביק בני אדם, מומלץ להשתמש במתקנים ו / או שיטות מעבדה לבטיחות ביולוגית ברמה 3 (BSL-3) לטיפול בבקר, מעלי גירה קטנים ודגימות צוואר הרחם הכלולות במעקב TSE. בנוסף, מומלץ להכלה ולציוד ייעודי לפריון, במידת האפשר, כדי להגביל את הזיהום. הליך PrPSc IHC מורכב משלב פירוק אפיטופ חומצה פורמית הפועל גם כאמצעי לנטרול פריונים, מכיוון שרקמות קבועות פורמלין ומשובצות פרפין המשמשות בטכניקה זו נשארות זיהומיות. כאשר מפרשים את התוצאות, יש להקפיד להבחין בין תיוג חיסוני לא ספציפי לבין תיוג מטרה. למטרה זו, חשוב להכיר ממצאים של תיוג חיסוני המתקבלים בחיות בקרה ידועות של TSE שלילי כדי להבדיל בין אלה לבין סוגים ספציפיים של תיוג חיסוני PrPSc , אשר יכולים להשתנות בין זני TSE, מינים מארחים וגנוטיפ prnp , המתוארים בהמשך.
Introduction
על פי השערת הפריון, האיזופורם החריג (PrPSc) הוא המרכיב העיקרי, או היחיד, של הגורם הזיהומי באנצפלופתיות ספוגיפורמיות מועברות (TSEs). אישור לאבחון TSE מסתמך על זיהוי חיסוני של PrPSc על ידי יישום פרוטוקולים של אימונוהיסטוכימיה (IHC) ו / או שיטות אימונובלוט מערביות (WB) של רקמות אנצפלון1.
IHC היא שיטה המשתמשת בנוגדנים חד-שבטיים או, במקרים מסוימים, רב-שבטיים (כנוגדנים ראשוניים) כצעד ראשון בצביעת מערכת החיסון של אנטיגנים ממוקדים במיוחד הממוקמים בתאים של חתך רקמה. כל קשירת נוגדנים-אנטיגן ראשונית יעילה מומחשת לאחר מכן באמצעות נוגדנים משניים ספציפיים לנוגדנים הראשוניים. נוגדנים משניים אלה מצומדים לאנזימים, כגון חזרת פרוקסידאז (HRP) או פוספטאז אלקליין (AP). הדמיה מושגת לאחר מכן על ידי הוספת מצע לאנזימים אלה, המייצרים תוצרי צבע בלתי מסיסים הממוקמים באזורים שבהם הנוגדנים העיקריים קשורים לאנטיגנים הממוקדים. הדמיה משופרת יכולה להיות מושגת על ידי צביעה נגדית, שבו צבע משמש ליצירת ניגוד בין רקמה immunolabeled ולא immunolabeled2.
עם IHC באמצעות רקמות משובצות פרפין קבועות פורמלין (FFPE), קיבוע פורמלין יכול לבטל את היעילות של נוגדנים ראשוניים עקב קישור צולב על ידי פורמלדהיד וחימום והתייבשות במהלך הטמעת פרפין. אלה משנים את הקונפורמציה של חלבונים, הורסים או מסווים את האפיטופים, ובכך מפחיתים או מבטלים את זיהויים3. ככזה, זה דורש אחזור אנטיגן (AR). טכניקות המציאות הרבודה משבשות את הקישור הצולבות של קבוצות כימיות הקשורות לפורמלדהיד במולקולות האנטיגניות, ובכך משחזרות או חושפות את הקונפורמציה המקורית של אנטיגן-חלבון. התוצאה היא שחזור זיקת נוגדן-אנטיגן (אפיטופ) לתיוג חיסוני. היעילות הסופית של AR תלויה באיכויות של האנטיגן הממוקד ו / או הנוגדן העיקרי2.
אחזור אנטיגן (אפיטופ) המושרה בחום (HIER) הוא הליך אחד של AR3 ומשמש באופן שגרתי לזיהוי PrPSc IHC, כמתואר כאן. IHC חיוני לאבחון ומשמש במעבדות מחקר כדי לקבוע את התפלגות הרקמות של אנטיגן הקשור לפתולוגיה. הוא נמצא בשימוש נרחב באבחון ומחקר סרטן, מדעי המוח ומחלות זיהומיות4, בין היתר. עבור TSEs, IHC ממלא תפקיד חשוב באבחון ובמחקר לאישור וחקירה של התפלגות PrPSc במארחים טבעיים ובמודלים ניסיוניים. IHC תורם למחקרי פתוגנזה של פריונים ולניתוח סוגים ודפוסים של תצהיר PrPSc , כלומר ברקמות עצביות5, כדי לזהות סטיות מזיהומים המתוארים באופן שגרתי ולזהות זני פריונים חדשים לכאורה.
מכיוון שפריונים של אנצפלופתיה ספוגית בקר (BSE) יכולים להדביק בני אדם, פרוטוקולי מעבדה מסוימים המעורבים בעבודה עם BSE עשויים לדרוש שימוש במתקנים ובשיטות BSL-36. אלה כוללים שימוש במיכל משני אטום להובלת דגימות רקמה פוטנציאליות נגועות ב- BSE בתוך המכון והמעבדה. הוא כולל גם ייעוד אזורי הכלה וציוד ייעודי למחקר וניתוח BSE במידת האפשר. הדבר נעשה על מנת למנוע זיהום מחוץ לאזור העבודה ולספק חלל סגור מאחר ויש צורך בהליכי טיהור.
בהתאם לכך, המעבדה לפתולוגיה של INIAV עוקבת אחר מתקנים ושיטות עבודה מומלצים ברמת בטיחות ביולוגית 3 (BSL-3)6 לניהול דגימות פוטנציאליות נגועות בפריונים של רקמות מבקר, מעלי גירה קטנים וצווארים הקשורים למעקב TSE.
רקמות קבועות פורמלין ומשובצות פרפין הכלולות בהליכי אבחון או מחקר TSE, במיוחד במערכת העצבים המרכזית, עלולות להיות זיהומיות. לפיכך, רקמות קבועות אלה חייבות להיות מטופלות בחומצה פורמית כדי להפחית את ההדבקה של פריונים, אם קיימים, לפני עיבוד הרקמות. זה מבוצע על ידי הצבת רקמות קבועות, גזוז (כ 2-4 מ”מ עובי) בתוך קלטת עיבוד. לאחר מכן הקלטת טובלת ב-98% חומצה פורמית (למשך שעה). לאחר טבילה, הקלטות עם רקמות נשטפות במי ברז זורמים במשך 30 דקות, ומוחזרות לקיבוע לפני עיבוד נוסף. אם מקטעי הרקמה אינם מטופלים לפני העיבוד, יש לטבול קטעי רקמה פוסט-מיקרוטומיים בחומצה פורמית לא מדוללת למשך 5 דקות לפחות לפני צביעה היסטולוגית7. פרוטוקול IHC עבור PrPSc כולל שלב שגרתי של פירוק אפיטופ חומצה פורמית, המשמש גם לנטרול פריונים7. לאחר שלבי השבתת פריונים אלה, ניתן לעבד את הרקמות הקבועות המתקבלות ב- BSL-2 באמצעות שיטות BSL-2 סטנדרטיות.
דרישת דגימת הרקמה המינימלית לאבחון TSE בכל בעל חיים הכלול במעקב TSE היא איסוף גזע המוח (ברמת האובקס). בנוסף, עבור גילוי BSE לא טיפוסי ו scrapie, מומלץ כי חלק המוח הקטן צריך להיות גם לאסוף 1,8. לאבחון CWD, יש לבדוק הן את גזע המוח (obex) והן את בלוטות הלימפה הרטרופרינגיאליות מכיוון שניתן לזהות PrP Sc ברקמות לימפה ללא PrPSc ניתן לזיהוי ב- obex9, נסקר על ידי Machado et al.10.
החלק האובקס של גזע המוח כולל אתרי מטרה של TSE אבחנתיים, כלומר, הגרעין הווגאלי הגבי (DVN), גרעין דרכי הבידוד (STN) וגרעין דרכי השדרה של העצב הטריגמינלי (V). אזורים אלה מציגים באופן עקבי הצטברות PrPSc דו-צדדית, אפילו בשלבים המוקדמים של BSE וגירוד קלאסי. במקרים קליניים של TSE מתקדם, כל אזורי החומר האפור בגזע המוח מראים התפלגות PrPSc נרחבת11.
לפני החתך והעיבוד, דגימות המוח מוערכות (איור 1) כדי לוודא את רמת האוטוליזה ואת נוכחותו של נזק כלשהו לרקמות שעלול לסכן את התאמת הדגימה לאבחנה מאשרת מבוססת IHC8. כדי לאמת את שלמות פרוטוקולי ההכנה ואת התוצאות האנליטיות, דגימות הרקמה החיוביות והשליליות של TSE נכללות כבקרות בשילוב עם הכנת רקמות ממקרי בדיקה בכל בדיקה.
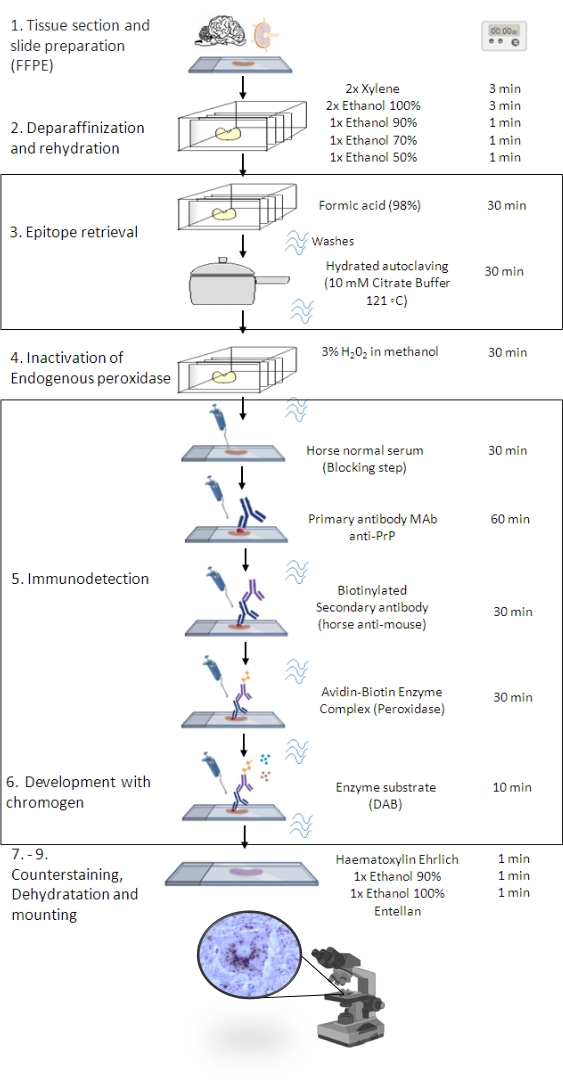
איור 1: נוהל PrPSc IHC. ייצוג המציג את הרצף שלב אחר שלב של הליך PrPSc IHC מדה-פרפיניזציה של חלקי רקמות ועד אימונוסטיין וזיהוי בסופו של דבר (FFPE – פורמלין-קבוע פרפין מוטבע; Mab – נוגדן חד שבטי; DAB – 3,3′ diaminobenzidine). דמות זו נוצרה בשנת BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
TSEs הן מחלות זואונוטיות פוטנציאליות. לאחר הופעתה של BSE בשנת 1986 בבריטניה, פורטוגל הפכה לאחת המדינות החברות באיחוד האירופי עם שכיחות גבוהה יותר של מחלה זו14,15. על מנת לשלוט במחלה זו, TSEs אחרים שהתפתחו (scrapie קלאסי ולא טיפוסי, גרסאות BSE, וכיום מעקב אחר מחלת בזבוז כרונ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
מאמר זה מומן על ידי פרויקט POCI-01-0145-FEDER-029947 “הערכת סיכון למחלות בזבוז כרוני בפורטוגל” הנתמך על ידי FCT (Fundação para a Ciência e a Tecnologia) – FEDER -Balcão2020. כמו כן, מחברי יחידת המחקר CECAV קיבלו מימון מה- FCT, במסגרת הפרויקט UIDB/CVT/0772/2020.אנו מודים לברוס קמפבל, מנהל מחקר (בדימוס), מרכז המחקר האזורי המערבי, USDA, על עזרתו.
Materials
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase |
Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use |
||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum |
Gibco |
16050-122 |
Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. |
||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. |
||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
References
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. – Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).

