Diffusion Tensor Magnetic Resonance Imaging in de analyse van neurodegeneratieve ziekten
Summary
Diffusion tensor imaging (DTI) fungeert in feite als een MRI-gebaseerde tool te identificeren<em> In vivo</em> De microstructuur van de hersenen en pathologische processen door neurologische stoornissen in de cerebrale witte stof. DTI-gebaseerde analyses zorgen voor toepassing van hersenziekten zowel op groepsniveau als in enkel onderwerp data.
Abstract
Diffusion tensor imaging (DTI) technieken geven informatie over de microstructurele processen van de cerebrale witte stof (WM) in vivo. De onderhavige toepassingen zijn ontworpen om verschillen in WM betrokkenheid patronen onderzoeken verschillende hersenaandoeningen bijzonder neurodegeneratieve aandoeningen, bij gebruik van verschillende DTI analyses vergeleken met gematchte controles.
DTI data-analyse wordt uitgevoerd in een variate mode, dwz voxelgewijze vergelijking van regionale diffusie richting gebaseerde metrics zoals fractionele anisotropie (FA), samen met fiber tracking (FT) vergezeld van tractwise fractionele anisotropie statistieken (TFA) op groepsniveau met het oog tot verschillen in FA langs WM structuren te identificeren, die gericht zijn op de vaststelling van het regionale patronen van WM wijzigingen op groepsniveau. Transformatie naar een stereotaxisch standaard ruimte is een voorwaarde voor groep studies en vereist een grondige verwerking van gegevens te behouden directional onderlinge afhankelijkheden. De huidige applicaties tonen geoptimaliseerd technische benaderingen voor dit behoud van kwantitatieve en directionele informatie tijdens ruimtelijke normalisatie in data-analyses op groepsniveau. Op basis hiervan kan FT technieken om informatie metrics kwantificeren gedefinieerd FT toegepast groeperen gemiddelde data. Bovendien, de toepassing van DTI methoden, dwz verschillen in FA-kaarten na stereotaxisch uitlijning, in een longitudinale analyse op individueel onderwerp basis onthullen informatie over de progressie van neurologische aandoeningen. Verdere kwaliteitsverbetering van DTI gebaseerde resultaten kunnen tijdens de voorbewerking worden verkregen door toepassing van een gecontroleerde uitschakeling van gradiënt richtingen met hoge geluidsniveaus.
Samengevat wordt DTI gebruikt om een afzonderlijke WM pathoanatomy verschillende hersenaandoeningen gedefinieerd door de combinatie van volledige hersenen-gebaseerd en kanaal gebaseerde DTI analyse.
Introduction
Diffusion tensor imaging in het menselijk brein
De witte stof (WM) stukken in het centrale zenuwstelsel bestaan uit dicht verpakt axons naast diverse soorten neuroglia en andere kleine populaties van cellen. De axonale membraan en de goed uitgelijnde eiwitvezels binnen een axon beperkt water diffusie loodrecht op de vezel oriëntatie, waardoor anisotrope diffusie van water in de hersenen WM 1. Myelineschede om de axonen kan ook bijdragen aan de anisotropie voor zowel intra-en extracellulair water 2.
De kwantitatieve beschrijving van deze anisotropie kan worden gedetecteerd door diffusie tensor imaging (DTI). DTI produceert beelden van weefsels gewogen met de lokale microstructurele eigenschappen van water diffusie. De beeld-intensiteiten op elke positie worden gedempt, afhankelijk van de sterkte en richting van de zogenaamde magnetische diffusiegradiënt (vertegenwoordigdde b-waarde), en op de lokale microstructuur waarin het water diffundeert 3, de diffusiecoëfficiënt D, een scalaire waarde:
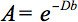
Echter, in de aanwezigheid van anisotropie in WM, diffusie niet meer gekenmerkt door een scalaire coëfficiënt, maar vereist een tensor  die in eerste benadering beschrijft moleculaire mobiliteit langs elke richting en de correlatie tussen deze richtingen 4. Diffusie anisotropie wordt voornamelijk veroorzaakt door de oriëntatie van de vezels traktaten in WM en wordt beïnvloed door de micro-en macrostructurele functies. Van de microstructuur, lijkt intraaxonal organisatie zijn de grootste invloed op de diffusie anisotropie, naast de dichtheid van een vezelnd cel verpakking, de mate van myelinisatie, en individuele vezel diameter. Op macroscopische schaal, de variabiliteit in de oriëntatie van alle WM traktaten in een imaging voxel beïnvloedt de mate van anisotropie 5.
die in eerste benadering beschrijft moleculaire mobiliteit langs elke richting en de correlatie tussen deze richtingen 4. Diffusie anisotropie wordt voornamelijk veroorzaakt door de oriëntatie van de vezels traktaten in WM en wordt beïnvloed door de micro-en macrostructurele functies. Van de microstructuur, lijkt intraaxonal organisatie zijn de grootste invloed op de diffusie anisotropie, naast de dichtheid van een vezelnd cel verpakking, de mate van myelinisatie, en individuele vezel diameter. Op macroscopische schaal, de variabiliteit in de oriëntatie van alle WM traktaten in een imaging voxel beïnvloedt de mate van anisotropie 5.
In typische DTI metingen de voxel afmetingen in de orde van millimeters. Zo kan een voxel bevat altijd de gemiddelde informatie van de watermoleculen in de gedetecteerde volume gewoonlijk verscheidene van axons en de omringende watermoleculen. Desondanks multidirectionele omgeving DTI gevoelig voor de oriëntatie van de grootste hoofdas die prima de overheersende axonale richting en bepaal de axonale bijdrage domineert het gemeten signaal 2.
DTI levert twee soorten informatie over de eigenschap van water diffusie: de eerste, de oriëntatie-onafhankelijke mate van diffusie anisotropie 5 en ten tweede, de overheersende richting van het water diffusie in image voxels, dat wil zeggen de diffusie oriëntatie 6.
De huidige protocollen worden verondersteld om een kader van DTI analysetechnieken bieden voor kwantitatieve vergelijking van groepen proefpersonen op groepsniveau, zoals beschreven in het volgende.
Kwantificering van diffusie-eigenschappen – analyse parameters
De elementen van de symmetrische tensor kan worden gemeten door diffusie gradiënten langs ten minste zes niet-collineaire en niet-coplanaire richtingen, zodat ter (vergelijking 1) is een tensor, waardoor signaalverzwakking
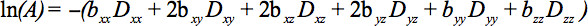
Deze vergelijking wordt bepaald dat een eventuele wisselwerking tussen beeldvorming en diffusie gradiënten die worden toegepast in orthogonale richtingen (kruis termen) en zelfs tussen beeldvorming hellingen die worden toegepastin orthogonale richtingen 4.
De tweede rang diffusion tensor  kan altijd worden diagonalized waardoor er slechts drie niet-nul elementen langs de hoofddiagonaal van de tensor, dwz de Eigenvalues (
kan altijd worden diagonalized waardoor er slechts drie niet-nul elementen langs de hoofddiagonaal van de tensor, dwz de Eigenvalues ( 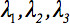 ). De Eigenwaarden weerspiegelen de vorm of configuratie van de ellipsoïde. De wiskundige relatie tussen de belangrijkste coördinaten van de ellipsoïde en het laboratorium frame wordt beschreven door de Eigenvectoren
). De Eigenwaarden weerspiegelen de vorm of configuratie van de ellipsoïde. De wiskundige relatie tussen de belangrijkste coördinaten van de ellipsoïde en het laboratorium frame wordt beschreven door de Eigenvectoren 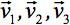
Aangezien er verschillende uitdagingen in het weergeven tensor data, heeft het concept van diffusie ellipsoïden voorgesteld 3. De Eigendiffusivities van deze ellipsoids vertegenwoordigen de eendimensionale diffusie coëfficiënten in de hoofdrichting van diffusiviteiten van het medium, namelijk de hoofdas van de ellipsoïde is de belangrijkste diffusie richting de voxel die samenvalt met de richting van de vezels, terwijl de excentriciteit van de ellipsoïde geeft informatie over de anisotropie en symmetrie. Daarom kon diffusie anisotropie metrics zoals de fractionele anisotropie (FA) worden gedefinieerd 7.
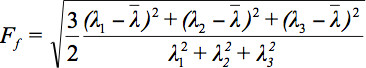
 is het rekenkundig gemiddelde van alle Eigenvalues.
is het rekenkundig gemiddelde van alle Eigenvalues.
Een extra aanpak is om de hoofdrichting van de diffusie tensor gebruiken om de WM-connectiviteit van de hersenen aan te pakken, wat overeenkomt met de tractografie approach die de intentie heeft om te onderzoeken welke delen van de hersenen zijn verbonden met elkaar. Aangenomen dat de oriëntatie van de belangrijkste component van de diffusie tensor is de oriëntatie van de dominante axonen is een 3-D vector veld waarin elke vector vertegenwoordigt de vezeloriëntatie. Momenteel zijn er verschillende benaderingen WM stukken die kunnen worden onderverdeeld in twee types reconstrueren: de eerste categorie is gebaseerd op regel propagatie algoritmes lokale tensor-informatie voor elke stap van de vezel darmkanaal voortplanting 2,8,9. De tweede categorie is gebaseerd op mondiale energieminimalisering de energetisch meest gunstige pad tussen twee WM regio, resulterend in de benadering van kanaal gebaseerde ruimtelijke statistiek voorbeeld (TBSS) 10 die is gebruikt in andere algoritmen zoals tractwise fractionele anisotropie statistieken (transvetzuren – zie protocol tekst, paragraaf 2.4)..
Transformatie naar stereotaxisch standard ruimte
Net als in andere geavanceerde MRI methoden DTI-en FT-gebaseerde studies in een klinische context nastreven uiteindelijke doel hersenmorfologie individuele patiënt categoriseren om het diagnostische proces gebaseerd op enkele discriminatie metrisch 11 vergemakkelijken. Studies op groepsniveau zijn relevantie als de gewone klinische fenotype wordt verondersteld door beschadiging van een of meer specifieke hersengebieden of specifieke neuroanatomische netwerk. Hier, met een gemiddelde van de resultaten voor de verschillende onderwerpen is nuttig om de gemeenschappelijke patronen van microstructurele veranderingen te beoordelen. Elk individu hersenen worden overgebracht in stereotaxische ruimte zodat in een tweede stap, het rekenkundig gemiddelde van de resultaten op een voxel-by-voxel niveau mogelijk. Ruimtelijke normalisatie toegestaan rekenkundige gemiddelden van de resultaten van verschillende onderwerpen teneinde de signaal-ruisverhouding (SNR) te verbeteren en een vergelijking van monsters van patiënten en cont voerenrols om de rekenkundige pathoanatomy van een bepaalde aandoening te analyseren, zoals een neurodegeneratieve ziekte die wordt geassocieerd met de ongunstige beïnvloeding van de hersenen een specifieke systeem.
De vroege aanpak van normalisering van een gestandaardiseerde stereotaxisch ruimte door 12 suggereerde een transformatie algoritme om een standaard atlas die de identificatie van de verschillende hersenen bezienswaardigheden en fragmentarische schaling van de hersenen kwadranten. Tegenwoordig zijn de meeste van de geavanceerde MRI data-analyse pakketten te gebruiken normalisatie op het Montreal Neurological Institute (MNI) stereotaxisch ruimte 13. Voor deze transformatie, werden halfautomatische en automatische brein registratie algoritmes behulp studie specifieke templates ontwikkeld 14,15. In DTI, bijzondere aandacht worden gevestigd op de directionele informatie tijdens het normalisatieproces 16,17 bewaren. De toepassing van ruimtelijke transformaties DT-MR beelden die nodig zijn voor ruimtelijke normalisatiewinning van datasets is, in tegenstelling tot kromtrekken scalaire beelden, bemoeilijkt doordat ODC bevatten orientatie informatie die weer wordt beïnvloed door de transformatie. Dit effect moet rekening worden gehouden met het oog op de anatomische correctheid van de getransformeerde afbeelding garanderen. Hier worden technieken voor het aanbrengen affine transformaties DTI datasets gepresenteerd.
Toepassing van DTI van hersenziekten
De vergelijking van longitudinale DTI data vereist een aanpassing / registratie van de gegevens een onderwerp's onder elkaar. In die context, het behoud van de directionele informatie is noodzakelijk (dwz rotatie van de diffusie tensor tijdens affiene transformaties). Mogelijke toepassingen van neurodegeneratieve stoornissen zijn eerder gerapporteerd (bv. 18,19).
DTI is opgericht als een robuust niet-invasieve technische hulpmiddel om te onderzoeken in vivo Neuropatholgie van WM neuronale traktaten (bijv. 11,20,21,22). DTI-gebaseerde kwantitatieve metrieken het diffusieproces, zoals de FA, al en gevoelig markers voor het bestuderen uiteenlopende WM aandoeningen, zoals beroerte 20, multiple sclerosis 23, amyotrofe laterale sclerose 24, 25, de ziekte van Alzheimer 26 , en diverse andere WM aandoeningen 27,28.
Daarnaast DTI met FT kunnen worden gebruikt WM stukken identificeren 23. Deze techniek, terwijl nog niet in routine klinisch gebruik, is in opkomst als een krachtig instrument voor de beoordeling van pathway-specifieke afwijkingen bij neurologische ziekte. Binnen de geïdentificeerde stukken, diverse kwantitatieve MRI indices afgeleid van DTI en aanvullende acquisities (bijv. T2-gewogen beelden en / of magnetiseringsoverdracht (MT) imaging) die anatomisch coregistered de DTI data kunnen worden gemeten. Hierbij kan elke index calcul zijnated als functie van de positie in het darmkanaal, verwijzend naar plots afbeelden hun ruimtelijke variatie darmkanaal profielen.
Hierna menselijke DTI scans die werden uitgevoerd op 1,5 Tesla MRI-scanners (Siemens Medical, Erlangen, Duitsland) werden gebruikt om de capaciteit van verschillende analysetechnieken voor detectie witte stof afwijkingen in patiëntengroepen en in individuen te onderzoeken. Na een geautomatiseerde kwaliteitscontrole voor de afschaffing van de motion-corrupte volumes en volumes met andere soorten van artefacten, gestandaardiseerde postprocessing procedures bereiden de DTI data voor de achtereenvolgende analyse. Verschillende analyse benaderingen worden geïllustreerd in de volgende, dwz de eerste, hele brein gebaseerd ruimtelijke statistiek (WBSS), tweede, FT, en de derde, Tractwise fractionele anisotropie statistieken (transvetzuren). WBSS is een methode die analoog aan voxel-gebaseerde morfometrie (VBM) die gewoonlijk bekend staat als voxel-gebaseerde morfometrie / statistieken DTI data (VBM / DTI) loopt <em>. VBM is een methode die oorspronkelijk uitgevoerd op contrastrijke beelden waarbij het contrast verschillen in afzonderlijke scans moet opgelost worden WBSS is een methode die de voxelgewijze vergelijking van de fysische parameter gebruikt. Daarom, hoewel algoritmisch dergelijke, een terminologie die differentiëren WBSS en VBM worden gebruikt in de volgende.
Protocol
Representative Results
Discussion
Interindividuele middeling van DTI data kan worden bereikt met betrekking tot diffusie amplitude (door het gebruik van informatie FA) en verspreiding richting (basis FT), respectievelijk. Middeling van FA kaarten maakt voor de statistische vergelijking van de groepen proefpersonen door WBSS en transvetzuren. Dit methodologisch kader geeft een inleiding tot DTI technieken met inter-subject middeling en groepsvergelijking. Stereotaxisch normalisering en vergelijking van de FA kaarten op groepsniveau mogelijk maakt voor ve…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Delen van dit werk, dwz de studie van een QC en de correctie voor beschadigde gradiëntrichtingen in toepassing om gegevens van patiënten met hyperkinetische stoornissen, werden gesteund door de Europese HD-netwerk (EHDN project 070). De MRI-scans in deze bepaalde studie werden verkregen als onderdeel van de London website TRACK-HD cohort.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
Referenzen
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

