Behavioral Phänotypisierung von murinen Krankheitsmodelle mit dem Integrated Behavioral Station (INBEST)
Summary
Längerer und umfassende Überwachung der Mäuse in einem Heim-Käfig-Umgebung bietet ein tieferes Verständnis für abweichendes Verhalten in Mausmodellen der Erkrankungen des Gehirns. Dieses Papier beschreibt die Integrated Behavioral Station (INBEST) als wesentlicher Bestandteil der modernen Verhaltensanalyse.
Abstract
Aufgrund der raschen Fortschritte in der Gentechnik, sind kleine Nagetiere werden die bevorzugten Themen in vielen Disziplinen der biomedizinischen Forschung. In Studien zur chronischen ZNS-Störungen, gibt es eine zunehmende Nachfrage nach murine Modelle mit hoher Validität auf der Verhaltensebene. Doch mehrere pathogenen Mechanismen sowie komplexe Funktionsdefizite oft zu verhängen Herausforderungen zuverlässig zu messen und zu interpretieren Verhalten chronisch kranker Mäuse. Daher erfolgt die Prüfung des peripheren Pathologie und einer Verhaltensprofil zu verschiedenen Zeitpunkten unter Verwendung einer Reihe von Tests erforderlich sind. Video-Tracking, Verhaltens-Spektroskopie und Remote-Übernahme von physiologischen Maßnahmen neue Technologien, die für eine umfassende, genaue und unvoreingenommene Verhaltensanalyse in einem Home-Base-ähnliche Einstellung zu ermöglichen. Dieser Bericht beschreibt eine raffinierte Phänotypisierung-Protokoll, das eine maßgeschneiderte Überwachungsvorrichtung (Integrated Behavioral Station, INBEST), die auf längere Messungen ba konzentriert beinhaltetsic Funktionsausgänge, wie spontane Aktivität, Futter- / Wasseraufnahme und motiviertes Verhalten in einer relativ stressfreien Umgebung. Technische und konzeptionelle Verbesserungen INBEST Design kann weiter zu fördern Reproduzierbarkeit und Standardisierung von Verhaltensstudien.
Introduction
Schnelle Fortschritte in der Gentechnik in den letzten Jahrzehnten eine beispiellose Vermehrung von Tiermodellen von Krankheiten des Menschen geführt. Mäuse haben den Status der primären Versuchspersonen in den biomedizinischen Wissenschaften aus mehreren Gründen gewonnen. Vom praktischen Standpunkt aus, sie haben eine hohe Wiedergabegeschwindigkeit, sind relativ preiswert und leicht zu beherbergen. Aus konzeptioneller Sicht sind sie genetisch nah an den Menschen, genetisch relativ leicht geändert werden, und haben hochentwickelte endokrine, Immunsystem und Nervensystem. Zusätzlich zu den Veränderungen auf genetischer und zellulärer Ebene, zeitgenössische Studien von Gehirn-Erkrankungen erfordern die Demonstration replizierbar funktionelle Defizite, dass Highlight Gesicht, konstruieren oder prognostische Validität eines neuen Mausmodell ein.
Die akute Infektion in einem Säuger homoeothermic oft zur fiebrige Reaktion, die zusammen mit Krankheitsverhalten, bildet eines derHauptüberlebensmechanismen 2. Akut kranke Tiere zeigen signifikante Veränderungen in Futter- / Wasseraufnahme und Leistung in Aufgaben reflektierende emotionaler Reaktivität Erkundungsverhalten und Lernen / Speicherkapazität. Diese Veränderungen weitgehend entfallen eingeschränkter sozialer / sexuelle Aktivität und die Erhaltung der Energie für defensive Immunreaktionen. Allerdings, wenn akuten Zuständen schalten chronischen (wie in vielen immunologischen, metabolischen und neurologischen Erkrankungen zu sehen ist), Verhaltensleistung kann weiter verschlechtern aufgrund struktureller Schäden verschiedener Organe, einschließlich des Gehirns 3.
Mensch und Tier neurodegenerativen Erkrankungen werden häufig von einer Konstellation von neurologischen und Verhaltensdefiziten einhergeht. Daher ist ein wesentliches Ziel in Verhaltensstudien von chronisch kranken Tieren zum zentralen Effekte aus den Defiziten durch periphere Symptome induzierten unterscheiden. , Begrenzt die collect jedoch die relativ kurze Dauer der Standard-VerhaltensaufgabenIonen von Informationen über die grundlegenden Funktions Maßnahmen wie Riechen, Ruhen, Schlafen, Futter- / Wasseraufnahme, oder epileptische Anfälle. Die Einbeziehung dieser Maßnahmen verbessert Verhaltensprofilierung und ermöglicht eine bessere Interpretation der Leistung in aktivitäts anspruchsvolle Aufgaben.
Ergebnis in verhaltens Phänotypisierung von erkrankten Mäusen
Die Unzulänglichkeiten bei der Beurteilung der Verhaltensprofil von kranken Mäusen haben die kontinuierliche Überwachung von einzeln untergebracht Mäusen durch schnelle Verarbeitungs PCs notwendig. Obwohl diverse Verhaltens Batterien kann so gestaltet werden 4, 5, die unten aufgeführt sind die Verfahren, die verwendet wurden, um ein Tiermodell für neuropsychiatrische Lupus 6 erfolgreich zu etablieren. Diese Batterie ist wiederholt in beiden subchronischen und chronischen Krankheitsmodelle (Abbildung 1), wie zum Beispiel milder kognitiver Beeinträchtigung und Alzheimer 7 angewendet. Nach einer Reihe von neurologischen Tests 8-10, acustom gemachte Vorrichtung entwickelt, um die oben genannten Anforderungen durch den Einsatz kontinuierlicher Überwachung mehrerer Verhaltens Ausgänge in angereicherter hauskäfigartigen Umgebung zu erfüllen, kann verwendet werden. Solch eine artgerechte basierten Ansatz für die Bewertung der spontanen Erkundungstätigkeit und motiviertes Verhalten bietet ein umfassenderes Verständnis von Leistungsdefiziten in anderen Paradigmen, wie sie repräsentativ für Lernen und Gedächtnis.
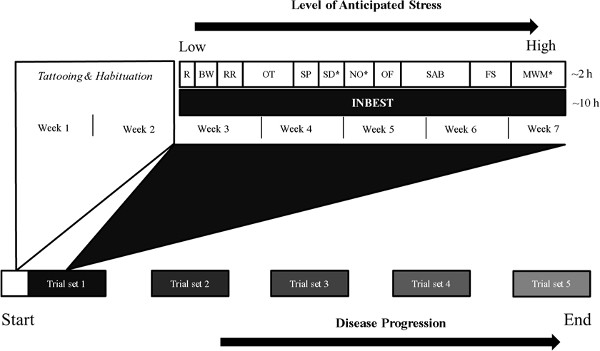
Abbildung 1 Schematische Darstellung der Längsverhaltens Phänotypisierung in unserem Labor. Die Verhaltens Batterie entworfen, um von Lessing Richtung mehr- belastenden Aufgaben, die zu verschiedenen Zeitpunkten wiederholt werden, um die Auswirkungen der anhaltenden Faktoren wie Krankheitsprogression zu beurteilen entwickeln, pharmakologische Behandlung oder immunologische Reaktionen. INBEST und einzelnen Tests werden während der dunklen p durchgeführthase, oft über 10 und 2 h zuge Abkürzungen:. R – Reflexe; BW – Strahl Gehen Test; RR – Rotarod; OT – Geruchstests; SP – Saccharose Vorlieben Test; SD – Step Down-Test; NEIN – Novel Objekt Tests; VON – Freifeldtest; SAB – Spontane Alter Verhalten; FS – Forced Swim-Test; MWM – Morris Wasser-Labyrinth. * – Aspekte des Tests (beispielsweise Standort, Kontext, Farbe, Form), die müssen in nachfolgenden Studien im gesamten Verlauf des Experiments geändert werden.
Kontinuierliche Videoaufzeichnung und Analyse des Verhaltens in einem Heim-käfigartigen Umgebung wurden erstmals im Jahr 2007 11 ausgewiesen. Eine komplexere automatische Vorrichtung, die Verhaltenstests in Studien mit autoimmunen Mäusen integriert wurde auf der "Messverhalten" ein Jahr später treffen vorgestellt 12. Die Integrated Behavioral Station (INBEST, 2A) ist ein modulares System, das comprises einer Unterkunft, computergesteuerte Lichtreiz, zwei Fotozelle lickometers (eine für Wasser, eine für eine Lösung von Interesse), eine automatische Futterspender, ein EDV-Laufrad und ein digitalisiertes Klettergitter. Latenzzeiten, Frequenzen und Dauern von spezifischen Verhaltensweisen sind mit kundenspezifischer Software untersucht. Bewegungs- und Erkundungstätigkeit (zB eines neuartigen Objekt oder einer fremden Artgenossen) mit Video-Tracking-Software (Liste der Werkstoffe / Ausrüstung) bewertet werden, während des Schlafes und weniger häufige Verhaltensmuster, wie selbstverletzendes Verhalten und Anfälle können manuell mit Video-Tracking-Software oder spezielle Ereignis-Aufzeichnung Pakete gewertet. Acht vollständige INBEST / Video-Einstellungen werden verwendet, so dass die gleichzeitige Überwachung von 4 Versuchs und 4 Kontrolltieren (2B).
<img alt="Abbildung 2" src="/files/ftp_upload/51524/51524fig2.jpg" />
Abbildung 2. Integrated Behavioral entfernt. (A) Schematische Darstellung der Hardware und Software bei der Gestaltung einer INBEST Feld (L = 39 x B = 53 x H = 50 cm) verwendet. (B) Acht vollständige INBEST Boxen bieten die Möglichkeit zur gleichzeitigen Heimkäfig Überwachung von vier experimentellen und vier Kontrollmäusen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Abhängige Variablen sind Messungen der Futter- / Wasseraufnahme, Reaktionsfähigkeit auf schmackhaftes Stimulation, spontane Bewegungsaktivität, Klettern, freiwillige Lauf, Angst-Verhalten (zB Erforschung von neuartigen Objekt), Körperpflege, Fressen und Schlafen. Darüber hinaus können visuelle Reize für die Konditionierung und Lernparadigmen vorgestellt. Die Vorteile INBEST über Standard-Verhaltenstests umfassen die Eliminierung von Störfaktoren Auswirkungen INDUCvon Transportbeanspruchungen sowie kontinuierliche, automatisierte Sammlung von Maßnahmen reflektierende der nächtlichen Aktivität, Erforschung, Angst-und depressive ähnlichen Verhaltensweisen ed. Die Integration von empfindlichen Hardwarekomponenten mit einem Videoverfolgungspaket liefert eine Vielzahl von Informationen, die eine verbesserte Beurteilung des Verhaltens in verschiedenen Tiermodellen ermöglicht in Bezug auf Progression von chronischer Krankheit. INBEST kann verwendet werden, um andere chronische Erkrankungen des ZNS (z, Autismus, schwerer Depression, Schizophrenie), als auch in Langzeitstudien mit Schwerpunkt auf die neurologische Entwicklung, Verhaltenswirkungen von systemischen / neoplastischen Erkrankungen und verlängert Pharmakotherapie untersuchen.
Protocol
Representative Results
Discussion
Der Nachweis von funktionellen Wirkungen bei Tieren hängt weitgehend von der Fähigkeit des Forschers die Variabilität inhärenten Verhaltensstudien begrenzen. Daher ist es wichtig, die Kontrolle und Minimierung der potentiellen minutiös verwechselt, die die Zuverlässigkeit und Reproduzierbarkeit der Verhaltensdaten verringern kann. Gleichzeitig ist es wichtig, zu erkennen, dass kein Test spiegelt eine einzelne Domäne des Verhaltens ist, dass das Wissen der neurologischen Funktion zwingend, und das Verhalten ist sehr empfindlich gegenüber externen Belastungen. Wenn die oben genannten Postulate geschätzt werden, kann man schließen, dass umfassende Verhaltensanalyse sollte den zeitlichen Verlauf der Reaktion gemessen sind, als auch, betreffen grundlegende funktionale Merkmale und Paradigmen, die Hahn in spezifische Verhaltensaspekte. Viele dieser Kriterien kann mit computergestützten Beurteilung der Bewegungen und Verhaltensakte in angereicherter hausKäfigUmgebung erfüllt werden.
Bisher war es emphasized, dass Verhaltens Phänotypisierung von Mausmodellen menschlicher Erkrankungen garantiert zusätzliche Überlegungen. Diese Auffassung beruht auf der Prämisse, dass funktionelle Homöostase wird durch interne und externe Stressoren während der Ausbruch der Krankheit in Frage basiert. Obwohl alle potenziellen verwechselt möglicherweise nicht durch die Einführung von automatisierten, haus Käfig Phänotypisierung beseitigt werden, sind Fragen der inkonsistenten Umwelteinstellungen, Transport Stress und wiederholtem Umgang minimiert. Diese deutliche Steigerung Konstanz und Präzision in allen Studien; sogar einer leichten Abnahme der Variabilität Nachweis der Auswirkungen von einer beginnenden Erkrankung induzierte verbessern. Tatsächlich bietet INBEST eine Fülle von Informationen, die eine genauere Beurteilung des Beginns, der Kinetik und der Schwere von Verhaltensänderungen, sowie wichtige Beziehungen zwischen verschiedenen krankheitsbedingten Verhaltensstörungen ermöglicht. Zuverlässigen Videoverfolgungs hängt von zwei Lichtverhältnissen. Zunächst wird diffuses Licht in den Testraum erforderlich, um zu verhindern,Artefakte aus dem nahe gelegenen reflektierenden Objekten. Zweitens kann eine hohe Farbkontrast, indem ein geeigneter Bodenfarbe, von der Subjektfarbe so viel wie möglich unterscheiden erreicht werden. In unserem Labor wird dies durch den Einsatz Flutlichter unter den INBEST Boxen und schwarzen Boden Schalen bei der Überwachung von Albinomäusen positioniert erreicht (weiß oder grau Hintergrund wäre es ausreichend, wenn die Prüfung pigmentierte Stämme). In Bezug auf die Ereignisaufzeichnung Aspekt INBEST die aktuelle Hardware-Einstellung (1 Piccolo-Grafikkarte mit 4 Eingängen) begrenzt 4 Boxen, gleichzeitig pro PC eingesetzt werden. Dies ist eine ziemlich kleine Anzahl von Boxen, während ein geeigneter Aufbau würde erfordern, 8 oder sogar 16 Käfige und somit 2 bzw. 4 PCs verbunden. Vorzugsweise kann INBEST kontinuierlich über 24 h als die Heimat-Käfig verwendet werden. Dies würde es Tiere in vollem Umfang in die Umgebung zu gewöhnen und zu etablieren stabile zirkadianen Verhaltensmuster, die unvoreingenommen analysiert werden kann. Computerdatenverlust durch Stromausfall, einer Dauerleistung so zu verhindernpply (oder zumindest eine unterbrechungsfreie Stromversorgung) muss gesichert sein. Schließlich, um die richtige Bewertung der täglichen Nahrungsaufnahme zu gewährleisten, ist darauf hinzuweisen, dass die Größe der Futterpellets sollte die Größe der Löcher in der Lebensmittelausgabegerät (die empfohlene Größe einer Futterpellet ist 20 mg) nicht übersteigt.
Es ist nicht zu übersehen ist jedoch, dass diese Analyse auch integrieren, wie verschiedene INBEST Maßnahmen können miteinander interagieren. Zum Beispiel Mäuse, die mehr Zeit im Laufrad verbringen dürften, größere Mengen an Nahrung und Wasser aufnehmen, um ihre erhöhte kalorische Anforderungen zu erfüllen. Ebenso kann Mäuse Einnahme mehr Saccharose-Lösung ihre Nahrungsaufnahme zu verringern. Die Interpretation dieser Ergebnisse kann ferner durch die allgemeine Verbesserung der Leistung über die Zeit schwierig sein, insbesondere im Hinblick auf das Verhalten und Laufrad Aktivität Ingestiv. Angesichts ihrer Incentive-Eigenschaften können Experimentatoren auch der Zugriff auf Saccharose-Lösung und t betrachtener Laufrad, um die Wahrscheinlichkeit postingestive Effekte und übermäßiger Gewichtsverlust bzw. entgegenzuwirken. Allerdings können diese Bedenken mehr relevant in einigen Stämmen als andere, weil verschiedene Stämme von Mäusen haben unterschiedliche Verhaltensprofile. Funktioniert zwar sowohl Grundlinie und experimentelle Bestimmung Steuerungen für viele der oben genannten Probleme, müssen Experimentatoren zu erkennen, dass diese Variablen müssen bei der Interpretation INBEST Daten genommen werden. Zur gleichen Zeit können einige Aspekte des Verhaltens nicht im Heimatkäfig Umwelt untersucht werden, was es muss eine Kombination mit Standard-Tests, um die Verhaltensprofil der Patienten zu beenden.
Computergesteuerte Überwachungs innerhalb standardisierte, aber flexible Umgebungen scheint der nächste logische Schritt in der heutigen Verhaltensanalyse sein. Eine solche nicht-invasive, ethologisch basierten Ansatz wird es den Forschern ermöglichen das gesamte Repertoire der Verhaltensantworten über einen längeren Zeitraum zu beobachten. Dieoretically, kann dies durch das Studium Verhalten in einem "virtuellen", angereichert Umgebung, die sehr ähnlich ist einen natürlichen Lebensraum durchgeführt werden. Mehrere Arbeitsgruppen Vision-basierte Tracking-Tools, die Verhaltens Phänotypisierung von Mäusen in ihren Heimatkäfig 22-25 unterstützt beschrieben, in Dyaden 26, 27, oder im Rahmen der großen gesellschaftlichen Gruppen 28. Hohe Genauigkeit und räumliche Auflösung kann durch Integration von Video-Nachführung mit Mikrochip-Technologie zum gleichzeitigen und synchronisierten Sammlung von Verhaltensdaten in einer Gruppe von Mäusen 28 erreicht werden. Wärmebildkameras zum Aufspüren von Wärme-Signaturen können mit implantierbaren Mikrochips oder Transponder kombiniert werden, um die relative Position und grundlegenden physiologischen Funktionen von jeder Maus (zB Körpertemperatur, Herz / Atemfrequenz) zu liefern. Darüber hinaus würde eine fortgeschrittene 3D-Tracking-System genauer und quantitative Erkennung von Verhaltens Handlungen zu produzieren. Um die wiederholte Ausführung einer variety von Tests, sollte ein solches System automatisiert werden, ferngesteuert, und modular. Beispielsweise kann das räumliche Gedächtnis in größeren Umgebungen durch die Programmierung der Erscheinung des distalen Hinweise auf LCD-Wände, oder durch die Vorlage / Ausblenden Spender mit schmackhaften Speisen aus beweglichen Böden untersucht werden. In ähnlicher Weise könnte eine neuartige Gegenstände präsentiert / zu bestimmten Zeitpunkten während der Studie ausgeblendet werden. Solche computergestützten Phänotypisierung kann bei der Aufklärung der genetischen Determinanten des Verhaltens, der pathogenen Mechanismen der Krankheitsmodellen und der Entwicklung neuer Therapiestrategien helfen. Wenn ein Konsens in Bezug auf Testbedingungen, Reihenfolge der Tests, sowie die Hard- und Software erreicht ist, kann man erwarten, dass lang erwartete Standardisierung würde Reproduzierbarkeit der Verhaltensstudien zu verbessern und zu erhöhen experimentellen Psychometrie auf ein neues Niveau.
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
This work was supported by an Ontario Mental Health Foundation grant to B.S, and an Ontario Graduate Scholarship to M.K.
Materials
| Power control interface operating package | Med Associates Inc. | MED-SYST-8 | Interface box and PCI card that manage all A/D data inputs and outputs |
| Stimulus light | Med Associates Inc. | ENV-221M | 28 V DC, 100 mA, 2.5 cm diameter light (for presentation of a conditioned stimulus) |
| Head entry detector | Med Associates Inc. | ENV-254-CB | Permits head entry detection into the pellet receptacle |
| Photobeam lickometer | Med Associates Inc. | ENV-351W | Infrared sensor system for detecting beam interception by snout |
| Food pellets | Bio-Serv | F0163 | Dustless precisions food pellets (20 mg rodent grain-based diet) |
| Food dispenser | Med Associates Inc. | ENV-203-20 | Automated food dispensing system consisting of elevated plastic container and dispensing tube |
| Food receptacle | Med Associates Inc. | ENV-303R2W | Infrared sensitive base to signal when food pellet is dispensed or collected |
| Climbing mesh | Med Associates Inc. | CT-Climbing mesh | Durable metal rungs, dimensions |
| Med PC IV software | Med Associates Inc. | SOF-735 | Integrates data acquisition from all electronic devices |
| MPC2XL v1.4 | Med Associates Inc. | SOF-731 | Raw data transfer utility |
| Soft CR Pro v1.05 | Med Associates Inc. | SOF-722 | Remote online monitoring software |
| Running wheel | Med Associates Inc. | CT-MSUB-ENV-3042-X1 | Activity wheel for mice |
| Digital counter | Med Associates Inc. | ESUB-ENV-3000 | LCD counter (4 counts = 1 revolution = 54.6 cm length) |
| Picolo Diligent frame grabber | Euresys | High-resolution PCI video capture card | |
| Ethovision XT 8.5 | Noldus Information Technology | Video-tracking software | |
| Camera | Panasonic | WV-BP334 | Digital, low-lux video camera suspended from a custom-made metal stand |
| Video Splitter | American Dynamics | ADQUAD87 | Integrates and digitizes inputs from 4 video cameras |
Referenzen
- Henn, F. A., McKinney, W. T., Meltzer, H. Y. Ch. 67. Psychopharmacology: The Third Generation of Progress . , 687-695 (1987).
- Hart, B. L. The behavior of sick animals. Vet. Clin. North Am. Small Anim. Pract. 21, 225-237 (1991).
- Kapadia, M., Sakic, B. Autoimmune and inflammatory mechanisms of CNS damage. Prog. Neurobiol. 95, 301-333 (2011).
- Rogers, D. C. Behavioral and functional analysis of mouse phenotype: SHIRPA, a proposed protocol for comprehensive phenotype assessment. Mamm. Genome. 8, 711-713 (1997).
- Moy, S. S. Mouse behavioral tasks relevant to autism: phenotypes of 10 inbred strains. Behav. Brain Res. 176, 4-20 (2007).
- Gulinello, M., Putterman, C. The MRL/lpr mouse strain as a model for neuropsychiatric systemic lupus erythematosus. J. Biomed. Biotechnol. 2011, 207504 (2011).
- Marchese, M. Autoimmune manifestations in the 3xTg-AD model of Alzheimer’s disease. J. Alzheimers. Dis. 39, 191-210 (2014).
- Sakic, B. A behavioral profile of autoimmune lupus-prone MRL mice. Brain Behav. Immun. 6, 265-285 (1992).
- Sakic, B., Szechtman, H., Denburg, S. D., Carbotte, R. M., Denburg, J. A. Spatial learning during the course of autoimmune disease in MRL mice. Behav. Brain Res. 54, 57-66 (1993).
- Sakic, B. Disturbed emotionality in autoimmune MRL-lpr mice. Physiol. Behav. 56, 609-617 (1994).
- Visser, L., van den Bos, R., Kuurman, W. W., Kas, M. J., Spruijt, B. M. Novel approach to the behavioural characterization of inbred mice: automated home cage observations. Genes Brain Behav. 5, 458-466 (2006).
- Sakic, B. The use of integrated behavioral station in chronic behavioral studies. Measuring Behavior. , 328 (2008).
- Shinzawa, K. Neuroaxonal dystrophy caused by group VIA phospholipase A2 deficiency in mice: a model of human neurodegenerative disease. J. Neurosci. 28, 2212-2220 (2008).
- Quintana, A., Kruse, S. E., Kapur, R. P., Sanz, E., Palmiter, R. D. Complex I deficiency due to loss of Ndufs4 in the brain results in progressive encephalopathy resembling Leigh syndrome. Proc. Natl. Acad. Sci. U. S. A. 107, 10996-11001 (2010).
- Irwin, S. Comprehensive observational assessment: Ia. A systematic, quantitative procedure for assessing the behavioral and physiologic state of the mouse. Psychopharmacologia. 13, 222-257 (1968).
- Crawley, J. N. . What’s Wrong With My Mouse?: Behavioral Phenotyping of Transgenic and Knockout Mice. , (2007).
- Feeney, D. M., Gonzales, A., Law, W. A. Amphetamine, haloperidol and experience interact to affect rate of recovery after motor cortex injury. Science. 217, 855-857 (1982).
- Stanley, J. L. The mouse beam walking assay offers improved sensitivity over the mouse rotarod in determining motor coordination deficits induced by benzodiazepines. J. Psychopharmacol. 19, 221-227 (2005).
- Gulinello, M., Chen, F., Dobrenis, K. Early deficits in motor coordination and cognitive dysfunction in a mouse model of the neurodegenerative lysosomal storage disorder, Sandhoff disease. Behav. Brain Res. 193, 315-319 (2008).
- Rustay, N. R., Wahlsten, D., Crabbe, J. C. Influence of task parameters on rotarod performance and sensitivity to ethanol in mice. Behav. Brain Res. 141, 237-249 (2003).
- Kapadia, M. Altered olfactory function in the MRL model of CNS lupus. Behav. Brain Res. 234, 303-311 (2012).
- Jhuang, H. Automated home-cage behavioural phenotyping of mice. Nat. Commun. 1, 68 (2010).
- Steele, A. D., Jackson, W. S., King, O. D., Lindquist, S. The power of automated high-resolution behavior analysis revealed by its application to mouse models of Huntington’s and prion. Proc. Natl. Acad. Sci. U. S. A. 104, 1983-1988 (2007).
- Zarringhalam, K. An open system for automatic home-cage behavioral analysis and its application to male and female mouse models of Huntington’s disease. Behav. Brain Res. 229, 216-225 (2012).
- Chaumont, F. Computerized video analysis of social interactions in mice. Nat. Methods. 9, 410-417 (2012).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: interactive machine learning for automatic annotation of animal behavior. Nat. Methods. 10, 64-67 (2013).
- Weissbrod, A. Automated long-term tracking and social behavioural phenotyping of animal colonies within a semi-natural environment. Nat. Commun. 4, 2018 (2013).

