Sürekli Vana Gape ölçümlerde Toxinler yumuşakçalar laboratuvar indüklenen Diel Bisiklete binme hipoksi ve pH yanıt için Ağırlık ölçme esneklik detektörler monitör (SGM)
Summary
Kabuklu süspansiyon-beslemek davranış yanıt çözünmüş oksijen gibi ortam değişkenleri için anlama bazı ekosistem süreçleri açıklayabilir. Bir ucuz, laboratuvar tabanlı, ağırlık ölçme esneklik detektörler monitör (SGM) Vana esnemek yanıt istiridye, Crassostrea virginica, ve ölçmek için diel Bisiklete binme hipoksi ve döngüsel pH için geliştirdik.
Abstract
Bir ucuz, laboratuvar tabanlı, ağırlık ölçme esneklik detektörler Vana esnemek monitör (SGM) yanıt diel Bisiklete binme hipoksi olarak kabuklu yumuşakçalar Vana esnemek davranışını izlemek için geliştirilmiştir. Wheatstone Köprüsü (Crassostrea virginica) istiridye kabukları için bağlı olduğunu gerginlik ölçme bağlı. Kaydedilen sinyalleri üzerinde sürekli olarak kaydedilecek açılış ve kapanış bivalvia için izin iki günlük süreler deneysel kaynaklı hipoksi diel Bisiklete binme ve pH değişiklikleri diel Bisiklete binme. Burada, bir ucuz ağırlık ölçme esneklik detektörler monitör geliştirmek için bir iletişim kuralı tanımlamak ve açıklamak, bir örnek Laboratuvar deney, vana esnemek davranışını ölçmek için kullandığımız nasıl Doğu yanıt olarak diel Bisiklete binme hipoksi (C. virginica), istiridye ve pH döngüsel değişiklikler. Vana esnemek döngüsel şiddetli hipoksik (0.6 mg/L) tabi istiridye üzerinde ölçülen çözünmüş oksijen koşulları ve pH, döngüsel hafif hipoksik (1.7 mg/L) koşulları ve normoxic (7,3 mg/L) koşulları döngüsel değişiklikler olmadan. Biz istiridye tekrarlanan diel döngüleri karşılaştığınızda, onlar hızla kabuklarından yanıt ağır hipoksi olarak kapatın ve hafif hipoksi için gecikme süresi ile yakın olduğunu göstermek. Normoxia geri yüklendiğinde, onlar hızla yeniden açın. İstiridye döngüsel pH koşulları ağır hipoksi Bisiklete binme diel üzerinde üst üste yanıt vermedi. Düşük oksijen koşulları, istiridye üçte biri aynı anda kapalı. Biz istiridye otelde bivalvia için davranışını değerlendirme çözünmüş oksijen dikkate alınması gerekir diel Bisiklete binme hipoksi için tepki göstermek. Vana SGM kabuklu yumuşakçalar yanıt çözünmüş oksijen veya kirletici değişiklikleri için değerlendirmek için kullanılabilir. Teknikleri daha iyi mühür için mühürleme Vana esnemek gerilim ölçerler deniz su sensörleri uzun ömürlü artırmak için daha fazla gelişme gerekir.
Introduction
Hipoksi, çözünmüş Yani, oksijen konsantrasyonları yeterince düşük olumsuz yönde etkileyecek biyolojik ve ekolojik süreçleri ama sık sık işlevsel olarak tanımlanır [< 2 mg / L1ve kanda oksijen azlığı mı] ([DO] olarak işlevsel olarak tanımlanmış 0.0-0.2 mg/L) daha sık ve ciddi bir şekilde dünyanın kıyı sularında, haliçler ve derin okyanus2,3 görülür ve genellikle Ötrofikasyon4,5artırarak şiddetlenir. Artan bir alansal ölçüde hipoksi ve kanda oksijen azlığı ile macrofauna olumsuz etkilenir ve habitat ölçüde ve yaşam kalitesi kaybetmek. İklim değişikliği hipoksi ve kanda oksijen azlığı6daha da kötüye tahmin edilmektedir.
Chesapeake Körfezi, ABD gibi pek çok tabakalı, besin zenginleştirilmiş haliçler mevsimsel kalıcı hipoksi hakim olabilir ve2yıl sonra oluşabilir. Buna ek olarak, diel Bisiklete binme hipoksi, haliçler Chesapeake Körfezi ve başka yerlerde gibi sık biridir ve geç gece veya sabah erken saatlerde yaz7,8sırasında ortaya çıkar.
Çoğu çalışmalar etkisi [DO] düşük organizmaların sürekli maruz kalma ve onların hoşgörü hipoksi ve kanda oksijen azlığı9,10,11,12,13,14 odaklanmıştır . Ayrıca, çalışmalar baktı türler dağılımları, zenginliği ve tür kompozisyonu genişletilmiş düşük [DO]4,15yanıt olarak büyük ölçekli vardiyada. Düşük kitleler, DO ölmeyi çok hassas olan kez türler üzerinde Louisiana-Texas raf ekosistem4bulundu kalan türler olarak, örneğin, bir genç, daha küçük boyutlu, kısa ömürlü fauna için değişen16 .
Davranış değişiklikleri genellikle toplum Daralt17 koyun ve çalışmalar üzerinde genişletilmiş düşük [DO]4,16,17,18,19 organizmaların davranışsal yanıt bildirdin ,20,21,22,23,24,25. Bu çalışmalar, organizmalar diel Bisiklete binme pozlama, hipoksi ve haliçler [DO] durumu dalgalanan doğası için yanıt ancak, odaklanmak değil.
Çalışmalar [daha fazlasını] monitör olarak Diel Bisiklete binme hipoksi sığ nehir içinde artan farkındalık sık haliçler16,26sondes ile gün boyunca aldı. Su kalır hipoksik saat gecenin sonunda veya sabah erken saatlerde yaz aylarında olduğunda hiç oksijen üreten fotosentez gece ama yüksek oksijen tüketen sırasında aerobik solunum7,16. Bu da gelgit diel etkilenen bulundu en aşırı minima ile düşük koşullardan Bisiklete binme gözlenen ne zaman düşük gelgit gece27sonu ile aynı zamana denk geldi. [DO] hipoksi, birkaç saat sonra geri gelmek için normoxia7,16,28 günlük döngüsünde.
C. virginica davranışsal yanıt biz izlenen açýlýþ ve kapanýþ laboratuvara maruz istiridye kapakların diel Bisiklete binme hipoksi ve pH olarak belirlemek için diel [do] Bisiklete binme ve döngüsel indüklenen pH. Esnemek yanıt bivalvia bir olumsuz çevre koşulları algılamak için kullanılmaktadır. Vana kilitler bivalvia kirletici madde29,30,31, toksik yosun32,33,34, termal kirlilik35,36 yanıt olarak , 37, gıda miktarı azaltırsanız beslenme rejimi39,41, emersion37,42, photoperiod43 38,39,40, , 44, pH45,46ve kombine pH ve çözünmüş oksijen47 ölçülen var. Esnemek teknikleri Örneğin, doğrudan gözlem48,49,13, reed anahtarları ve mıknatıslar (Dreissena İzleyicisi)50veya fiber optik sensörleri kullanarak sürekli ölçüleri eklemiş temiz su gerektiren 51 . Buna ek olarak, mıknatıs ve manyetik alan gücü Hall sensörleri midye esnemek açı52,53,54,55ve yüksek frekanslı elektromanyetik indüksiyon sistemi çalışmaya kullanılmıştır ölçü vanaları yapıştırılmış iki elektrik bobinleri arasında değişen mesafe olmuştur56,57,58,59kullanılır. Elektromanyetik indüksiyon sistemi için gerekli bir yüksek gerilim kaynağıdır ve güç Kabuk52iki tarafa da teslim edilecek. Bu sistem aynı zamanda “MOSSELMONITOR” (http://mosselmonitor.nl/) ticari olarak kullanılabilir.
Sıkı araştırma bütçe üzerinde Laboratuvar kaynaklı diel üzerinde bir ucuz ağırlık ölçme esneklik detektörler monitör (SGM) sürekli istiridye esnemek ölçmek için inşa [DO] bisiklet ve pH, düşük görünürlük koşullar altında. Sistemimiz de çok rakip sistemleri, birçok hayvan deney sırasında Enstrümante izin daha kolaydır. C. virginica davranışsal yanıt diel şiddetli Bisiklete binme için belirlemek istedim (= 0.6 mg/L) hipoksi denetim pH ile (pH 7.8 =) ve Bisiklete binme pH (pH 7.8-7.0 =), sırasıyla ve hafif esnemek yanıt (= 1.7 mg/L) hipoksi. Ayrıca, istiridye hızla diel döngüsü ve normoxia hipoksik bir olaydan sonra döndüğünde nasıl yanıt değişikliklere yanıt veremiyoruz olup olmadığını belirlemek istedim. Belki de istiridye yaşadıkları en iyi şekilde birçok haliçler16,27 ‘ bulundu hızla dalgalanan çevreye adapte olmuşlardır. Daha karmaşık Vana esnemek monitörler mevcut olmakla birlikte, SGM Vana esnemek sularda sürekli ölçümleri sağlayan düşük görünürlük koşullarda bile ucuz bir teknik sunar.
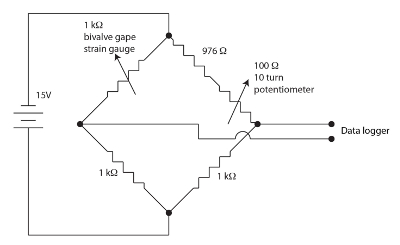
Şekil 1. Vana esnemek aygıtı Wheatstone Köprüsü. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Kabuklu esnemek izlemek için kullanılan ağırlık ölçme esneklik detektörler sensörler üzerinde yedekleme polimid menderes desende rezistif filmleri vardır. Küçük miktarlarda büyük yük sensörü dayanıklılığını modüle. Ne zaman bir değişiklik Sensör direnci neden gapes Toxinler strain gage şişiriyor. Kabuklu her kanal için geçersiz, dengeli, Wheatstone Köprüsü değişikliği Sensör direnci ölçmek için Şekil 1 ‘ de gösterildiği gibi çalıştırmaya başladık. Wheatstone Köprüsü datalogger tarafından istihdam edilecek oldukça yüksek bir kazanç sağlayan potansiyometre tarafından nulled. Wheatstone Köprüsü doğru bir oranı bilinen direniş standart ve bir voltmetre kullanarak bilinmeyen bir direnci ölçmek için standart bir yöntemdir. Bu çok eski teknik tarihinin Ekelof (2001)60içinde ele alınmıştır. Ağırlık ölçme esneklik detektörler monitör (SGM) birim içine 12 kanal, her biri kendi Wheatstone Köprüsü ve geçersiz potansiyometre ile entegre.
Protocol
Representative Results
Discussion
Tipik çalışmalar odak sürekli, düşük oksijen koşulları, süreler ve çoğu zaman hayvanlar hayatta kalma ifade yanıt, genişletilmiş. Ancak, şu anda, bizim hayvan davranış yanıt hipoksi diel Bisiklete binme için en az63anlaşılmasıdır. Böylece, daha fazla çalışmaları birçok haliçler7,8yaz boyunca düzenli olarak gerçekleşen diel Bisiklete binme hipoksi yanıt organizmalarda davranışları üzerinde odaklanmalı…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
İstiridye ve fotoğraf çekmek ve ImageJ onların esnemek genişlik ölçme için Melinda Forseth teşekkür ederiz. Biz bisiklet hipoksi ve döngüsel pH koşulları diel ile erişim akvaryumlar için Denise Breitburg teşekkür. Smithsonian çevre Araştırma Merkezi, Edgewater, Maryland, deneyler için alan için teşekkür ediyoruz. Hipoksi deneyler bir Ulusal Okyanus ve Atmosfer İdaresi – sponsorluğunda kıyı okyanus araştırma bursu için Merkezi No finanse edilmiştir NA10NOS4780138 ve Denise Breitburg Smithsonian Hunterdon Fonu’na. Vana gape ölçümler sırasında hipoksi deneyler bir öğretim geliştirme hibe Elka T. Porter üniversiteye Washington tarafından finanse edilmiştir.
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
Referenzen
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

