Laserinduzierte Fluoreszenzemission (L.I.F.E.) als neuartiges nichtinvasives Werkzeug zur In-Situ-Messung von Biomarkern in kryosphärischen Lebensräumen
Summary
Kohlenstoffflüsse in der Kryosphäre sind noch kaum bewertet, aber entscheidend für den Klimawandel. Hier zeigen wir ein neuartiges Prototypgerät, das das phototrophe Potenzial in supraglazialen Umgebungen auf Basis laserinduzierter Fluoreszenzemission (L.I.F.E.) mit Daten mit hoher spektraler und räumlicher Auflösung unter in situ-Bedingungen erfasst.
Abstract
Die globale Erwärmung wirkt sich auf mikrobielle Gemeinschaften in einer Vielzahl von Ökosystemen aus, insbesondere in kryosphärischen Lebensräumen. Über mikrobielle Kohlenstoffflüsse in extremen Umgebungen ist jedoch wenig bekannt. Daher impliziert die in den wenigen verfügbaren Studien beschriebene Methodik der Stichprobenerfassung zwei Hauptprobleme: A) Daten mit hoher Auflösung erfordern eine große Anzahl von Proben, was in abgelegenen Gebieten nur schwer zu erhalten ist; B) unvermeidbare Probenmanipulationen wie Schneiden, Sägen und Schmelzen von Eiskernen, was zu einem Missverständnis der In-situ-Bedingungen führt. In dieser Studie wird ein Prototyp-Gerät vorgestellt, das weder Probenvorbereitung noch Probenzerstörung erfordert. Das Gerät kann für In-situ-Messungen mit hoher spektraler und räumlicher Auflösung in terrestrischen und Eisökosystemen eingesetzt werden und basiert auf der Laser-Induced Fluorescence EMission (L.I.F.E.) Technik. Photoautotrophe supraglaziale Gemeinschaften können durch den Nachweis von L.I.F.E.-Signaturen in Photopigmenten identifiziert werden. Die L.I.F.E.-Instrumentenkalibrierung für die Porphyrinderivate Chlorophylla (chla) (405 nm Laseranregung) und B-Phycoerythrin (B-PE) (532 nm Laseranregung) wird demonstriert. Für die Validierung dieser Methodik wurden l.I.F.E.-Daten mit einer konventionellen Methode zurChl-Quantifizierung ratifiziert, die die Pigmentextraktion und die anschließende Absorptionsspektroskopie umfasste. Der Prototyp der Anwendbarkeit im Feld wurde in extrem polaren Umgebungen nachgewiesen. Weitere Tests an terrestrischen Lebensräumen fanden während der Mars-Analogsimulationen im marokkanischen Dessert und auf einem österreichischen Felsengletscher statt. Das L.I.F.E.-Instrument ermöglicht hochauflösende Scans großer Flächen mit akzeptabler Betriebslogistik und trägt zu einem besseren Verständnis des ökologischen Potenzials supraglazialer Gemeinschaften im Kontext des globalen Wandels bei.
Introduction
Die Kryosphäre beherbergt Meereis, Gletscher, Hochgebirgsseen, Schneegebiete, Seeeis, Schmelzwasserströme und Permafrost. Diese Gebiete bedecken etwa 11% der Landmassen der Erde1,2 und werden von der Atmosphäre als anerkannte kryosphärische Umgebung überförmig. Jüngste Studien zeigen, dass sich massive Bereiche der Kryosphäre schnell zurückziehen3,4. Die Antarktis5,6, die Alpen7, die Arktis8 undandere Regionen weisen negative Eismassenbilanzen auf. Der Rückzug von Eiskappen und Gletschern führt zur Erschöpfung unseres größten Süßwasserreservoirs der Erde. In einigen Gebieten ist der Gletscherrückzug unaufhaltsam5.
Lange Zeit galten Eisökosysteme als sterile Umgebungen. Trotz rauer Bedingungen ist das Vorhandensein von aktivem Leben in der Kryosphäre der Erde jedoch offensichtlich9,10,11,12,13,14,15 . Aufgrund des Trends zu massiven Eisverlusten durch Schmelzen durchläuft die Kryosphäre eine Verschiebung der biologischen Aktivität, die sich auf benachbarte Lebensräume auswirkt. Um diese teilweise irreversiblen Veränderungen zu verstehen, benötigen wir Methoden, um biologische Aktivität im Eis unter In-situ-Bedingungen mit hoher räumlicher und zeitlicher Auflösung zu untersuchen.
In supraglazialen Umgebungen findet man Leben in Kryokonitlöchern, Schneedecken, geschmolzenem Wasser, Bächen und auf nackten Eisflächen. Die offensichtlichsten supraglazialen Lebensräume sind jedoch Kryokonitlöcher. Sie erscheinen weltweit in vergletscherten Umgebungen und wurden erstmals vom schwedischen Entdecker Adolf Erik Nordenskjold während einer Expedition nach Grönland in den 1870er Jahren16,17beschrieben. Der Name leitet sich von den griechischen Wörtern “kryos” (kalt) und “konia” (Staub) ab. Äolische-abgeleitete dunkle organische und anorganische Ablagerungen befestigen sich auf der Eisoberfläche und reduzieren die Albedo lokal. Die Sonneneinstrahlung fördert das Schmelzen der Trümmer in tiefere Eisschichten und bildet zylindrische Becken mit Sediment (Kryokonit) im Boden9. Kryokonitlöcher decken 0,1–10% der Gletscherablationszonen11ab.
Kryokonit-Gemeinschaften bestehen aus Viren, Pilzen, Bakterien, Cyanobakterien, Mikroalgen und Protozoen. Je nach Region können auch metazoische Organismen wie Färsen, Nematoden, Copepoden, Tardigrade und Insektenlarven gefunden werden. Edwards und andere18 beschreiben Kryokonitenlöcher als “eiskalte Hotspots”. Sie verfolgten auch funktionelle Gene in Kryokonitlöchern, die für N, Fe, S und P Radfahren verantwortlich sind. Die Mini-See-Ökosysteme atmen und photosynthetisieren mit Raten in viel wärmeren und nährstoffreicheren Lebensräumen11. Diese Ergebnisse unterstreichen die wichtige Rolle der mikrobiellen Sequestrierung in supraglazialen Umgebungen. Neben lebenden Gemeinschaften in Kryokonitlöchern werden nackte Eisflächen von Eisalgen bewohnt. Ihre Physiologie ist gut untersucht19 aber ihre räumliche Verteilung wurde nicht bewertet20. Ihre Anwesenheit in supraglazialen Umgebungen verringert die Albedo und fördert damit das Schmelzen, das zu einer Nährstoffaushuntung und Nährstoffeintrag in nachgelagerte Lebensräume führt9. Steigende Temperaturen und damit eine höhere Verfügbarkeit von flüssigem Wasser beeinflussen die Netto-Ökosystemproduktivität in diesen eisigen Ökosystemen.
In supraglazialen Umgebungen wandeln photosynthetisch aktive Organismen anorganischen Kohlenstoff und Stickstoff in organische, verfügbare Quellen für das mikrobielle Nahrungsnetz21,22um. Bisher gibt es nur wenige Studien, die supraglaziale Kohlenstoffflüsse11,20,23” schätzen. Die Diskrepanz bei den vorgeschlagenen Co2-Flussraten resultiert aus einer geringen räumlichen und zeitlichen Datenauflösung. Darüber hinaus wird die räumliche Verteilung supraglazialer Gemeinschaften außerhalb von Kryokonitlöchern kaum beurteilt. Cook undandere 20 sagten in ihren Modellen voraus, dass supraglaziale Algengemeinschaften aufgrund ihrer großen Oberflächenabdeckung bis zu 11-fach mehr Kohlenstoff fixieren als zeitgenössische Kryokonitlöcher. Der Nachweis supraglazialer Algengemeinschaften, die die Probenintegrität gewährleisten, wird aufgrund fehlender Werkzeuge zur In-situ-Erkennung und Quantifizierung immer noch behindert.
Als Reaktion auf logistische Schwierigkeiten werden Eisökosysteme seltener untersucht als Lebensräume in gemäßigten Gebieten. Die Datenauflösung hängt von der Anzahl der bewerteten Proben ab und hängt von der Zugänglichkeit der Studienstandorte ab. Standard-Probenahmeverfahren wie Sägen, Koringen und anschließendes Schmelzen beinhalten eine Manipulation der mikrobiellen Gemeinschaft. Beispielsweise ist eine Chlorophyll-a-Bewertung in Festisproben mit Standardmethoden ohne wesentliche Eingriffe nicht möglich. Daher sind schmelzinduzierte Temperaturänderungen innerhalb der untersuchten mikrobiellen Gemeinschaften unvermeidbar. Als Reaktion auf die Thermolität des Photosystems II und anderer zellulärer Strukturen bei Psychrononen22führen Laboranalysen von geschmolzenen Eisproben immer zu einer Verfälschung von In-situ-Bedingungen.
Zerstörungsfreie In-situ-Messungen sind der einzig vernünftige Weg, um zuverlässige Daten zu erhalten. Dieses Ziel kann mit fluoreszenzbasierten Methoden erreicht werden. Aufgrund ihrer leichten Erntefunktion sind chla und B-Phycoerythrin (B-PE) in Organismen vorhanden, die zum Kohlenstoffkreislauf in supraglazialen Umgebungen beitragen, wie Von Anesio und anderen11nachgewiesen wurde. Daher sind diese fluoreszierenden Moleküle geeignete Biomarker für die Quantifizierung mikrobiellen vermittelten Kohlenstoffflüsse in Eisökosystemen.
In dieser Studie stellen wir die Entwicklung, Kalibrierung und Anwendbarkeit eines neuartigen nicht-invasiven Werkzeugs zur In-situ-Quantifizierung von chla- und B-PE-Molekülen in terrestrischen und Eisökosystemen vor. Das Prototypgerät basiert auf laserinduzierter Fluoreszenzemission, auch bekannt als L.I.F.E. Das optische Instrument (Abbildung 1) erfasst fluoreszierende Biomarker-Signaturen nach laserinduzierter Fluoreszenzerregung. Das Verfahren ist zerstörungsfrei und kann am Studienort oder im Labor durchgeführt werden.
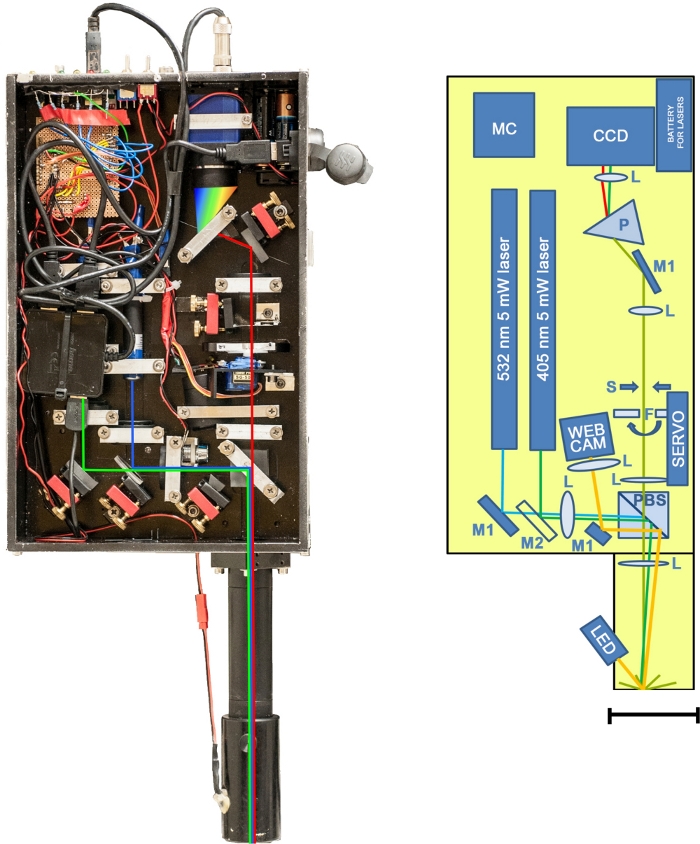
Abbildung 1: Der L.I.F.E.-Prototyp. Links: Foto des Instruments ohne Schutzdeckel. Rechts: Schematische Darstellung des Instruments. Gesamtmasse = 5,4 kg (Laser und Optik = 4,025 kg, Laptop = 1,37 kg). Aluminiumrahmen = 32,5 cm x 20,3 cm x 6,5 cm. Optisches Rohr: 18,4 cm x 4 cm (Durchmesser). CCD: bluefox mv220g Sensor; F: servogesteuerte Langpassfilter (450 nm und 550 nm); L: optische Linsen; M1: Spiegel; M2: dichroitischer Spiegel; MC: Mikrocontroller; P: Prisma; PBS: polarisierender Strahlteiler; S: Schlitzöffnung aus verstellbaren Rasierklingen. Maßstabsleiste = 70 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Das tragbare Dual-Wellenlängen-Kit wiegt 4,5 kg und wird auf einem Stativ in Kombination mit einem externen Computer verwendet. Die Feldeinrichtung ist schnell und einfach. Das Gerät ist am Stativ befestigt, und das Linsenrohr wird zusammen mit einem USB-Kabel und dem Kamerakabel am Gerät befestigt. Der externe Computer ist über ein USB-Kabel mit dem Gerät verbunden. Die Stativbeine sind so eingestellt, dass das Linsenrohr auf die Probe gerichtet ist und die Probe bedeckt. Dann trifft ein 5 mW grüner Laser die Probe, nachdem er einen polarisierenden Strahlsplitter passiert hat, der polarisiertes Licht in Richtung der optischen Achse des Spektrometers umleitet. Die Probe zeigt ein fluoreszierendes Licht, rot in Abbildung 1dargestellt. Die Hälfte des kollimierten Lichts passiert den polarisierenden Strahlteiler und wird durch einen servogesteuerten Langpassfilter fokussiert, der die Lasersignale entfernt. Als nächstes trifft das Signal auf einen Blendenschlitz, der aus zwei verstellbaren Rasierklingen besteht. Ein Prisma trennt die feine Linie des orthogonalen Lichts spektral von der Schlitzöffnung, bevor das Signal vom Sensor erfasst wird. Das Verfahren wird mit einem blauen Laser wiederholt. Die Rohdaten werden automatisch an einen tragbaren Computer übertragen, der auch für den Softwarebetrieb verwendet wird.
Das Gerät wird von einem externen Computer über eine LabVIEW-Umgebung gesteuert, die die Bildaufnahme mit der CCD-Kamera synchronisiert, Laser ein-/ausschalten und das Langpass-Filterrad drehen. Die grafische Benutzeroberfläche (GUI) ist in drei Hauptabschnitte unterteilt. Die Belichtungseinstellung erfolgt manuell. Obwohl die Korrektur zwischen Belichtungszeit und Signalintensität linear ist (Abbildung 2B), ist die maximale Belichtungszeit auf 10 s begrenzt, da längere Integrationszeiten zu einer signifikanten Verringerung des Signal-Rausch-Verhältnisses führen. Das Kommentarfeld wird für die Beschreibung der Stichprobe verwendet (Abbildung 2A). Im rechten Bereich werden Rohbilder angezeigt, sobald die Messungen abgeschlossen sind. Diese Funktion ist für die sofortige Datenauswertung vor Ort von entscheidender Bedeutung (Abbildung 2C–E). Rote Bereiche zeigen überbelichtete Pixel an, die durch Eine Verkürzung der Belichtungszeit vermieden werden können.
Der nachfolgende Rohdatenreduktionsprozess ist vom Bildaufnahmeverfahren entkoppelt und kann jederzeit nach der Bildaufnahme durchgeführt werden.
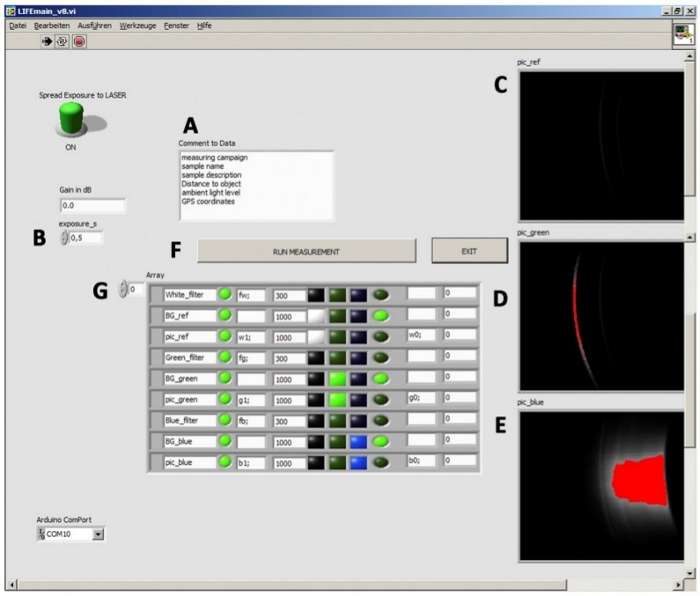
Abbildung 2: Grafische Benutzeroberfläche von L.I.F.E. für die Datenerfassung und Rohdatenauswertung. (A) Die Software ermöglicht manuelle Texteingabe für Beispielbeschreibungen. (B) Die Belichtungszeit kann vor der Messung eingestellt werden. (C-E) Die Rohbilder werden auf der rechten Seite der Benutzeroberfläche angezeigt. (E) Rote Farben zeigen eine Sättigung des Sensors an. (F) Die Aktivierung der Schaltfläche RUN MEASUREMENT löst den Datenerfassungsprozess aus. Im Array (G) werden alle Befehle angezeigt, die während der Datenerfassung automatisch ausgeführt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Beispiel für ein Rohbild. Links: Rohdaten von chlein Standard in Aceton-Lösung, aufgezeichnet mit dem L.I.F.E Instrument. Aufgrund der optischen Eigenschaften des Geräts wird das Signal als verzogene Linie angezeigt. Rechts: Interpretation des Rohbildes pro Pixel (px). Die Spektralachse (5 nm/px Auflösung) wird gegen die räumliche Achse (30 m/px-Auflösung) geplottet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die 12-Bit-Rohbilder im Graumaßstab zeigen eine räumliche Komponente aufgrund des eindimensionalen Blendenschlitzes und eine Spektralkomponente aufgrund des Prismas vor der CCD (Abbildung 3). Als Reaktion auf optische Einschränkungen werden die Rohbilder verzerrt. Daher müssen sie beschnitten und entzerrt werden, indem ein Code angewendet wird, der den Grad der Verzerrung erkennt. Dies geschieht mit einem Software-Assistenten(Abbildung 4). Als nächstes erfolgt die Wellenlängenkalibrierung mit dem 532 nm Laser. Das grüne Licht wird durch Frequenzverdoppelung eines 1.064 nm Infrarotlasers erzeugt. Beide Wellenlängen können von der CCD erfasst werden und daher kann die Spektralposition jedes Pixels in entzerrten Bildern automatisch berechnet werden (Abbildung 4).
Das Bild wird dann auf einen bestimmten Wellenlängenbereich heruntergeschnitten (550–1.000 nm für grüne Lasermessungen und 400–1.000 für blaue Lasermessungen). Graue Werte aus jedem Pixel in einer ausgewählten Pixellinie werden gezählt und summiert. Ein Grauwert kann zwischen 0 und 255 liegen. Danach ist jede Pixellinie für eine Zahl. Weitere Softwareanweisungen auf dem Bildschirm führen zur Generierung eines Diagramms, das die Grauwertzahlen jeder Pixellinie zeigt, die gegen die räumlichen Koordinaten gezeichnet wird. Dies ermöglicht eine quantitative räumliche Diskriminierung von chla und B-PE gleichzeitig in der Stichprobe. Darüber hinaus können die spektralen Eigenschaften eines Samples automatisch aus ausgewählten Pixellinien gezeichnet werden.
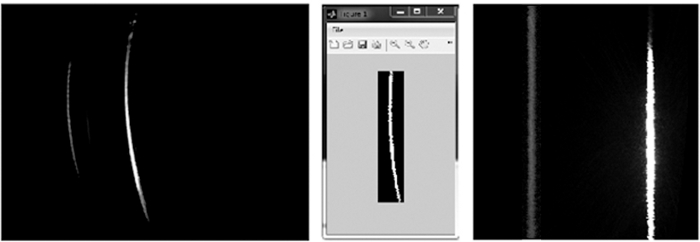
Abbildung 4: Dewarping von Rohbildern. Links: Rohbild, das mit einem grünen Laser aufgenommen wurde. Es wurde kein Filter verwendet. Die Signale werden bei 532 nm und 1.064 nm angezeigt. Belichtungszeit = 0,015 s. Mitte: Das zugeschnittene 532 nm Signal wird als Referenzlinie verwendet, um einen Satz von Bildern zu entwirn. Rechts: Das verzerrte Bild aus der Rohbildquelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
eichung
Es bestand eine lineare Korrelation zwischen Pigmentkonzentration und Fluoreszenzintensität nach normalisierender Photonenzahl auf eine Belichtungszeit von 1 s. Proben mit niedriger Säulenhöhe und niedrigen Pigmentkonzentrationen führten zu einer Überschätzung der Zielpigmente, im Vergleich zu höheren Säulenhöhen mit der gleichen Pigmentkonzentration. Darüber hinaus erforderten schwache Fluoreszenzsignale lange Belichtungszeiten für ausreichende Photonenzähler am Sensor. Die langen Integrationszeiten erhöhten jedoch auch die Menge an Streulicht am Sensor, was zu einer Verringerung des Signal-Rausch-Verhältnisses führte. In der aktuellen Version kann die Software während des Datenreduktionsprozesses nicht zwischen Rauschen und Signal unterscheiden. Daher führten Messungen der niedrigen Fluoreszenzintensität zu einer Pigmentüberschätzung, da Rauschen als Signal gezählt wurde, das von den Zielpigmenten abgeleitet wurde. Darüber hinaus zeigten Fluoreszenzintensitäten aus konzentrierteren Pigmentlösungen eine größere Variabilität als Lösungen mit geringer Konzentration. Dieser Effekt könnte durch Absorptionsprozesse innerhalb der Pigmentlösungen erklärt werden, die für die Kalibrierkurve verwendet wurden.
Datenvalidierung für Chlorophyllund Quantifizierung
Nach dem Filtern von Eis- und Schneeproben tauchten die dreidimensionalen Proben fast als zweidimensionale Probe auf dem Filter auf. Dies rechtfertigte einen direkten Vergleich zwischen L.I.F.E (Flächendichte) und spektrophotometrischen Daten (volumetrische Messung).
Der Datensatz (Abbildung 8) zeigte, dass eine hohe Pigmentkonzentration zu einer Unterschätzung führt, während eine niedrige Pigmentkonzentration zu einer Überschätzung des tatsächlichen Wertes führt. Dieser Effekt kann durch die Dicke des Filterkuchens und damit durch den volumetrischen Charakter der Probe erklärt werden. Die Eindringtiefe des Lasers hing von der optischen Dichte und Dicke der Probe ab. Hohe Pigmentgehalte wurden unterschätzt, da der Laser keine Pigmentfluoreszenz in tieferen Schichten induzieren konnte. Bei dünnen Filterkuchen wurden jedoch niedrige Fluoreszenzsignale aufgrund geringer Flächendichten von Pigmenten erfasst. Offenbar zeigte der Filter selbst laserinduzierte Signale, nachdem er den 450 nm Langpassfilter passiert hatte (Abbildung 12). Dieses Signal wurde irreführend als Fluoreszenzsignal gezählt, das von chlaabgeleitet wurde. So sind dünne und zu dicke Filterkuchen mit dem L.I.F.E.-Instrument schwer zu messen.
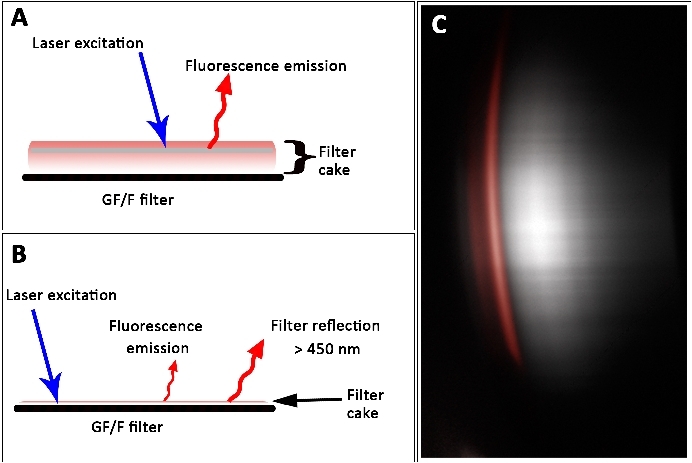
Abbildung 12: Fluoreszenzsignale von dicken (A) und dünnen (B) Filterkuchen auf einem GF/F-Filter. (A) Selbstschattierung verhindert laserinduzierte Fluoreszenz aus tieferen Schichten, was zu einer Unterschätzung der tatsächlichen Pigmentkonzentration führt. (B) Fluoreszenzemission aus Filterkuchen mit Überlagerung durch Filterreflexionen. (C) Rohdaten zeigen Filterreflexion (grau). Die spektrale Eigenschaft eines Labors abgeleitet chlein Fluoreszenzmuster ist rot dargestellt. Maßstabsleiste = 45 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Einschränkungen des L.I.F.E.-Prototyps
Während der Datenreduktion interpretierte die MATLAB-codierte Software die Rohbilder, indem sie Pixellinien innerhalb eines bestimmten Wellenlängenbereichs zusammenfasste. Die aktuelle Version der Software unterscheidet nicht zwischen organischen und anorganischen abgeleiteten Signalen. Das Vorhandensein mehrerer Signale kann zu einer Überschätzung des tatsächlichen Pigmentgehalts führen. Lange Expositionszeiten aufgrund niedriger Fluoreszenzintensitäten führten zu einer Verringerung des Signal-Rausch-Verhältnisses, wodurch der oben beschriebene Effekt gefördert wurde (siehe Abbildung 8 und Abbildung 12).
Ein in Abbildung 13 dargestelltes Geodegestein zeigte rotes fluoreszierendes Licht, wenn es mit grünem und blauem Licht ausgesetzt wurde. Derzeit ist nicht klar, ob die Fluoreszenz aus Mineralien oder aus Porphyrin-basierten Molekülen stammt. Daher kann eine Überlagerung biologischer und nichtbiologischer Signale die Anwendung dieser Methode einschränken und die Einrichtung einer Fluoreszenzdatenbank erfordern, die speziell für den L.I.F.E.-Prototyp erstellt wurde.
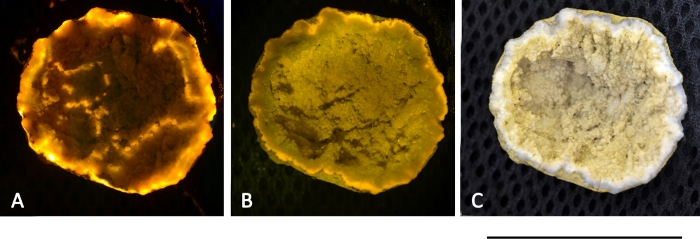
Abbildung 13: Mineralfluoreszenz aus einem Geodegestein, gefunden in Ny-Elesund. Das Gestein wurde mit einem 532 nm 50 mW Laser (A) und einem 405 nm 50 mW Laser (B) angeregt. Beide Bilder wurden mit einem Polarisationsfilter an der Linse aufgenommen, was zu einer Fälschung der tatsächlichen Fluoreszenzfarben führte. (C) Echtes Farbbild ohne Verwendung eines Polarisationsfilters bei Tageslicht. Maßstabsleiste = 40 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Beutler undandere 29 kamen zu dem Schluss, dass charakteristische Emissionsspektren von Cyanobakterien in marinen Ökosystemen von Umweltbedingungen abhängen. Auch der Stoffwechselzustand hat einen Einfluss auf die Fluoreszenzeigenschaften in phototrophen Organismen30. Das L.I.F.E-Instrument kann zwischen dem Algen- und dem Cyanobakterienfluoreszenzmuster unterscheiden, indem Bio-Fingerabdruckbibliotheken verwendet werden, die spektrale Informationen der Probe enthalten, die mit Denkbedingungen korreliert sind.
In dunkel angepasstenChl-Molekülen sind alle Reaktionszentren vollständig oxidiert und für die Photochemie verfügbar und es wird keine Fluoreszenzausbeute abgeschreckt31. Mit dem L.I.F.E.-Verfahren wird eine Probe zunächst durch einen 532 nm Laser (grün) und dann mit einem 405 nm Laser (blau) angeregt. Während der zweiten Anregung durch den blauen Laser kann chla eine verringerte Fluoreszenzreaktion aufgrund der vorherigen Anregung durch den grünen Laser zeigen. Chla absorbiert Energie bei 532 nm Wellenlänge, trotz seines Abstands von seiner Absorption maximale Wellenlänge32. Vor der eigentlichen chleine Messung bei 405 nm kann der grüne Laser photochemische Reaktionen verursachen, die Abschreckungsmechanismen in den Zielpigmenten aktivieren. Darüber hinaus führte die Vorbeleuchtung mariner phototropher Organismen nicht zu einer Veränderung der Spektralnormkurven zwischen 450 nm–600 nm, während die Standardabweichung der Fluoreszenzintensitäten um 25%29zunahm. Je nach Art stiegen die Fluoreszenzintensitäten als Reaktion auf die vorherige Anregung sogar an. Dieses Thema bedarf weiterer Untersuchungen.
Anwendbarkeit
Wir testeten das L.I.F.E. Instrument in verschiedenen Lebensräumen mit schwerpunkt auf Kryokonitlöchern. Der Laser wurde erfolgreich in Boden- und Biofilm-Lebensräumen eingesetzt, da während der Messung kein Umgebungslicht zur Welt kam. Kryokonitengranulat e.V. konnte gemessen werden, wenn Sedimentschichten Licht unter dem Loch blockierten (Abbildung 14A,C). Dünne Sediment-Kryokonitlöcher waren durchlässig für Streulicht von unten (Abbildung 14B). Stray-Licht stört die Messung. So ist die Pigmentkonzentration in nackten Eisflächen bei Tageslicht noch nicht messbar. Derzeit laufen Die Signalverarbeitungsbemühungen, um den Betrieb des Systems bei hohen Umgebungslichtverhältnissen zu ermöglichen.

Abbildung 14: Kryokonitloch mit flüssigem Wasser obendrauf. (A) Kryokonit auf Gletscher mit L.I.F.E. Linsenrohr. Maßstabsbalken = 70 mm. (B) Die Sedimentschicht (rot) ist sehr dünn. Stray Licht blutet durch die Kryokonitschicht. (C) Die Sedimentschicht ist dick genug, um das Streulicht von unten zu blockieren. Diese Art von Kryokonitloch ist mit dem L.I.F.E.-Instrument messbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Zusammenfassend lässt sich sagen, dass unser L.I.F.E.-Instrument photoautotrophe Organismen in terrestrischen Lebensräumen wie Böden, Bakterienmatten, Biofilmen und in Kryokonitlöchern auf Gletscheroberflächen nachgewiesen hat. Die Zielmoleküle waren chla und B-PE. Die räumliche Auflösung betrug 30 m/px. Die Nachweisgrenze für chla betrug 250 pg/mL und 2 ng/ml für B-PE. Nach einer Laborkalibrierung konnten wir den Pigmentgehalt in Proben quantifizieren, die an unserem Studienort in der Arktis gesammelt wurden. Wir haben selbstprogrammierte Software für einen automatisierten Datenreduktionsprozess eingesetzt. Die Auswirkungen des Vorhandenseins von Mineralien und sich verändernden Lichtverhältnissen während der Messungen erfordern weitere Untersuchungen.
Mit der Klimaerwärmung führen steigende Temperaturen zu einer verbesserten Verfügbarkeit von flüssigem Wasser, was zu einer höheren biologischen Aktivität auf eisigen Oberflächen autotrophischer und heterotropher Natur führt. Es sollten energische Anstrengungen unternommen werden, um heterotrophe Organismen vor Ort zu erkennen, um ein vollständiges Bild des aktiven Lebens in der Kryosphäre zu vermitteln. Dies könnte mit anderen Zielpigmenten und geeigneten Laseranregungswellenlängen getestet werden. Damit bietet L.I.F.E. ein geeignetes Überwachungssystem, das eine hohe zeitliche und räumliche Auflösung für supraglaziale Bedingungen im Zusammenhang mit globalen Veränderungen sowie möglichen astrobiologischen Anwendungen bietet.
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Oberst (IL) J.N. Pritzker, der Tawani Stiftung, USA, dem Bundesministerium für Wissenschaft, Forschung und Wirtschaft (Sparkling Science SPA04_149 und SPA05_201), Alpine Forschungsstelle Obergurgl (AFO), Österreichisches Weltraumforum ( ÖWF), Roman Erler vom Hintertuxer Natur Eis Palast, der österreichische Bundesforst- und Stützpunktleiter Nick Cox von der Arktisstation in Ny Alesund (Svalbard). Wir sind auch Sabrina Obwegeser, Carina Rofner und Fabian Drewes für ihre Hilfe bei den Dreharbeiten dankbar. Abschließend möchten wir James Bradley dafür danken, dass er die Stimme für das videoerhaltende Video gegeben hat.
Materials
| aceton | Merck | 67-64-1 | |
| B-Phycoerythrin | Invirtrogen | P6305 | |
| Chlorophyll a standard | Sigma-Aldrich | C6144-1MG | |
| formaline | Merck | HT501128 | 36% |
| GF/C filters | Whatman | WHA1822025 | 25mm diameter |
| HCl | Merck | H1758 | 36,5-38% |
| L.I.F.E. Prototype | University of Innsbruck | built on demand | |
| LabView | National Instruments | Software, Laboratory Virtual Instrumentation Engineering Workbench | |
| Leucine, L-[4,5-3H], 1 mCi | Perkin Elmer | NET1166001MC | radioactive |
| Liquid scintillation cocktail Beckman Ready Use | Beckman | not more available, can be compensated by Ultra Gold, Packard | |
| liquid scintillation counter | Beckman | out of stock | LSC 6000 IC |
| NaH14CO3 (4 µCi/ml) | DHI Denmark | 4 μCi/ml, 1 ml | radioactive |
| Osmonics polycarbonate filters | DHI Denmark | PCTE | 25mm diameter, 0,2µm pore size |
| Polyscintillation vials | Perkin Elmer | WHA1825047 | 20ml |
| sample tubes | Sigma Aldrich | T2318-500EA | Greiner centrifuge tubes, 50ml |
| Spectrophotometer | Hitachi | NA | Model U2001, any photometer for absorption spectroscopy measuring at 664nm and 750nm would be appropriate |
| trichloric acetic acid (TCA) | Merck | T6399 | 100% |
| ultrasonic probe | nano lab | QS1T-2 |
Referenzen
- Boyd, E. S., Skidmore, M., Mitchell, A. C., Bakermans, C., Peters, J. W. Methanogenesis in subglacial sediments. Environmental Microbiology Reports. 2, 685-692 (2010).
- Sattler, B., Puxbaum, H., Psenner, R. Bacterial growth in supercooled cloud droplets. Geophysical Research Letters. 28, 239-242 (2001).
- Good, P., et al. A review of recent developments in climate change science. Part I: Understanding of future change in the large-scale climate system. Progress in Physical Geography. 35, 281-296 (2011).
- Fountain, A. G., et al. The Disappearing Cryosphere: Impacts and Ecosystem Responses to Rapid Cryosphere Loss. BioScience. 62, 405-415 (2012).
- Rignot, E., Mouginot, J., Morlighem, M., Seroussi, H., Scheuchl, B. Widespread, rapid grounding line retreat of Pine Island, Thwaites, Smith, and Kohler glaciers, West Antarctica, from 1992 to 2011. Geophysical Research Letters. 41, 3502-3509 (2014).
- McMillan, M., et al. Increased ice losses from Antarctica detected by CryoSat-2. Geophysical Research Letters. 41, 3899-3905 (2014).
- Barletta, V. R., et al. Glacier shrinkage and modeled uplift of the Alps. Geophysical Research Letters. 33, 14307 (2006).
- Nuth, C., et al. Decadal changes from a multi-temporal glacier inventory of Svalbard. The Cryosphere. 7, 1603-1621 (2013).
- Takeuchi, N., Kohshima, S., Seko, K. Structure, formation, and darkening process of albedo-reducing material (cryoconite) on a Himalayan glacier: A granular algal mat growing on the glacier. Arctic Antarctic and Alpine Research. 33, 115-122 (2001).
- Takeuchi, N. Optical characteristics of cryoconite (surface dust) on glaciers: the relationship between light absorbency and the property of organic matter contained in the cryoconite. Annals of Glaciology. 34, 409-414 (2002).
- Anesio, A. M., Hodson, A. J., Fritz, A., Psenner, R., Sattler, B. High microbial activity on glaciers: importance to the global carbon cycle. Global Change Biology. 15, 955-960 (2009).
- Anesio, A. M., et al. Carbon fluxes through bacterial communities on glacier surfaces. Annals of Glaciology. 51, 32-40 (2010).
- Storrie-Lombardi, M. C., Sattler, B. Laser-Induced Fluorescence Emission (L.I.F.E): In Situ Nondestructive Detection of Microbial Life in the Ice Covers of Antarctic Lakes. Astrobiology. 9, 659-672 (2009).
- Murray, A. E., et al. Microbial life at -13 °C in the brine of an ice-sealed Antarctic lake. Proceedings of the National Academy of Sciences of the United States of America. 109, 20626-20631 (2012).
- Edwards, A., et al. A distinctive fungal community inhabiting cryoconite holes on glaciers in Svalbard. Fungal Ecology. 6, 168-176 (2013).
- Miteva, V., Margesin, R., Schinner, F., Marx, J. C., Gerday, C. Bacteria in Snow and Glacier Ice. Psychrophiles: from Biodiversity to Biotechnology. , 31-50 (2008).
- Yallop, M. L., et al. Photophysiology and albedo-changing potential of the ice algal community on the surface of the Greenland ice sheet. The ISME Journal. 6, 2302-2313 (2012).
- Edwards, A., et al. A metagenomic snapshot of taxonomic and functional diversity in an alpine glacier cryoconite ecosystem. Environmental Research Letters. 8, 035003 (2013).
- Remias, D., et al. Characterization of an UV-and VIS-absorbing, purpurogallin-derived secondary pigment new to algae and highly abundant in Mesotaenium berggrenii (Zygnematophyceae, Chlorophyta), an extremophyte living on glaciers. FEMS Microbiology Ecology. 79, 638-648 (2012).
- Cook, J., et al. An improved estimate of microbially mediated carbon fluxes from the Greenland ice sheet. Journal of Glaciology. 58, 1098-1108 (2012).
- Mueller, D. R., Vincent, W. F., Pollard, W. H., Fritsen, C. H. Glacial cryoconite ecosystems: a bipolar comparison of algal communities and habitats. Nova Hedwigia Beiheft. 123, 173-198 (2001).
- Morgan-Kiss, R. M., Priscu, J. C., Pocock, T., Gudynaite-Savitch, L., Huner, N. P. A. Adaptation and Acclimation of Photosynthetic Microorganisms to Permanently Cold Environments. Microbiology and Molecular Biology Reviews. 70, 222-252 (2006).
- Hodson, A., et al. The cryoconite ecosystem on the Greenland ice sheet. Annals of Glaciology. 51, 123-129 (2010).
- Tilg, M., et al. L.I.F.E.: laser induced fluorescence emission, a non-invasive tool to detect photosynthetic pigments in glacial ecosystems. Proceedings SPIE. 8152, Instruments, Methods, and Missions for Astrobiology XIV, 81520I. , (2011).
- Lorenzen, C. J. Determination of chlorophyll and pheo-pigments: spectrophotometric equations. Limnology & Oceanography. 12, 343-346 (1967).
- Kirchman, D. Measuring bacterial biomass production and growth rates from leucine incorporation in natural aquatic environments. Methods in Microbiology. , 227-238 (2001).
- Bell, R. T., Kemp, P. F., Cole, J. J., Sherr, B. F., Sherr, E. B. Estimating production of heterotrophic bacterioplankton via incorporation of tritiated thymidine. Handbook of methods in aquatic microbial ecology. Edited by. , 495-503 (1993).
- Groemer, G., et al. Field trial of a dual-wavelength fluorescent emission (L.I.F.E.) instrument and the Magma White rover during the MARS2013 Mars analog mission. Astrobiology. 14, 391-405 (2014).
- Beutler, M. . Spectral fluorescence of chlorophyll and phycobilins as an in situ tool of phytoplankton analysis-models, algorithms and instruments. , (2003).
- Krogmann, K. D. Discoveries in Oxygenic Photosynthesis (1727-2003): A Perspective. Photosynthesis Research. 80, 15-57 (2004).
- Corrêa, D. S., et al. Reverse saturable absorption in chlorophyll A solutions. Journal of Applied Physics B. 74, 559-561 (2002).
- Kaňa, R., et al. The slow S to M fluorescence rise in cyanobacteria is due to a state 2 to state 1 transition. Biochimica et Biophysica Acta. 1817, 1237-1247 (2012).

