Het bepalen van de functionele status van het Corticospinale darmkanaal binnen een week van de beroerte
Summary
Dit protocol is voor de evaluatie van corticospinale darmfunctie binnen 1 week na een beroerte. Het kan worden gebruikt om patiënten te selecteren en te bevredigen in proeven van interventies die zijn ontworpen om het motorisch herstel en de resultaten van de bovenste ledematen te verbeteren en in de klinische praktijk voor het voorspellen van functionele resultaten van de bovenste ledematen 3 maanden na een beroerte.
Abstract
Hoge interindividuele variabiliteit in het herstel van de functie van de bovenste ledematen (UL) na een beroerte betekent dat het moeilijk is om het potentieel van een individu voor herstel te voorspellen op basis van klinische beoordelingen alleen. De functionele integriteit van het corticospinale kanaal is een belangrijke prognostische biomarker voor herstel van ul-functie, met name voor mensen met ernstige initiële UL-stoornis. Dit artikel presenteert een protocol voor de evaluatie van corticospinale darmfunctie binnen 1 week na een beroerte. Dit protocol kan worden gebruikt om patiënten te selecteren en te bevredigen in proeven met interventies die zijn ontworpen om ul-motorisch herstel en resultaten na een beroerte te verbeteren. Het protocol maakt ook deel uit van het PREP2-algoritme, dat ul-functie voor individuele patiënten 3 maanden postslag voorspelt. Het algoritme combineert achtereenvolgens een UL sterktebeoordeling, leeftijd, transcraniële magnetische stimulatie en slagernst, binnen een paar dagen na de beroerte. De voordelen van het gebruik van PREP2 in de klinische praktijk worden elders beschreven. Dit artikel richt zich op het gebruik van een UL sterktebeoordeling en transcraniële magnetische stimulatie om corticospinale darmfunctie te evalueren.
Introduction
Bovenste ledemaat functie is vaak aangetast na een beroerte, en herstel van ul functie is belangrijk voor het herwinnen van onafhankelijkheid in de dagelijkse levende activiteiten1. Beroerte revalidatie proeven zijn vaak gericht op het verbeteren van UL herstel en resultaten na een beroerte. De meerderheid van het onderzoek naar beroerterevalidatie wordt uitgevoerd bij patiënten in het chronische stadium (>6 maanden postslag), maar de meeste revalidatie vindt vroeg na beroerte2,3plaats. Meer onderzoek moet worden uitgevoerd met patiënten kort na een beroerte om een bewijsbasis voor revalidatie praktijk op te bouwen.
Een van de grootste uitdagingen bij het uitvoeren van onderzoek kort na de beroerte is het detecteren van de effecten van de interventie tegen de achtergrond van herstel die optreedt tijdens de eerste weken en maanden na de beroerte. Hoge intersubject variabiliteit in klinische presentatie en herstel creëert ruis die de gunstige effecten van interventies kan verdoezelen. Interventie- en controlegroepen zijn doorgaans in evenwicht op basis van klinische metingen van initiële neurologische stoornissen. Deze maatregelen zijn echter vaak slechte voorspellers van het potentieel van de patiënt voor volgend herstel, met name die met een ernstige initiële waardevermindering4,5. Dit betekent dat groepen kunnen worden gekoppeld voor basisklinische maatregelen en niet kunnen worden afgestemd op hun herstelpotentieel, waardoor het moeilijker wordt om de effecten van de interventie vast te stellen. Biomarkers kunnen deze uitdaging aanpakken door het potentieel van een individuele patiënt voor motorisch herstel te identificeren, zodat groepen nauwkeurig kunnen worden afgestemd en gestratificeerd6,7,8. Biomarkers kunnen ook worden gebruikt om patiënten te selecteren die het meest waarschijnlijk reageren op de bekende of hypothetische mechanismen van actie van de interventie6.
De functionele integriteit van het corticospinale (CST) is een belangrijke biomarker die herstel van de UL-functie voorspelt na beroerte5,8,9,10,11,12. De CST brengt dalende motoroutput van de primaire motorische cortex naar het ruggenmerg en is essentieel voor coördinatie en fijne motorische controle. Patiënten met een functionele CST na een beroerte hebben meer kans om kracht, coördinatie en behendigheid te herwinnen dan patiënten zonder. Een klinische beoordeling kan voldoende zijn om te bevestigen dat de CST functioneel is bij licht gehandicapte patiënten13,14,15. Patiënten met een ernstigere initiële beperking kunnen echter al dan niet beschikken over een functionele CST, en een neurofysiologische beoordeling met behulp van transcraniële magnetische stimulatie (TMS) is nodig9,10,11,16,17.
TMS is een niet-invasieve en pijnloze techniek die kan worden gebruikt om CST functie te testen18. De TMS spoel levert een magnetische stimulus over de primaire motorische cortex die een dalende volley genereert in de CST, het uitlokken van een motorisch opgeroepen potentieel (MEP) in de spieren van de contralaterale ledemaat19. De aanwezigheid van een lid van het Europees Parlement in de paretische arm of hand (MEP+) duidt op een functionele CST en wordt geassocieerd met een groter potentieel voor herstel van de UL-functie. Patiënten die lid van het Europees Parlement zijn, hebben het meest waarschijnlijk een slechter UL-herstel, zonder terugkeer van gecoördineerde en behendige handfunctie4,6,9,12,16.
Het testen van alle patiënten met TMS is onpraktisch en onnodig, omdat patiënten met een milde initiële beperking hoogstwaarschijnlijk een functionele CST17hebben. Daarom is een hiërarchische aanpak nodig, zodat TMS alleen wordt gebruikt voor patiënten met een ernstigere initiële beperking. Het PREP2-algoritme werd ontwikkeld met behulp van een combinatie van klinische metingen en TMS om de CST-functie te evalueren en de waarschijnlijke UL-uitkomst te voorspellen op 3 maanden postslag (figuur 1)17. PREP2 begint bij dag 3 postslag door het testen van de kracht van schouder ontvoering en vinger extensie in de paretic arm (SAFE score), met behulp van Medical Research Council kwaliteiten. Als de som van deze cijfers 5 of meer van de 10 is, is het “veilig” om aan te nemen dat de patiënt MEP+ is. Van deze patiënten wordt verwacht dat ze een goed of uitstekend UL-resultaat hebben met 3 maanden postslag, afhankelijk van hun leeftijdvan 17jaar. Deze patiënten hebben geen TMS nodig om de status van het Europees Parlement te bepalen, waardoor de kosten en onnodige tests voor de patiënt worden geminimaliseerd.
Patiënten met een VEILIGE score van minder dan 5 op dag 3 postslag vereisen TMS om de functionele integriteit van hun CST te bepalen. Als een lid van het Europees Parlement kan worden ontlokt uit de paretische extensor carpi radialis (ECR) of eerste ruginterosseus (BDI) spieren, de patiënt is MEP + en zal naar verwachting fijne motorische controle van de hand te herstellen door 3 maanden poststroke. Ongeveer de helft van de patiënten met een SAFE score minder dan 5 op dag 3 postslag zijn MEP +. Belangrijk is dat patiënten een SAFE score kunnen hebben zo laag als nul en MEP+ kunnen zijn. Dit illustreert de noodzaak van TMS in deze subgroep van patiënten, omdat klinische beoordeling alleen geen onderscheid kan maken tussen patiënten met en zonder een functionele CST. Patiënten die europarlementariër zijn, hebben aanzienlijke CST-schade. Van deze patiënten wordt verwacht dat zij een beperkte of slechte UL-functionele uitkomst hebben, afhankelijk van hun algehele ernst van de beroerte, gemeten met het National Institute of Health Stroke Scale (NIHSS) (figuur 1)17. Van deze ep-patiënten wordt niet verwacht dat zij de gecoördineerde en behendige vingercontrole herwinnen en kunnen zij voor onderzoeksdoeleinden worden gegroepeerd.
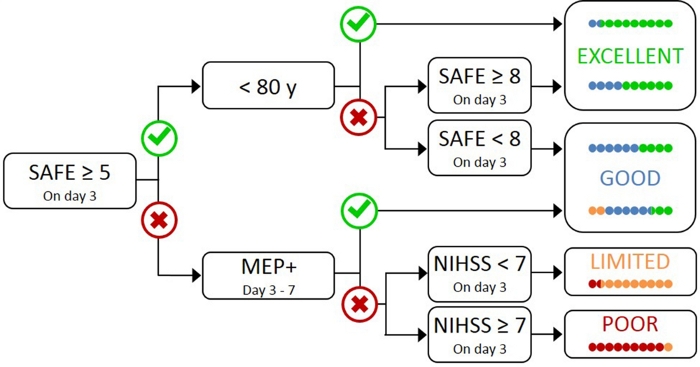
Figuur 1: Het PREP2-algoritme. SAFE = Schouder ontvoering, Vinger Extensie score, dat is de som van de Medical Research Council kwaliteiten voor elk van deze bewegingen van de 5, voor een totale SAFE score van de 10. MEP+ = Motor Evoked Potentials kunnen worden ontlokt uit de paretische extensor carpi radialis (ECR) en/of eerste dorsale interosseous (BDI) spieren van de paretische UL met behulp van transcraniale magnetische stimulatie. NIHSS = National Institutes of Health Stroke Scale. Het algoritme voorspelt een van de vier mogelijke UL functionele resultaten op 3 maanden postslag. Elke voorspellingscategorie wordt geassocieerd met een revalidatiefocus die kan worden gebruikt om UL-therapie2op maat te maken. De gekleurde stippen vertegenwoordigen, proportioneel, PREP2 algoritme nauwkeurigheid. De stippen zijn kleurgecodeerd op basis van de uitkomst categorie daadwerkelijk bereikt 3 maanden postslag (Groen = Uitstekend; Blauw = Goed; Oranje = Beperkt; Rood = Slecht). Figuur gereproduceerd uit Stinear et al.17. Klik hier om een grotere versie van dit cijfer te bekijken.
In de klinische praktijk voorspelt PREP2 een van de vier uitkomstcategorieën die kunnen worden gebruikt om revalidatie voor individuele patiënten op maat te maken en patiënten en gezinnen te helpen begrijpen wat ze kunnen verwachten voor hun UL-herstel. Tot op heden is PREP2 het enige extern gevalideerde UL-voorspellingstool dat klinische beoordeling en biomarker-informatie combineert in eenbeslissingsboom 17. Het is ook het enige UL-voorspellingsinstrument met onderzoek naar de effecten van implementatie in de klinische praktijk20,21. PREP2 voorspellingen zijn nauwkeurig voor ongeveer 75% van de patiënten, te optimistisch voor 17% en te pessimistisch voor 8% van de patiënten op 3 maanden postslag17. De nauwkeurigheid is het hoogst voor ep-patiënten (nauwkeurig voor 90% van de ep-patiënten), waarbij de waarde wordt benadrukt van het gebruik van TMS om deze patiënten te identificeren met ernstige schade aan de aflopende motorpaden17. PREP2 blijft correct voor ongeveer 80% van de patiënten op 2 jaar postslag22. Dit ondersteunt het gebruik van PREP2 om ul functionele motorische resultaten te voorspellen op 3 maanden en langere termijn. Informatie over het leveren van PREP2 voorspellingen en het gebruik ervan in de klinische praktijk valt buiten het toepassingsgebied van deze methoden papier, maar gedetailleerde middelen zijn online beschikbaar23.
PREP2 biedt onderzoekers een hulpmiddel om patiënten te selecteren en te bevredigen voor klinische studies. Hierdoor kunnen patiënten niet alleen worden gegroepeerd op basis van basisklinische kenmerken, maar ook hun neurobiologisch potentieel voor UL-herstel. Ondanks het montagebewijs voor het gebruik van TMS als prognostische biomarker voor UL-herstel, kan gebrek aan vertrouwdheid met TMS-protocollen in ziekenhuisinstellingen met subacute beroertepatiënten een belemmering vormen voor het gebruik ervan in onderzoek. Daarom is dit protocol bedoeld om aan te tonen hoe de SAFE-score en TMS te gebruiken om cst-functie te evalueren bij patiënten in een ziekenhuis instelling vroeg na een beroerte.
Protocol
Representative Results
Discussion
CST-functie geëvalueerd met MEP-status is een belangrijke prognostische biomarker voor UL-herstel en resultaat na beroerte. Een totaal van 95% van de patiënten met een functionele CST op 1 week postslag bereiken van een Action Research Arm Test (ARAT) score van ten minste 34 van de 57 door 3 maanden postslag17. Omgekeerd, 100% van de patiënten zonder een functionele CST op 1 week postslag bereiken van een ARAT score van minder dan 34 door 3 maanden postslag17. Evaluatie …
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
De auteurs danken professor Winston Byblow en Harry Jordan voor hun waardevolle bijdrage aan dit werk. Dit werk werd gefinancierd door de Health Research Council van Nieuw-Zeeland.
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
Referenzen
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

