Chromatographie en phase gazeuse-spectrométrie de masse associée à la vaporisation totale de la microextraction en phase solide en tant qu’outil médico-légal
Summary
La microextraction en phase solide de vaporisation totale (TV-SPME) vaporise complètement un échantillon liquide tandis que les analytes sont sorbés sur une fibre SPME. Cela permet de cloisonner l’analyte entre uniquement la vapeur de solvant et le revêtement de fibre SPME.
Abstract
Chromatographie en phase gazeuse – Spectrométrie de masse (GC-MS) est une technique fréquemment utilisée pour l’analyse de nombreux analytes d’intérêt médico-légal, y compris les substances contrôlées, les liquides inflammables et les explosifs. La GC-MS peut être couplée à la microextraction en phase solide (SPME), dans laquelle une fibre avec un revêtement sorptif est placée dans l’espace libre au-dessus d’un échantillon ou immergée dans un échantillon liquide. Les analytes sont sorbés sur la fibre qui est ensuite placée à l’intérieur de l’entrée gc chauffée pour la désorption. La vaporisation totale de la microextraction en phase solide (TV-SPME) utilise la même technique que le SPME d’immersion, mais immerge la fibre dans un extrait d’échantillon complètement vaporisé. Cette vaporisation complète se traduit par une partition entre uniquement la phase vapeur et la fibre SPME sans interférence d’une phase liquide ou de tout matériau insoluble. Selon le point d’ébullition du solvant utilisé, le TV-SPME permet d’obtenir de grands volumes d’échantillons (p. ex., jusqu’à des centaines de microlitres). La dérivation sur fibre peut également être effectuée à l’aide de TV-SPME. TV-SPME a été utilisé pour analyser les médicaments et leurs métabolites dans les cheveux, urine, et la salive. Cette technique simple a également été appliquée aux drogues de rue, aux lipides, aux échantillons de carburant, aux résidus explosifs post-explosion et aux polluants dans l’eau. Cet article met en évidence l’utilisation de TV-SPME pour identifier les adultérants illégaux dans de très petits échantillons (quantités de microlitres) de boissons alcoolisées. Le gamma-hydroxybutyrate (GHB) et le gamma-butyrolactone (GBL) ont été identifiés à des niveaux qui seraient trouvés dans les boissons enrichies. La dérivation par un agent triméthylsilyle a permis de convertir la matrice aqueuse et le GHB en leurs dérivés tms. Dans l’ensemble, TV-SPME est rapide, facile et ne nécessite aucune préparation d’échantillon en dehors de placer l’échantillon dans un flacon d’espace de tête.
Introduction
La microextraction en phase solide (SPME) est une technique d’échantillonnage dans laquelle un échantillon liquide ou solide est placé dans un flacon d’espace libre et une fibre SPME, recouverte d’un matériau polymère, est ensuite introduite dans l’espace de tête de l’échantillon (ou immergée dans un échantillon liquide). L’analyte est sorbé sur la fibre puis la fibre est placée à l’intérieur de l’entrée GC pour la désorption1,2. La vaporisation totale de la microextraction en phase solide (TV-SPME) est une technique similaire à celle du SPME d’immersion, mais vaporise complètement un échantillon liquide avant que les analytes ne soient adsorbés sur la fibre. Cela permet de cloisonner l’analyte entre uniquement la vapeur de solvant et le revêtement de la fibre, permettant à une plus grande partie de l’analyte d’être adsorbée sur la fibre et résultant en une bonne sensibilité3. Il existe diverses fibres SPME disponibles et la fibre doit être choisie en fonction de l’analyte d’intérêt, du solvant / matrice et de l’agent de dérivation. Voir le tableau 1 pour les analytes TV-SPME établis.
| échantillon | Analyte(s) | Fibre SPME recommandée | Référence(s) |
| Cheveux humains | Nicotine, cotinine | Polydiméthylsiloxane/divinylbenzène (PDMS/DVB), polyacrylate (PA) | 3 |
| Poudre sans fumée | Nitroglycérine, diphénylamine | Polydiméthylsiloxane (PDMS), polyéthylène glycol (PEG) | 7, 8 |
| Carburant de course | Méthanol, nitrométhane | cheville | 9 |
| Eau | Hydrocarbures aromatiques polycycliques | PDMS | 10 |
| Boissons | Acide ɣ-hydroxybutyrique, ɣ-butyrolactone | PDMS | Ce travail |
| Poudre solide | Méthamphétamine, amphétamine | PDMS/DVB | inédit |
Tableau 1. Fibres de SPME recommandées avec des analytes établis de TV-SPME.
Pour réaliser le TV-SPME, les analytes sont dissous dans un solvant et une partie aliquote de ce mélange est placée dans un flacon d’espace libre. Les échantillons n’ont pas besoin d’être filtrés car seuls le solvant et les analytes volatils vont se vaporiser. Des volumes spécifiques d’échantillons liquides doivent être utilisés pour assurer la vaporisation totale de l’échantillon. Ces volumes sont déterminés à l’aide de la loi du gaz idéal pour calculer le nombre de moles d’un solvant multiplié par le volume molaire du liquide (équation 1).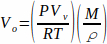 Équation 1
Équation 1
où Vo est le volume de l’échantillon (mL), P est la pression de vapeur du solvant (bar), Vv est le volume du flacon (L), R est la constante de gaz idéal (0,083145), 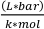 M est la masse molaire du solvant (g/mol), T est la température (K) et
M est la masse molaire du solvant (g/mol), T est la température (K) et 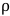 est la densité du solvant (g/mL). 3
est la densité du solvant (g/mL). 3
Afin d’utiliser la pression de vapeur correcte, l’équation d’Antoine (équation 2) est utilisée pour tenir compte de l’influence de la température:4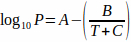 Équation 2
Équation 2
où T est la température et A, B et C sont les constantes d’Antoine pour le solvant. L’équation 2 peut être substituée à l’équation 1, donnant: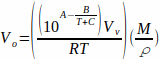 Équation 3
Équation 3
L’équation 3 donne le volume de l’échantillon (Vo)qui peut être complètement vaporisé en fonction de la température et du solvant utilisés.
Pour effectuer la dérivatisation avec TV-SPME, la fibre SPME est d’abord exposée à un flacon contenant l’agent de dérivatisation pendant une durée prédéterminée en fonction de l’analyte. La fibre SPME est ensuite exposée à un nouveau flacon contenant l’analyte d’intérêt. Ce flacon est chauffé à l’intérieur d’un agitateur chauffé. L’analyte est ensuite adsorbé sur la fibre avec l’agent de dérivation. La dérivatisation de l’analyte et/ou de la matrice a lieu sur la fibre avant d’être insérée dans l’entrée GC pour la désorption. La figure 1 montre une représentation du processus TV-SPME avec dérivation.
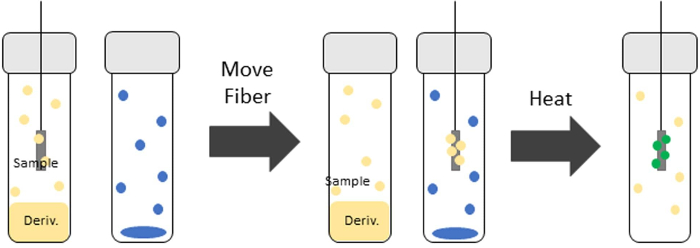
Figure 1 : Représentation du procédé TV-SPME avec dérivation. La fibre SPME pénètre d’abord dans le flacon de dérivation où l’agent de dérivatisation (cercles jaunes) sorbe sur la fibre. La fibre est ensuite introduite dans l’échantillon (cercles bleus) et chauffée. La formation de la dérivée (cercles verts) a lieu sur la fibre pendant le temps d’extraction. Veuillez cliquer ici pour voir une version plus grande de cette figure.
TV-SPME est bénéfique car il permet de dérivation de l’analyte pendant le processus d’extraction, ce qui réduit le temps d’analyse. D’autres méthodes, telles que l’injection de liquide, exigent que l’analyte réagisse avec l’agent dérivateur en solution avant d’être injecté dans le GC. TV-SPME nécessite également peu ou pas de préparation d’échantillon. Une matrice contenant un analyte peut être placée directement dans le flacon de l’espace libre et analysée. De nombreux composés d’intérêt sont compatibles avec TV-SPME. Les composés doivent être solubles dans un solvant et suffisamment volatils pour permettre la vaporisation. De plus, les composés doivent être thermiquement stables pour être analysés par GC-MS. TV-SPME a été utilisé pour analyser des médicaments et des métabolites de médicaments, des carburants de course, des hydrocarbures aromatiques polycycliques et des matériaux explosifs3,5,6,7,8,9,10.
Protocol
Representative Results
Discussion
Tv-SPME présente certains avantages par rapport à l’injection de liquide GC en ce que les échantillons de grande taille (p. ex. 100 μL) peuvent être utilisés sans modification de l’instrument. TV-SPME présente également certains des mêmes avantages que headspace SPME. Headspace SPME ne nécessite aucune extraction ou filtration car tous les composés non volatils resteront dans le flacon headspace et ne seront pas adsorbés sur la fibre, ce qui donnera un échantillon propre. Cette méthode permet également…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Cette recherche a été soutenue par le National Institute of Justice (Prix n° 2015-DN-BX-K058 &2018-75-CX-0035). Les opinions, constatations et conclusions exprimées ici sont celles de l’auteur et ne reflètent pas nécessairement celles des organismes de financement.
Materials
| 10 µL Syringe | Gerstel | 100111-014-00 | |
| BSTFA + 1% TMCS (10 x 1 GM) | Regis Technologies Inc. | 50442882 | |
| eVol XR Sample Dispensing System Kit | ThermoFisher Scientific | 66002-024 | |
 -Butyrolactone (GBL) -Butyrolactone (GBL) |
Sigma-Aldrich | B103608-26G | |
 -Hydroxy Butyric Acid (GHB) -Hydroxy Butyric Acid (GHB) |
Cayman Chemicals | 9002506 | |
| Headspace Screw-Thread Vials, 18 mm | Restek | 23083 | |
| Magnetic Screw-Thread Caps, 18 mm | Restek | 23091 | |
| Optima water for HPLC | Fisher Chemical | W71 | |
| SPME Fiber Assembly Polydimethylsiloxane (PDMS) | Supelco | 57341-U | |
| SPME Fiber Assembly Polydimethylsiloxane/Divinylbenzene (PDMS/DVB) | Supelco | 57293-U | |
| Topaz 2.0 mm ID Straight Inlet Liner | Restek | 23313 |
Referenzen
- Pawliszyn, J. B. Method and Device for Solid Phase Microextraction and Desorption. United States patent. , (2005).
- Pawliszyn, J. . Solid phase microextraction: theory and practice. , (1997).
- Rainey, C. L., Bors, D. E., Goodpaster, J. V. Design and optimization of a total vaporization technique coupled to solid-phase microextraction. Analytical Chemistry. 86 (22), 11319-11325 (2014).
- Sinnott, R. . Chemical Engineering Design: Chemical Engineering. 6, (2005).
- Davis, K. . Detection of Illicit Drugs in Various Matrices Via Total Vaporization Solid-Phase Microextraction (TV-SPME). , (2019).
- Ash, J., Hickey, L., Goodpaster, J. Formation and identification of novel derivatives of primary amine and zwitterionic drugs. Forensic Chemistry. 10, 37-47 (2018).
- Sauzier, G., Bors, D., Ash, J., Goodpaster, J. V., Lewis, S. W. Optimisation of recovery protocols for double-base smokeless powder residues analysed by total vaporisation (TV) SPME/GC-MS. Talanta. 158, 368-374 (2016).
- Bors, D., Goodpaster, J. Mapping smokeless powder residue on PVC pipe bomb fragments using total vaporization solid phase microextraction. Forensic science international. 276, 71-76 (2017).
- Bors, D., Goodpaster, J. Chemical analysis of racing fuels using total vaporization and gas chromatography mass spectrometry (GC/MS). Analytical Methods. 8 (19), 3899-3902 (2016).
- Beiranvand, M., Ghiasvand, A. Design and optimization of the VA-TV-SPME method for ultrasensitive determination of the PAHs in polluted water. Talanta. 212, 120809 (2020).

