Analisi di tracciamento delle nanoparticelle per la quantificazione e la determinazione delle dimensioni delle vescicole extracellulari
Summary
Dimostriamo come utilizzare un nuovo strumento di analisi del tracciamento delle nanoparticelle per stimare la distribuzione dimensionale e la concentrazione totale di particelle di vescicole extracellulari isolate dal tessuto adiposo perigonadale di topo e dal plasma umano.
Abstract
I ruoli fisiologici e fisiopatologici delle vescicole extracellulari (EV) sono diventati sempre più riconosciuti, rendendo il campo EV un’area di ricerca in rapida evoluzione. Esistono molti metodi diversi per l’isolamento dei veicoli elettrici, ognuno con vantaggi e svantaggi distinti che influenzano la resa a valle e la purezza dei veicoli elettrici. Pertanto, caratterizzare la preparazione EV isolata da una determinata fonte con un metodo scelto è importante per l’interpretazione dei risultati a valle e il confronto dei risultati tra i laboratori. Esistono vari metodi per determinare le dimensioni e la quantità di veicoli elettrici, che possono essere alterati da stati patologici o in risposta a condizioni esterne. L’analisi di tracciamento delle nanoparticelle (NTA) è una delle tecnologie di spicco utilizzate per l’analisi ad alto rendimento di singoli veicoli elettrici. Qui, presentiamo un protocollo dettagliato per la quantificazione e la determinazione delle dimensioni dei veicoli elettrici isolati dal tessuto adiposo perigonadale del topo e dal plasma umano utilizzando una tecnologia rivoluzionaria per NTA che rappresenta i principali progressi nel campo. I risultati dimostrano che questo metodo può fornire dati riproducibili e validi sulla concentrazione totale di particelle e sulla distribuzione delle dimensioni per veicoli elettrici isolati da fonti diverse utilizzando metodi diversi, come confermato dalla microscopia elettronica a trasmissione. L’adattamento di questo strumento per NTA affronterà la necessità di standardizzazione nei metodi NTA per aumentare il rigore e la riproducibilità nella ricerca EV.
Introduction
Le vescicole extracellulari (EV) sono piccole (0,03-2 μm) vescicole legate alla membrana secrete da quasi tutti i tipi di cellule1. Sono spesso indicati come “esosomi”, “microvescicole” o “corpi apoptotici” a seconda del loro meccanismo di rilascio e della dimensione2. Mentre inizialmente si pensava che gli EV fossero semplicemente un mezzo per eliminare i rifiuti dalla cellula per mantenere l’omeostasi3, ora sappiamo che possono anche partecipare alla comunicazione intercellulare tramite il trasferimento di materiale molecolare – tra cui DNA, RNA (mRNA, microRNA), lipidi e proteine4,5 – e che sono importanti regolatori della normale fisiologia e dei processi patologici1, 5,6,7,8.
Esistono molti metodi diversi per isolare e quantificare i veicoli elettrici, che sono stati descritti altrove9,10,11,12. Il protocollo di isolamento utilizzato e la fonte dei veicoli elettrici possono influire notevolmente sulla resa e sulla purezza dei veicoli elettrici. Anche la centrifugazione differenziale, a lungo considerata l’approccio “gold standard” per l’isolamento degli esosomi, può essere soggetta a una sostanziale variabilità che successivamente influisce sulla popolazione EV ottenuta e sulle analisi a valle13. Pertanto, le varie metodologie diverse per l’isolamento e la quantificazione dei veicoli elettrici rendono difficile confrontare, riprodurre e interpretare i risultati degli esperimenti riportati nella letteratura14. Inoltre, il rilascio di EV può essere regolato da condizioni cellulari o vari fattori esterni. È stato suggerito che gli EV svolgono un ruolo nel mantenimento dell’omeostasi cellulare proteggendo le cellule dallo stress intracellulare15, poiché diversi studi hanno dimostrato che lo stress cellulare stimola la secrezione ev. Ad esempio, è stato riportato un aumento del rilascio di EV dopo l’esposizione cellulare a ipossia, stress del reticolo endoplasmatico, stress ossidativo, stress meccanico, estratto di fumo di sigaretta e inquinamento atmosferico da particolato16,17, 18,19,20,21,22. Il rilascio di EV ha anche dimostrato di essere modificato in vivo; topi sottoposti a una dieta ricca di grassi o a digiuno per sedici ore hanno rilasciato più EV di adipociti23. Per indagare se un trattamento o una condizione specifica altera il rilascio di veicoli elettrici, il numero di veicoli elettrici deve essere determinato con precisione. La valutazione della distribuzione delle dimensioni dei veicoli elettrici può anche indicare l’origine subcellulare predominante dei veicoli elettrici (ad esempio, fusione di endosomi tardivi/corpi multivesicolari con la membrana plasmatica rispetto al germogliamento della membrana plasmatica)24. Pertanto, vi è la necessità di metodi robusti per misurare con precisione la concentrazione totale e la distribuzione dimensionale della preparazione EV in fase di studio.
Un metodo rapido e altamente sensibile per la visualizzazione e la caratterizzazione dei veicoli elettrici in soluzione è l’analisi del tracciamento delle nanoparticelle (NTA). Una spiegazione dettagliata dei principi di questo metodo e il confronto con metodi alternativi per la valutazione delle dimensioni e della concentrazione dei veicoli elettrici sono stati descritti in precedenza25,26,27,28. In breve, durante la misurazione NTA, i veicoli elettrici vengono visualizzati dalla luce diffusa quando vengono irradiati con un raggio laser. La luce diffusa viene focalizzata da un microscopio su una fotocamera che registra il movimento delle particelle. Il software NTA tiene traccia del moto termico casuale di ogni particella, noto come moto browniano, per determinare il coefficiente di diffusione che viene utilizzato per calcolare la dimensione di ciascuna particella utilizzando l’equazione di Stokes-Einstein. NTA è stato applicato per la prima volta alla misurazione di veicoli elettrici in un campione biologico nel 201125. Fino a poco tempo fa, c’erano solo due aziende mainstream che offrivano strumenti NTA commerciali29 fino all’introduzione del ViewSizer 3000 (di seguito denominato strumento di tracciamento delle particelle) che utilizza una combinazione di nuove soluzioni hardware e software per superare i limiti significativi di altre tecniche NTA.
Lo strumento di tracciamento delle particelle caratterizza le nanoparticelle in campioni liquidi analizzando il loro moto browniano e caratterizza particelle più grandi di dimensioni micron analizzando l’assestamento gravitazionale. L’esclusivo sistema ottico di questo strumento, che include l’illuminazione multispettrale con tre sorgenti di luce laser (a 450 nm, 520 nm e 635 nm), consente ai ricercatori di analizzare contemporaneamente una vasta gamma di dimensioni delle particelle (ad esempio, esosomi, microvescicole). Uno schema della configurazione dello strumento è mostrato nella Figura 1.
Qui, dimostriamo come eseguire la distribuzione delle dimensioni delle particelle e le misurazioni della concentrazione di veicoli elettrici isolati di topi e umani utilizzando un nuovo strumento NTA.
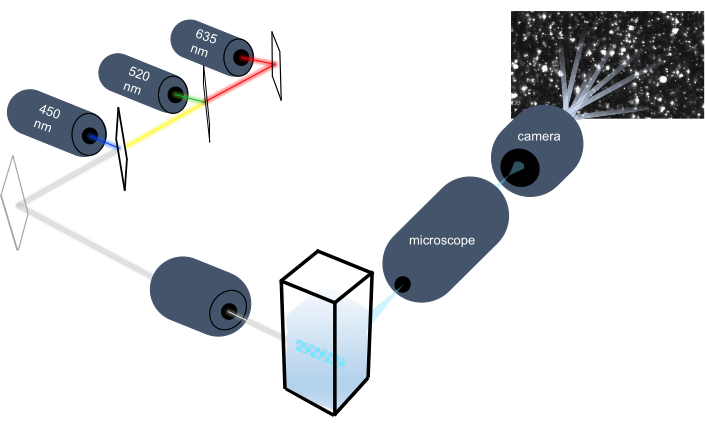
Figura 1: Sistema ottico dello strumento di tracciamento delle particelle. Lo strumento NTA illumina le particelle utilizzando tre laser con le seguenti lunghezze d’onda: 450 nm, 520 nm, 635 nm. La registrazione video della luce diffusa dalle singole particelle viene rilevata e tracciata da una videocamera digitale orientata a 90° dalla cuvetta. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Qui, dimostriamo un protocollo per NTA di veicoli elettrici per misurare la distribuzione dimensionale di un’ampia gamma di dimensioni delle particelle contemporaneamente e misurare la concentrazione totale di EV in un campione polidisperso. In questo studio, il tessuto adiposo perigonadale di topo e il plasma umano sono stati utilizzati come fonte di veicoli elettrici. Tuttavia, gli EV isolati da altri tessuti o fluidi biologici come siero, urina, saliva, latte materno, liquido amniotico e surnatante di coltura cellular…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato supportato dal National Institutes of Health (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Riconosciamo Jeffrey Bodycomb, Ph.D. di HORIBA Instruments Incorporated per il suo aiuto nella calibrazione dello strumento.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
Referenzen
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

