Het meten van de tijdsevolutie van materialen op nanoschaal met stop-flow en small-angle neutronenverstrooiing
Summary
Dit protocol presenteert het gebruik van een gestopte stroommonsteromgeving om snel meerdere vloeibare oplossingen in situ te mengen tijdens een neutronenverstrooiingsmeting met een kleine hoek en om kinetische processen te bestuderen op nanometerlengteschalen en tweede tijdschalen.
Abstract
Dit artikel presenteert het gebruik van een sans-monsteromgeving (Stopped-Flow Small-Angle Neutron-Scattering) om snel vloeistofmonsters te mengen en kinetische processen op nanoschaal te bestuderen op tijdschalen van seconden tot minuten. De stop-flow monsteromgeving maakt gebruik van in de handel verkrijgbare spuitpompen om de gewenste volumes vloeistofmonsters te mengen die vervolgens door een dynamische mixer in een kwartsglascel in ongeveer 1 s worden geïnjecteerd. Tijd-opgeloste SANS-gegevensverzameling wordt gesynchroniseerd met het mengen van monsters om de evolutie van de nanostructuur in oplossing na het mengen te volgen.
Om de neutronenbundeltijd zo efficiënt mogelijk te benutten, gebruiken we een reeks stroomkeuzekleppen om de cel tussen de metingen automatisch te laden, te spoelen en te drogen, waardoor herhaalde gegevensverzameling mogelijk is gedurende meerdere monsterinjecties. Monsterinjecties worden herhaald totdat voldoende neutronenverstrooiingsstatistieken zijn verzameld. De mengopstelling kan worden geprogrammeerd om de omstandigheden systematisch te variëren om de kinetiek te meten bij verschillende mengverhoudingen, monsterconcentraties, additiefconcentraties en temperaturen. Het minimaal benodigde monstervolume per injectie is ongeveer 150 μl, afhankelijk van de padlengte van de kwartscel.
Representatieve resultaten met behulp van deze gestopte stroommonsteromgeving worden gepresenteerd voor snelle lipide-uitwisselingskinetiek in aanwezigheid van een additief, cyclodextrine. De blaasjes wisselen buitenste deelblad (buitenste) lipiden uit in de orde van seconden en wisselen zowel binnen- als buitenlipiden binnen enkele uren volledig uit. Het meten van lipide-uitwisselingskinetiek vereist in situ mengen om de snellere (seconden) en langzamere (minuten) processen vast te leggen en de kinetische snelheidsconstanten te extraheren. Dezelfde monsteromgeving kan ook worden gebruikt om moleculaire uitwisseling in andere soorten vloeibare monsters te onderzoeken, zoals lipide nanodeeltjes, eiwitten, oppervlakteactieve stoffen, polymeren, emulsies of anorganische nanodeeltjes. Het meten van de structurele transformaties op nanoschaal en de kinetiek van uitwisselende of reagerende systemen zal nieuwe inzichten opleveren in processen die op nanoschaal evolueren.
Introduction
Small-angle neutron scattering (SANS) biedt een unieke manier om de groottes, vormen, interacties en organisatie van verschillende materialen te meten op lengteschalen van ≈1 nm tot ≈100 nm 1,2,3. Recente instrumenten, waaronder VSANS (very small-angle neutron scattering) instrumenten met focusspiegels, verleggen de grenzen naar het meten van nog grotere lengteschalen tot ≈1000 nm 4,5. Over het algemeen biedt het unieke verstrooiingscontrast dat inherent is aan neutronenverstrooiingsmethoden verschillende voordelen bij het meten van de tijdsevolutie van nanoschaalstructuren, zoals de aggregatie van componenten in farmaceutische formuleringen6, crosslinking en gelatiereacties in polymeersystemen7,8, bij mesokristallisatie van membraaneiwitten 9,10, afbraak en ontvouwing van eiwitten11,12 , en groei van op silica gebaseerde materialen13,14,15. Het unieke verstrooiingscontrast maakt tijd-opgeloste SANS (TR-SANS) een nuttige aanvulling op andere op stop-flow gebaseerde metingen.
Stop-flow mengmethoden worden vaak geïmplementeerd in small-angle X-ray scattering (SAXS)16,17,18,19,20,21, fluorescentiespectroscopie 22,23,24,25,26 en lichtverstrooiing27,28,29,30, 31,32 experimenten om kinetische processen op de milliseconde tijdschalen te bestuderen. Een belangrijk verschil tussen SANS en SAXS is dat neutronenverstrooiing een niet-destructieve karakteriseringstechniek is, en als zodanig kan SANS worden gebruikt om hetzelfde monster uren of zelfs dagen te meten zonder ioniserende stralingsschade aan het monster, wat kan gebeuren tijdens röntgenverstrooiingsexperimenten met een hogere flux33. Omdat herhaalde SANS-metingen de chemische structuur van het sondemolecuul of monster niet zullen veranderen, kan de tijdsevolutie worden bestudeerd zonder effecten van bijvoorbeeld fotobleaching, wat kinetische metingen kan bemoeilijken die afhankelijk zijn van fluorescentie23,24. Bovendien kan SANS worden gebruikt om sterk geconcentreerde en optisch ondoorzichtige monsters te meten die vaak moeilijk te karakteriseren zijn met op licht gebaseerde technieken zoals dynamische lichtverstrooiing.
Naast het verstrekken van structurele informatie op nanoschaal, kan SANS worden gebruikt om de lokale samenstelling van deze structuren te onderzoeken door de variatie in neutronenverstrooiingslengtedichtheidscontrast. De verstrooiingslengtedichtheid (SLD) van verschillende elementen varieert willekeurig over het periodiek systeem en varieert met verschillende isotopen van hetzelfde element. Een vaak gebruikt voorbeeld is waterstof (1H of H) en deuterium (2H of D), die enorm verschillende neutronenverstrooiingslengtes hebben. Daarom kunnen waterstofrijke materialen, zoals oppervlakteactieve stoffen, lipiden, eiwitten, RNA, DNA en andere polymeren, worden onderscheiden van gedeutereerde oplosmiddelen met behulp van SANS zonder de fysische eigenschappen van het systeem aanzienlijk te veranderen. Het is echter belangrijk op te merken dat H/D-uitwisseling de dichtheid, waterstofbinding en faseovergangstemperaturen in het monster kan beïnvloeden. Niettemin is de unieke gevoeligheid van SANS voor waterstofrijke materialen vooral nuttig in onderzoek naar zachte materie, waar de monsters van belang een lager verstrooiingscontrast en signaal hebben in op röntgenstraling gebaseerde technieken zoals SAXS. Isotopische substitutie maakt SANS ook een krachtig hulpmiddel voor het bestuderen van moleculaire uitwisselingskinetiek in waterstofrijke materialen door eenvoudigweg H-gelabelde en D-gelabelde moleculen te mengen. Isotopische substitutie is vooral nuttig in systemen waar omvangrijke fluorescerende kleurstoffen groter zijn dan de oppervlakteactieve of lipidemoleculen van belang en kan de uitwisselingskinetiek beïnvloeden34,35.
Tijd-opgeloste SANS-metingen zijn voordelig omdat de gemeten intensiteit een functie is van tijd, lengteschaal en SLD-contrast. Als zodanig kunnen TR-SANS-experimenten worden ontworpen om de tijdsafhankelijke veranderingen in de ruimtelijke verdelingen en de samenstelling van de monsters te onderzoeken. Deze unieke voordelen van SANS hebben geleid tot belangrijke inzichten in kinetische processen in veel zachte materiaalsystemen zoals oppervlakteactieve stoffen 36,37,38, emulsies 39,40,41, lipiden 34,42,43,44,45,46,47,48,49 ,50, en polymeren 51,52,53,54,55,56,57,58,59,60,61,62. De meeste TR-SANS-studies hebben zich gericht op tijdschalen van minuten tot uren. Veel kinetische processen van belang vinden echter plaats op de tweede tijdschaal en zijn essentieel voor het begrijpen van de onderliggende mechanismen. Het vastleggen van deze vroege tijdstippen vereist dat de oplossingen snel worden gemengd en in situ worden gemeten, waarbij het mengen wordt gesynchroniseerd met gegevensverzameling tijdens gestopte lichtverstrooiing van 27,28,29,30,31,32, fluorescentie 22,23,24,25,26 en röntgenstraling 16,17,18,19,20,21 experimenten. Dit werk beschrijft het gebruik van een monsteromgeving die is ontworpen om snel meerdere vloeistofmonsters te mengen en het mengsel in een kwartsglascel te injecteren voor TR-SANS-metingen. Het mengapparaat is een aanpassing van het recent ontwikkelde capillaire rheoSANS-apparaat63 en maakt gebruik van meerdere spuitpompen en kleppen om het mengen van monsters te regelen en de celreiniging te automatiseren. Door spuitpompen aan te sluiten op een reeks stroomkeuzekleppen, kunnen meerdere inlaatstromen herhaaldelijk worden gemengd, gemeten, gespoeld en gedroogd om TR-SANS-metingen op de secondentijdschaal te vergemakkelijken.
De huidige procedure gaat ervan uit dat de monsters van belang zijn geïdentificeerd en voorbereid. We richten ons op de in situ mengopstelling en methoden om TR-SANS-gegevens te verzamelen. Neutronenverstrooiingsgegevens werden verzameld op het VSANS-instrument in het NIST Center for Neutron Research (NCNR); de procedure moet echter van toepassing zijn op andere SANS-instrumenten. Lezers die geïnteresseerd zijn in het implementeren van vergelijkbare protocollen op andere SANS-instrumenten, moeten de lokale instrumentwetenschappers raadplegen om de optimale instrumentconfiguratie te bepalen om de neutronenflux te maximaliseren op de gewenste lengteschaal en tijdschaal die het meest relevant zijn voor de kinetische processen van belang. De hier gepresenteerde gegevens werden verzameld met behulp van de high flux ‘white beam’-configuratie op VSANS om het aantal neutronen te maximaliseren bij het verlies van ruimtelijke resolutie5. De detectorwagens werden gepositioneerd om een reeks verstrooiingsvectoren (q), 0,005 Å-1 < q < 0,5 Å-1 te bestrijken, overeenkomend met lengteschalen van ≈130 nm tot ≈13 nm. De verstrooiingsvector wordt gedefinieerd als q = 4π/λ sin (θ/2) waarbij λ de neutronengolflengte is en θ de verstrooiingshoek.
Het stop-flow mengapparaat dat wordt gebruikt voor de TR-SANS-metingen bestaat uit meerdere pompen, spoelspuiten, monsterspuiten, stroomkeuzeschakelaars, evenals een dynamische mixer, monstercel en gemengde monstercontainer, zoals weergegeven in figuur 1. Alle afgedichte vloeistofpaden bevinden zich in een behuizing met airconditioning, die de spuiten, kleppen, verbindingsbuizen, dynamische mixer en monstercellen omvat. Een programmeerbare thermo-elektrische airconditioner wordt gebruikt om de temperatuur van de behuizing te regelen in het bereik van 10 °C tot 50 °C binnen ±1 °C. Merk op dat een deel van de isolatie van de behuizing is verwijderd om de werkende delen van het apparaat te laten zien. De behuizing van het hoofdmengapparaat bevindt zich op een translatiefase op de NG3 VSANS-bundellijn bij de NCNR. De positie van de behuizing wordt aangepast met behulp van de translatiefase om de monstercel in het pad van de neutronenbundel te plaatsen (gele stippellijn).

Figuur 1: Een voorbeeldopstelling voor het combineren van stop-flow menging en kleinhoek neutronenverstrooiingsmetingen aan de VSANS-bundellijn in het NIST Center for Neutron Research. De opstelling bevat vier spuitpompen, twee spuiten voor het spoelen van oplosmiddelen en twee spuiten voor monsterinjectie, vier pompkeuzekleppen, twee mixerkeuzekleppen, een dynamische mixer, een doorstroomkwartscel en een gemengde monstercontainer. Invallende neutronen verstrooien het gemengde monster dat zich in de monstercel bevindt. Een geïsoleerde behuizing met kwartsvensters en een thermo-elektrische airconditioning wordt gebruikt om het monster en alle apparatuur op een constante temperatuur te regelen. De gele stippellijn toont het neutronenbundelpad. Schaalbalk = 10 cm. Klik hier om een grotere versie van deze figuur te bekijken.
Het apparaat in figuur 1 is geconfigureerd met twee monsterspuiten, twee spoelspuiten en één monstercel. Overeenkomstige stroomdiagrammen voor de verschillende stappen van het protocol worden geïllustreerd in figuur 2. De gewenste volumes van de twee verschillende monsters worden in de menger en de monstercel geïnjecteerd (figuur 2A). Zodra de monstercel is gevuld, worden de inlaatschakelaarklep (ISV) en de uitlaatschakelaarklep (OSV) gesloten om de monstercel te isoleren van de dynamische mixer en om te voorkomen dat het monster tijdens het verzamelen van TR-SANS-gegevens in de cel wordt teruggevoerd (figuur 2B). Vóór de dynamische mixer varieert de aansluitbuis in lengte van 10 cm tot 1 m en heeft deze geen invloed op de mengvertragingstijd. Buisverbindingen tussen de dynamische menger en de monstercel hebben echter invloed op de mengvertragingstijd en het vereiste monsterinjectievolume. Voorgesneden roestvrijstalen buizen met een binnendiameter van 0,04 inch (1 mm) en een lengte van 100 mm worden gebruikt om de dynamische mixer, de mixerkeuzekleppen (MSV1 en MSV2) en de ISV en OSV aan te sluiten. Gefluoreerde buizen met een binnendiameter van 1 mm en een lengte van 115 mm worden gebruikt om de ISV en OSV (of de dynamische mixeruitlaat) op de monstercel aan te sluiten. Het totale leegtevolume dat de mengvertragingstijd beïnvloedt, omvat het vacuülevolume van de menger (0,15 ml), de slang tussen de mixeruitlaat en de inlaat van de monstercel (0,09 ml) en het volume van de monstercel (0,16 ml). In dit voorbeeld is het totale leegtevolume 0,4 ml. De interne leegtevolumes van kleppen zijn verwaarloosbaar in vergelijking met de volumes van slangen, mixer en monstercellen. De gebruikte lagedrukkeuzekleppen (boringsdiameter van 0,75 mm) bevatten bijvoorbeeld geschatte leegtevolumes van 4 μl, terwijl de hogedrukkeuzekleppen en schakelkleppen (boringsdiameter van 0,25 mm) ongeveer lege volumes van 0,5 μl bevatten.
Nadat de TR-SANS-meting is voltooid, wordt het monster met oplosmiddel uit de cel geduwd en wordt het spoeloplosmiddel herhaaldelijk door de cel gepompt om het resterende monster te verwijderen en de monstercel te reinigen (figuur 2C). Merk op dat de spoelspuiten zijn aangesloten op grotere oplosmiddelreservoirs (bijv. Water en ethanol) via pompkeuzewaarden om ervoor te zorgen dat er voldoende oplosmiddelvolumes beschikbaar zijn om de monstercel tussen meetruns te reinigen. Oplosmiddelbronnen, monsterbronnen en gemengde monstercontainers die ontvlambare vloeistoffen bevatten, worden in een aparte behuizing zonder elektrische apparatuur geplaatst om alle mogelijke ontstekingsbronnen te elimineren. Bovendien worden dampsluitende flessendoppen gebruikt om brandbare dampen en oplosmiddelverdamping te minimaliseren. Ten slotte wordt de monstercel gedroogd met een stikstofgasstroom om het resterende spoeloplosmiddel te verwijderen (figuur 2D). De inlaatstikstofgasdruk naar de mixerkeuzeklep wordt geregeld tot ongeveer 2 bar (0,2 MPa, manometerdruk) met behulp van een handmatige drukregelaar op de stikstofgasfles. Zodra de monstercel voldoende is gereinigd en gedroogd, wordt een nieuw gemengd monster in de monstercel geïnjecteerd voor de volgende meetcyclus (waarbij het mengen en injecteren wordt herhaald zoals geïllustreerd in het stroomdiagram in figuur 2A).
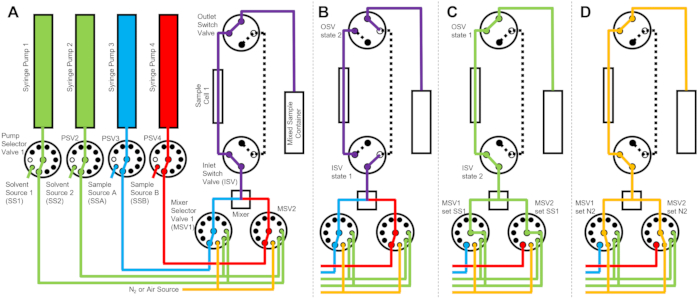
Figuur 2: Voorbeeldstroomdiagram met één monstercel, twee mengmonsters en twee spoelmiddelen voor reiniging . (A) Mengen van monster A (blauw) en monster B (rood) en vervolgens het gemengde monster (paars) in de monstercel laten stromen. B) Tijdens het verzamelen van gegevens geeft de stop-flow-inrichting aan waar de ISV- en OSV-schakelkleppen gesloten zijn om de monstercel te isoleren en terugdiffusie van het monster tijdens het verzamelen van gegevens te voorkomen. (C) De reinigingsstappen waarbij de monstercel na gegevensverzameling wordt gespoeld met spoelmiddel uit SS1 (groen). D) Droogstap waarbij de monstercel wordt gedroogd met stikstofgas (oranje). Afkortingen: PSV = pompkeuzeklep; MSV = mixerkeuzeklep; OSV = uitlaatschakelaarklep; ISV = inlaatschakelaarklep; SS1 = oplosmiddelbron 1; SSA = monsterbron A; N2 = stikstofgasbron. Klik hier om een grotere versie van deze figuur te bekijken.
Figuur 3 toont stroomschema’s voor een iets andere versie waarin de mengopstelling is geconfigureerd met twee afzonderlijke monstercellen die op dezelfde schakelkleppen zijn aangesloten (figuur 3A). Terwijl TR-SANS-gegevens worden verzameld in monstercel 1, wordt monstercel 2 gespoeld (figuur 3B) en gedroogd (figuur 3C). Wanneer de gegevensverzameling voor monstercel 1 is voltooid, leidt de inlaatschakelaarklep een nieuw gemengd monster naar monstercel 2 voor gegevensverzameling (figuur 3D). Terwijl TR-SANS-gegevens worden verzameld in monstercel 2, wordt monstercel 1 gespoeld en gedroogd (figuur 3E). Dit alternatieve, parallelle proces tussen twee monstercellen minimaliseert de tijd tussen volgende monsterinjecties en maximaliseert het gebruik van neutronenbundeltijd.
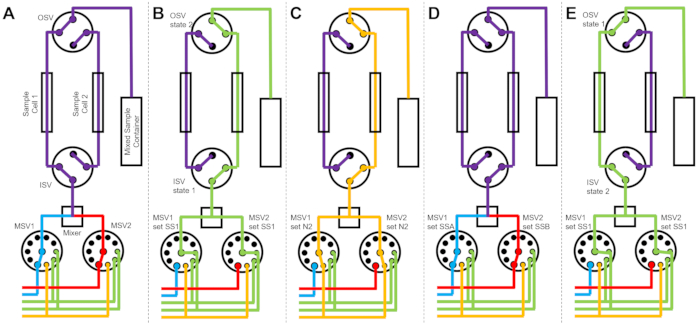
Figuur 3: Voorbeeld stroomdiagram met behulp van cellen met twee monsters, twee mengmonsters en twee spoelmiddelen voor reiniging. A) Meng monster A (blauw) en monster B (rood) en laat het gemengde monster (paars) vervolgens in monstercel 1 stromen. B) De toestand van de stop-flow inrichting tijdens het verzamelen van gegevens op monstercel 1, terwijl monstercel 2 wordt gespoeld met oplosmiddel uit SS1 (groen). (C) De toestand van de gestopte stroominrichting tijdens het verzamelen van gegevens op monstercel 1 terwijl monstercel 2 wordt gedroogd met stikstofgas (oranje). D) Zodra de gegevensverzameling van monstercel 1 is voltooid, wordt onmiddellijk een nieuw monster (paars) gemengd en in monstercel 2 gestroomd. (E) De toestand van de stop-flow inrichting tijdens het verzamelen van gegevens op monstercel 2 terwijl monstercel 1 wordt gespoeld met oplosmiddel uit SS1 (groen). Terwijl de ene monstercel wordt gemeten, wordt de andere monstercel gereinigd en gedroogd. Het stop-flow meetproces wisselt af tussen twee monstercellen om de tijd tussen volgende monstermenginjecties te minimaliseren. Afkortingen: PSV = pompkeuzeklep; MSV = mixerkeuzeklep; OSV = uitlaatschakelaarklep; ISV = inlaatschakelaarklep; SS1 = oplosmiddelbron 1; SSA = monsterbron A; N2 = stikstofgasbron. Klik hier om een grotere versie van deze figuur te bekijken.
Hieronder wordt een stapsgewijs protocol beschreven voor het aansluiten van de pompen en leidingen, het primen van het systeem, het spoelen en drogen van de monstercel en het injecteren van het gemengde monster. Hoewel de eencellige configuratie voor eenvoud wordt gedemonstreerd (figuur 2), kunnen de flexibele modulaire opstelling, het protocol en de scripts eenvoudig worden gewijzigd om meer spuitpompen, kleppen, mixers of monstercelconfiguraties te implementeren, zoals de configuratie met twee monstercellen in figuur 3. Representatieve gegevens over de snelheid van het aantal ruwe neutronen die tijdens meng- en reinigingsinjectiecycli zijn verzameld, worden weergegeven in figuur 4, terwijl de lipidenuitwisselingskinetiek gemeten bij 3 verschillende temperaturen en de geëxtraheerde genormaliseerde verspreide intensiteit die overeenkomt met de fractie van uitgewisselde lipiden worden weergegeven in respectievelijk figuur 5 en figuur 6.
Protocol
Representative Results
Discussion
De huidige procedure beschrijft het mengapparaat en de stappen voor het uitvoeren van TR-SANS-metingen met gestopt stroom. Het apparaat en protocol zijn geoptimaliseerd voor vloeistofmonsters met een lage viscositeit waarbij de relevante tijdschalen ≈1 s tot 5 minuten zijn. Voor tijdschalen van meer dan 5 minuten kan het handmatig mengen van de monsters en het laden ervan in standaard verstrooiingscellen gemakkelijker en wenselijk zijn, vooral voor monsters met een hoge viscositeit, gels of pasta’s. Toegang tot tijdsch…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Toegang tot de NG3 VSANS werd geboden door het Center for High-Resolution Neutron Scattering, een samenwerkingsverband tussen het National Institute of Standards and Technology en de National Science Foundation onder overeenkomst nr. DMR-2010792. M.H.L.N erkent de financiering door Mitacs Globalink (Canada). De identificatie van commerciële producten of handelsnamen is bedoeld om begrip te bevorderen en impliceert geen goedkeuring of aanbeveling door het National Institute of Standards and Technology.
Materials
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
Referenzen
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101 (2007).
- Grillo, I., Borsali, R., Pecora, R. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. , (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31 (2015).
- Barker, J. G., Kline, S., et al. . 2019 NCNR Annual Report, Special Publication (NIST SP). , (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470 (2021).
- van’t Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948 (2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349 (2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227 (2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142 (2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874 (2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) – Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -. T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -. T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101 (2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591 (2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667 (2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302 (2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D., Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. , 51 (2013).
- Choi, S. -. H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802 (2010).
- Choi, S. -. H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599 (2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov Available from: https://github.com/usnistgov/stopped-flow-sans (2021)
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111 (2020).

