FAHD1 Proteininin Domuz Böbreği ve Fare Karaciğerinden Ekstraksiyonu ve Saflaştırılması
Summary
Bu protokol, domuz böbreği ve fare karaciğerinden fumarilasetotat hidrolaz alan içeren protein 1’in (FAHD1) nasıl çıkarılacağını açıklar. Listelenen yöntemler ilgilenilen diğer proteinlere uyarlanabilir ve diğer dokular için modifiye edilebilir.
Abstract
Fumarilasetotat hidrolaz alan içeren protein 1 (FAHD1), ökaryotlarda FAH süper ailesinin ilk tanımlanmış üyesidir ve mitokondride oksaloasetat dekarboksilaz olarak işlev görür. Bu makalede, FAHD1’in domuz böbreği ve fare karaciğerinden ekstraksiyonu ve saflaştırılması için bir dizi yöntem sunulmaktadır. Kapsanan yöntemler hızlı protein sıvı kromatografisi (FPLC) ile iyonik değişim kromatografisi, FPLC ile preparatif ve analitik jel filtrasyonu ve proteomik yaklaşımlardır. Toplam protein ekstraksiyonundan sonra, amonyum sülfat çökeltmesi ve iyonik değişim kromatografisi araştırıldı ve FAHD1, iyonik değişim ve boyut dışlama kromatografisi kullanılarak sıralı bir strateji ile ekstrakte edildi. Bu temsili yaklaşım, ilgilenilen diğer proteinlere (önemli seviyelerde ifade edilir) uyarlanabilir ve diğer dokular için modifiye edilebilir. Dokudan saflaştırılmış protein, yüksek kaliteli antikorların ve / veya güçlü ve spesifik farmakolojik inhibitörlerin gelişimini destekleyebilir.
Introduction
Ökaryotik FAH etki alanı içeren protein 1 (FAHD1), iki fonksiyonlu oksaloasetat (OAA) dekarboksilaz (ODx)1 ve asilpiruvat hidrolaz (ApH)2 olarak işlev görür. Mitokondri2’de lokalizedir ve 1,2,3,4,5,6 enzimlerinin geniş FAH süper ailesine aittir. ApH aktivitesi sadece küçük bir öneme sahip olsa da, FAHD1’in ODx aktivitesi, TCA döngü akısı1,7,8,9’un düzenlenmesinde rol oynar. OAA sadece trikarboksilik asit döngüsündeki merkezi sitrat sentaz reaksiyonu için gerekli değildir, aynı zamanda elektron taşıma sisteminin bir parçası olarak ve bir kataplerotik metabolit olarak süksinat dehidrogenazın rekabetçi bir inhibitörü olarak da işlev görür. İnsan göbek damarı endotel hücrelerinde (HUVEC) FAHD1 gen ekspresyonunun aşağı regülasyonu, hücre proliferasyon hızında10 önemli bir azalmaya ve glikolize eşzamanlı bir geçişle ilişkili mitokondriyal membran potansiyelinin önemli ölçüde inhibisyona neden olmuştur. Çalışma modeli, mitokondriyal OAA seviyelerinin FAHD1 aktivitesi 1,8,9 tarafından sıkı bir şekilde düzenlendiği mitokondriyal disfonksiyon ile ilişkili yaşlanma (MiDAS)11 benzeri fenotip 8’i ifade eder.
Rekombinant proteinin dokudan ziyade bakteri12’den ekspresyon ve saflaştırma yoluyla elde edilmesi daha kolaydır. Bununla birlikte, bakterilerde eksprese edilen bir protein, post-translasyonel modifikasyonların olası eksikliği nedeniyle önyargılı olabilir veya basitçe sorunlu olabilir (yani, plazmid kaybı, bakteriyel stres tepkileri, çarpık / şekilsiz disülfit bağları, hiç veya zayıf sekresyon, protein agregasyonu, proteolitik bölünme, vb. Nedeniyle). Bazı uygulamalar için, bu tür modifikasyonları dahil etmek ve / veya olası eserleri dışlamak için hücre lizatından veya dokudan protein elde edilmesi gerekir. Dokudan saflaştırılmış protein, FAHD113 gibi seçilmiş enzimler için yüksek kaliteli antikorların ve / veya güçlü ve spesifik farmakolojik inhibitörlerin gelişimini destekler.
Bu el yazması, FAHD1’in domuz böbreği ve fare karaciğerinden ekstraksiyonu ve saflaştırılması için bir dizi yöntem sunmaktadır. Tarif edilen yöntemler hızlı protein sıvı kromatografisi (FPLC) gerektirir, ancak aksi takdirde ortak laboratuvar ekipmanı kullanır. Alternatif yöntemler başka yerlerde bulunabilir14,15,16,17. Toplam protein ekstraksiyonundan sonra, önerilen protokol, amonyum sülfat çökeltmesi ve iyonik değişim kromatografisi için alt protokollerin tartışıldığı bir test aşamasını içerir (Şekil 1). Bu alt protokolleri tanımladıktan sonra, ilgilenilen protein, FPLC ile iyonik değişim ve boyut dışlama kromatografisi kullanılarak sıralı bir strateji ile çıkarılır. Bu kılavuzlara dayanarak, nihai protokol diğer ilgili proteinler için ayrı ayrı uyarlanabilir.
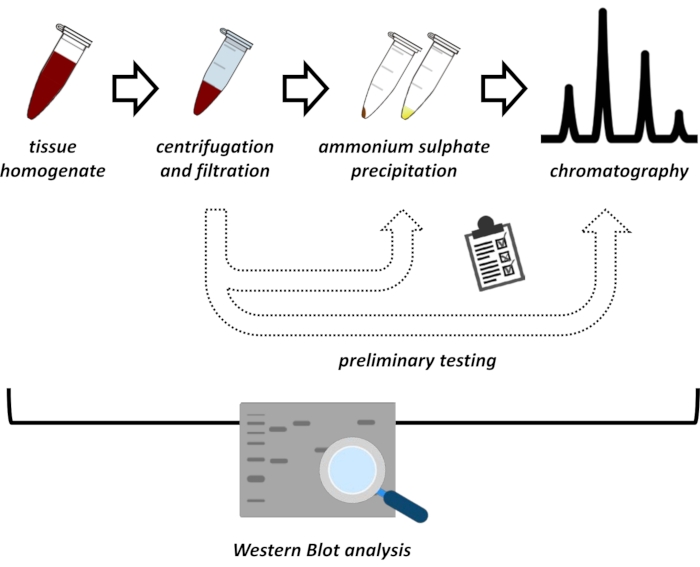
Şekil 1: Bu protokolün genel stratejisi. Yukarıdan aşağıya: Protein dokulardan çıkarılır. Doku homojenatı hazırlanır, santrifüj edilir ve filtrelenir. Her bir süpernatant ve pelet türevi numune çifti için, optimum koşullar için prob yapmak üzere amonyum sülfat çökeltme ve iyonik değişim kromatografisi (FPLC) testleri yapılmalıdır. Bu alt protokolleri oluşturduktan sonra, protein, değişen pH ve tuz konsantrasyonlarında sıralı bir amonyum sülfat çökeltme, iyonik değişim kromatografisi ve tekrarlayan boyut dışlama kromatografisi (FPLC) prosedürü ile ekstrakte edilebilir. Tüm adımların batı lekesi tarafından kontrol edilmesi gerekir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Protokoldeki kritik adımlar
Proteinlerin işlenmesi için ortak yönergeleri izlemek, buz üzerinde ve ılımlı pH ve tuz koşullarında çalışmak gibi esastır. Proteaz inhibitörlerinin kullanımı yöntem için faydalıdır, proteazom inhibitörlerinin kullanımı şiddetle tavsiye edilir. Numunenin dondurulması ve çözülmesi her zaman protein çökelmesine (en azından kısmen) neden olabilir, bu nedenle ilk protein lizatının çözülmüş herhangi bir alikotu (adım 2) ara vermeden süre…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Yazarlar, Ayşe Öztürk ve Eva Albertini’nin teknik yardımları için çok müteşekkirdir. Karaciğer dokusunun oluşumu için kullanılan fareler, Univ.-Doz gözetiminde tutuldu. Dr. Pidder Jansen-Dürr (Innsbruck Üniversitesi Biyomedikal Yaşlanma Araştırmaları Enstitüsü, Rennweg 10, 6020 Innsbruck, Avusturya).
Materials
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | – | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | – | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | – | – | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | – | – | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
Referenzen
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily – A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).

