多路复用表面等离子体共振成像芯片上的多模态分析平台,用于分析细胞外囊泡亚群
Summary
本文提出了新一代多参数分析平台,具有更高的通量,用于表征细胞外囊泡亚群。该方法基于多重生物传感方法与原子力显微镜的计量和形态力学分析相结合,结合拉曼光谱,以鉴定捕获在微阵列生物芯片上的囊泡靶标。
Abstract
细胞外囊泡(EV)是由所有细胞产生的膜衍生的微小囊泡,直径范围为50至数百纳米,用作细胞间通讯的手段。它们正在成为各种疾病的有前途的诊断和治疗工具。细胞使用两种主要的生物发生过程来生产大小、组成和含量不同的 EV。由于它们的大小、组成和细胞来源高度复杂,它们的表征需要结合分析技术。该项目涉及开发新一代多参数分析平台,具有更高的吞吐量,用于表征电动汽车的亚群。为了实现这一目标,这项工作从该小组建立的纳米生物分析平台(NBA)开始,该平台允许基于多重生物传感方法与原子力显微镜(AFM)的计量和形态力学分析相结合的EV进行原始研究微阵列生物芯片上捕获的囊泡靶标。目的是通过拉曼光谱的表型和分子分析来完成这项 EV 研究。这些发展使得能够提出一种多模态且易于使用的分析解决方案,用于区分具有临床潜力的生物体液中的EV亚群
Introduction
对诊断和治疗学1,2,3,4,5中的EV研究的兴趣日益浓厚,加上该领域面临的挑战,导致开发和实施各种方法来量化或表征这些囊泡的方法和技术。最广泛使用的EV鉴定方法是蛋白质特异性免疫印迹和蛋白质组学,以确认EV的来源,透射电子显微镜(TEM)以确认其结构,以及纳米颗粒跟踪分析(NTA)以量化其在样品体积中的数量和尺寸分布。
然而,这些技术本身都不能提供表征EV子集所需的所有信息。由于电动汽车生化和物理特性的多样性,其固有的异质性阻碍了可靠和可重复的全球分析,特别是对于混合物(粗样品)中所含的电动汽车。因此,电动汽车需要检测和表征方法,无论是单独还是一般,以补充其他更快但非选择性的方法6。
通过TEM(或cryoTEM)或AFM进行高分辨率成像,可以确定纳米分辨率为7,8,9,10,11,12的EV的形态和计量。然而,将电子显微镜用于生物物体(例如EV)的主要限制是需要真空来进行研究,这需要对样品进行固定和脱水。这种制备使得很难从观察到的结构转化为溶液内的EV形态。为了避免样品脱水,cryoTEM技术最适合EV表征13。它广泛用于确定电动汽车的超微结构。通过生物功能化的金纳米颗粒对囊泡进行免疫标记,还可以识别EV的特定亚群,并将其与复杂生物样品中存在的其他颗粒区分开来。然而,由于通过电子显微镜分析的EV数量很少,因此通常难以进行代表复杂和异质样品的表征。
为了揭示这种大小异质性,国际细胞外囊泡学会(ISEV)建议分析足够数量的宽场图像,并伴有较小的图像,以揭示具有高分辨率14的单个EV。AFM是用于研究电动汽车的光学方法和电子衍射技术的替代方案。该技术使用由柔性悬臂固定的锋利尖端,该悬臂逐行扫描沉积在一个支架上的样品,并通过反馈回路调整尖端与存在的元件之间的距离。这使得表征样品的形貌并收集形态力学信息成为可能15,16,17,18。EV可以在沉积在原子平坦的基板上后,或者在由抗体,肽或适配体功能化的特定底物上捕获以表征各种亚群后通过AFM进行扫描18,19。由于AFM能够在复杂的生物样品中定量并同时探测EV的结构、生物力学和膜生物分子含量,而无需预处理、标记或脱水,因此现在越来越多地用于在温度和介质的生理条件下以精细和多参数的方式表征EV。
本文提出了一种使用核心金生物芯片的方法,该方法能够以多重形式进行(生物)化学功能化。该基板是强大的分析平台的基石,该平台结合了通过表面等离子体共振对EV亚群进行生物检测,一旦EV被吸附/接枝或免疫捕获到芯片上,AFM就可以对EV进行计量和形态力学表征。结合芯片上捕获的EV子集的拉曼特征,该分析平台能够以无标记的方式鉴定生物样品中存在的EV,而无需任何分析前步骤。本文表明,强大的技术与高度严格的底物制备和数据采集方法相结合,使EV分析具有深入性、确定性和稳健性。
该方法的原理是制备金基底,吸附/嫁接或捕获EV亚型,并通过AFM扫描它们以估计每个EV亚群的大小和形态。此外,这些吸附的电动汽车通过拉曼光谱进行分析。事实上,这种底物可以呈现三种日益复杂的界面:裸界面、化学功能化界面或配体微阵列。在描述协议的不同步骤之前,读者参考 图1中纳米生物分析平台(NBA)方法的示意图,该方法结合了表面等离子体共振成像(SPRi),AFM和光谱学。
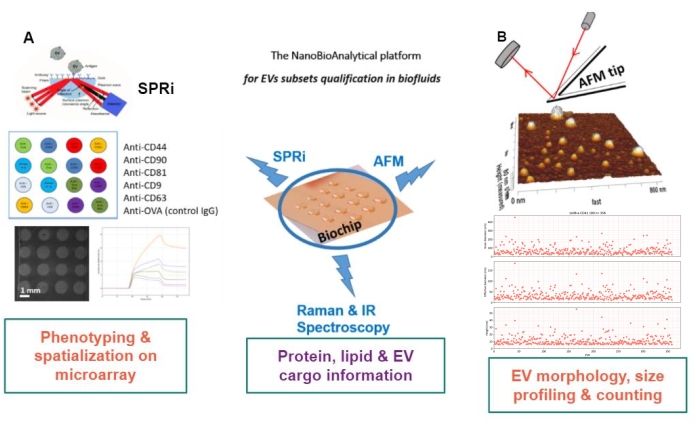
图1:纳米生物分析平台。该方法结合了(A)表面等离子体共振成像,(B)原子力显微镜和红外/拉曼(纳米)光谱,所有这些都在同一基板上 – 多路复用金芯片。缩写:NBA = 纳米生物分析平台;SPRi = 表面等离子体共振成像;AFM = 原子力显微镜;EV = 细胞外囊泡。 请点击此处查看此图的大图。
核心金生物芯片构成了该平台的核心,因为所有无标记表征技术都是在该生物芯片上进行的。根据 EV 表征的需求(全球/总 EV 或 EV 子集)和所用方法的局限性/要求,已经开发了三种类型的金生物芯片表面:“裸”,化学功能化的“C11/C16”或配体生物功能化的,称为“配体”金表面。
这种被称为“裸体”的裸生物芯片能够简单地将电动汽车吸附在黄金上。可以选择使用的缓冲液,并以被动方式(孵育然后冲洗步骤)或在流动下(在SPRi中)监测其实现这种吸附。此外,这种被动吸附既可以在整个芯片上(作为宏阵列)实现,也可以使用微量移液器点样器定位在微阵列中。“流动下程序”允许研究人员跟踪动力学和EV吸附水平。当化学层界面可能干扰分析方法(例如,用于拉曼光谱)时,在裸金衬底上采用这种方法。
化学功能化的生物芯片称为“C11/C16”,用于通过与硫醇酸盐形成伯酰胺键,在金表面上共价结合的EV的致密而坚固的“地毯”,目的是获得EV样品的全局视图。事实上,在这种情况下,金被巯基-1-十一醇(11-MUOH:“C11”)和巯基-1-十六烷酸(16-MHA:“C16”)的硫代酸盐混合物官能化,并且一小部分硫醇酸盐被化学活化以建立与靶标的共价结合。同样,这种策略可以被动地(孵育然后冲洗步骤,无论是在“宏阵列”中还是在多个微阵列中使用微量移液器点样器)或在流速下(在SPRi中)实现,以跟踪EV接枝在金表面上的动力学和水平。
配体 生物功能化的生物芯片,称为 “配体”,被化学激活以共价移植不同的配体(例如,抗体,受体),以选择性地捕获(亲和力)在生物样品中共存的不同EV亚群。
Protocol
Representative Results
Discussion
最近使用最广泛的 EV 鉴定方法是蛋白质特异性免疫印迹法,用于确认 EV 的来源,TEM 以确认其结构,以及 NTA 以量化其在样品体积中的数量和大小分布3。然而,(生物)医学研究中对电动汽车的高度兴趣以及现有分析工具的局限性促使科学界开发用于电动汽车表征、区分和量化的新方法。
大多数开发侧重于将免疫标记或免疫捕获原理与用于EV检测的先进物理…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
来自IVETh核心设施(巴黎)的Kelly Aubertin和Fabien Picot因拉曼成像实验而获得认可。Thierry Burnouf(台湾台北医科大学)和Zuzana Krupova(来自法国Helincourt)分别提供来自血小板和牛奶样本的EV样本。这项工作得到了勃艮第地区弗朗什-孔泰地区和欧洲 EIPHI 研究生院的支持(新手项目,2021-2024 年)。这项工作的一部分是使用CLIPP平台和FEMTO-ENGINEERING的RENATECH洁净室设施完成的,为此我们感谢Rabah Zeggari。
Materials
| CD41a antibody | Diaclone SAS (France) | 447528 | |
| CP920 | Microparticles GmbH, Germany | 448303 | |
| DXR3xi | Thermo Fisher Scientific | T1502 | |
| EDC | Sigma | A6272 | |
| Ethanolamine | Sigma | P5368-10PAK | |
| Evs derived from platelet concentrates | Collaboration : Pr T. Burnouf (TMU, Taipei) | S2889 | |
| Evs from bovine milk | Collaboration : Dr Z. Krupova (Excilone, Helincourt – France) | 3450 | |
| Glutaraldehyde | Sigma | 56845 | |
| Gwyddion | 853.223.020 | ||
| Magnetron sputtering | PLASSYS | SAB5300165 | |
| mercapto-1-hexadecanoic acid | Sigma | G5882 | |
| Mercapto-1-undecanol | Sigma | O8001 | |
| Mountains SPIP ones | Digital Surf | ||
| NanoWizard 3 Bioscience | Bruker-JPK | ||
| Octyl Glucoside (OG) | Sigma | ||
| Ovalbumine antibody | Sigma | ||
| Phosphate Buffer Saline (PBS) | Sigma | ||
| Rat Albumin Serum (RSA) | Sigma | ||
| Sodium acetate buffer | Sigma | ||
| SPR-Biacore 3000 | GE Healthcare/ Cytiva life sciences | ||
| SPRi Biochip | MIMENTO technology platform | The biochips were produced in-house in the clean room, Besancon | |
| SPRi Plex II | Horiba Scientific | ||
| Sulfo-NHS | Sigma |
Referenzen
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs – EVOLVE France". Advanced Drug Delivery Reviews. 179, 114001 (2021).
- Xunian, Z., Kalluri, R. Biology and therapeutic potential of mesenchymal stem cell-derived exosomes. Cancer Science. 111 (9), 3100-3110 (2020).
- Hartjes, T. A., et al. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Biotechnik. 6 (1), 7 (2019).
- Xing, Y., et al. Analysis of extracellular vesicles as emerging theranostic nanoplatforms. Coordination Chemistry Reviews. 424, 213506 (2020).
- Wang, T., Xing, Y., Cheng, Z., Yu, F. Analysis of single extracellular vesicles for biomedical applications with especial emphasis on cancer investigations. Trends in Analytical Chemistry. 152, 116604 (2022).
- Boireau, W., Elie-Caille, C. Extracellular vesicles: Definition, isolation and characterization. Medecine Sciences: M/S. 37 (12), 1092-1100 (2021).
- Brisson, A. R., et al. Extracellular vesicles from activated platelets: A semiquantitative cryo-electron microscopy and immuno-gold labeling study. Platelets. 28 (3), 263-271 (2017).
- Yuana, Y., et al. Atomic force microscopy: A novel approach to the detection of nanosized blood microparticles. Journal of Thrombosis and Haemostasis. 8 (2), 315-323 (2010).
- Sebaihi, N., de Boeck, B., Yuana, Y., Nieuwland, R., Pétry, J. Dimensional characterization of extracellular vesicles using atomic force microscopy. Measurement Science and Technology. 28 (3), 034006 (2017).
- Beekman, P., et al. Immuno-capture of extracellular vesicles for individual multi-modal characterization using AFM, SEM and Raman spectroscopy. Lab on a Chip. 19 (15), 2526-2536 (2019).
- Malenica, M., et al. Perspectives of microscopy methods for morphology characterisation of extracellular vesicles from human biofluids. Biomedicines. 9 (6), 603 (2021).
- Verweij, F. J., et al. The power of imaging to understand extracellular vesicle biology in vivo. Nature Methods. 18 (9), 1013-1026 (2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Obeid, S., et al. NanoBioAnalytical characterization of extracellular vesicles in 75-nm nanofiltered human plasma for transfusion: A tool to improve transfusion safety. Nanomedicine: Nanotechnology, Biology, and Medicine. 20, 101977 (2019).
- Obeid, S., et al. Development of a NanoBioAnalytical platform for «on-chip» qualification and quantification of platelet-derived microparticles. Biosensors and Bioelectronics. 93, 250-259 (2017).
- Ridolfi, A., et al. AFM-based high-throughput nanomechanical screening of single extracellular vesicles. Analytical Chemistry. 92 (15), 10274-10282 (2020).
- Vorselen, D., et al. The fluid membrane determines mechanics of erythrocyte extracellular vesicles and is softened in hereditary spherocytosis. Nature Communications. 9 (1), 4960 (2018).
- Hardij, J., et al. Characterisation of tissue factor bearing extracellular vesicles with AFM: Comparison of air-tapping-mode AFM and liquid Peak Force AFM. Journal of Extracellular Vesicles. 2, 21045 (2013).
- Jorgensen, M., et al. Extracellular Vesicle (EV) Array: Microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping. Journal of Extracellular Vesicles. 2, 20920 (2013).
- Remy-Martin, F., et al. Surface plasmon resonance imaging in arrays coupled with mass spectrometry (SUPRA-MS): Proof of concept of on-chip characterization of a potential breast cancer marker in human plasma. Analytical and Bioanalytical Chemistry. 404 (2), 423-432 (2012).
- Czamara, K., et al. Raman spectroscopy of lipids: A review. Journal of Raman Spectroscopy. 46 (1), 4-20 (2015).
- Penders, J., et al. Single particle automated Raman trapping analysis of breast cancer cell-derived extracellular vesicles as cancer biomarkers. ACS Nano. 15 (11), 18192-18205 (2021).
- Baek, S. J., Park, A., Ahn, Y. J., Choo, J. Baseline correction using asymmetrically reweighted penalized least squares smoothing. Analyst. 140 (1), 250-257 (2015).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246 (2016).
- Ertsgaard, C. T., et al. Integrated nanogap platform for sub-volt dielectrophoretic trapping and real-time Raman imaging of biological nanoparticles. Nano Letters. 18 (9), 5946-5953 (2018).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).

