磁共振扩散张量成像在神经退行性疾病的分析
Summary
弥散张量成像(DTI)基本上作为一个基于MRI的工具来识别<em>在体内</em>,大脑由于脑白质内神经系统疾病和病理过程中的微观结构。 DTI为基础的分析允许应用程序在组级和单一主体数据的脑部疾病。
Abstract
弥散张量成像(DTI)技术提供脑白质(WM) 在体内的微观过程的信息。本应用程序旨在探讨WM参与模式的差异,不同的脑部疾病,特别是神经退行性疾病,通过使用不同的DTI分析与匹配的对照比较。
DTI数据进行分析在变量的时尚,为了在集团层面, 即 voxelwise比较区域扩散方向的指标,如各向异性分数(FA),连同纤维跟踪(FT)陪同由的各向异性分数tractwise统计(TFAS)找出差异在FA随着WM结构,瞄准在组级别的WM改变区域格局的定义。改造成一个立体的标准空间组研究的前提条件是,需要彻底的数据处理到维护directional相互依存关系。本应用表明,优化的技术方法定向和定量的信息保存在集团层面在空间数据分析正常化。在此基础上,FT技术可以应用到组的场均数据,以量化指标信息,通过FT。此外,应用DTI方法, 即差异FA-映射后立体对齐,在个别科目进行纵向分析揭示神经系统疾病的进展信息。在预处理过程中应用受控消除高噪音水平的梯度方向,可以得到的DTI基于结果的质量进一步改善。
总之,DTI被用来定义一个独特的WM pathoanatomy的全脑和基于道DTI分析相结合的不同的脑疾病的。
Introduction
弥散张量成像技术在人类大脑
在中枢神经系统的白质(WM)大片密密麻麻轴突除了各种类型的神经胶质和其他小的细胞群体组成。轴突膜以及对齐的蛋白质纤维轴突内限制水的扩散垂直于纤维取向,导致脑WM 1中的各向异性水扩散。髓鞘的轴突周围也可能有助于各向异性的两个内和细胞外的水2。
扩散张量成像(DTI)可检测到这种各向异性的定量描述。 DTI生产组织与当地的微观结构特征的水扩散加权图像。的图象在每个位置上的强度衰减,根据所谓的磁扩散梯度的强度和方向(表示在b值),以及本地的显微组织,其中的水分子扩散,扩散系数 D,一个标量值:
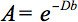
然而,在WM中的各向异性的存在下,扩散可以不再其特征在于由一个单一的标量系数,但要求一个张量 在第一近似描述分子的流动性,沿各个方向,这些方向之间的相关性4。扩散的各向异性的原因,主要是通过WM中的纤维束的方向和由它的微观和宏观结构的功能的影响。的微观结构特征,出现intraaxonal组织扩散各向异性的影响最大,除了纤维的密度一ND细胞包装,髓鞘化程度,纤维直径和个人。在宏观尺度上的变异的方向在成像体素的所有WM大片影响其各向异性度5。
在第一近似描述分子的流动性,沿各个方向,这些方向之间的相关性4。扩散的各向异性的原因,主要是通过WM中的纤维束的方向和由它的微观和宏观结构的功能的影响。的微观结构特征,出现intraaxonal组织扩散各向异性的影响最大,除了纤维的密度一ND细胞包装,髓鞘化程度,纤维直径和个人。在宏观尺度上的变异的方向在成像体素的所有WM大片影响其各向异性度5。
在典型的DTI测量,体素的尺寸以毫米的顺序。因此,总是包含一个体素的平均信息,检测到的,通常包括一些轴突,以及周围的水分子的体积内部的水分子。尽管这种多向环境,DTI是敏感的最大主轴线对齐的主要轴突方向的方向, 即轴突的贡献占主导地位的被测信号2。
英国贸工部提供两种类型的水扩散的财产的信息:第一,独立的方向扩散各向异性和第二的程度,水扩散成像的主要方向É体素, 即的扩散方向6。
目前的协议都应该DTI分析技术学科组在组级别的定量比较提供了一个框架,概述如下。
扩散性能的定量分析-分析参数
对称张量的元素可以通过扩散梯度沿至少6个非共线和非共面的方向进行测量,以便使得b( 等式1)已成为一个张量,从而导致信号的衰减
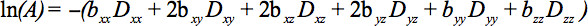
这个方程需要占成像和扩散梯度,应用正交方向(交叉)之间,甚至应用的成像梯度之间可能的相互作用在正交方向4。
排名第二的扩散张量 总是可以被对角化离开只有三个沿主对角线张量的非零元素, 即特征值(
总是可以被对角化离开只有三个沿主对角线张量的非零元素, 即特征值( 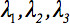 )。特征值反映椭球的形状或结构的。所描述的特征向量之间的数学关系的主坐标系中的椭球和实验室帧
)。特征值反映椭球的形状或结构的。所描述的特征向量之间的数学关系的主坐标系中的椭球和实验室帧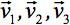
由于存在多种挑战,显示张量数据,扩散椭球的概念已经提出了3。这些电子Eigendiffusivities的llipsoids指在介质中的扩散系数的影响的主要方向的一维扩散系数椭圆体的主轴线, 即表示主扩散方向与纤维的方向相一致的体素,而椭球的偏心率提供了有关程度的各向异性和其对称性。因此,扩散各向异性的各向异性分数(FA)的指标,如可以定义7。
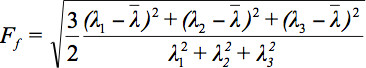
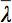 是所有特征值的算术平均值。
是所有特征值的算术平均值。
另外一个方法是使用解决洗衣机的连通性大脑的主要方向上的弥散张量,对应于跟踪技术的做法通道具有彼此连接的部位的脑的意向调查。假设的主要成分的方向的弥散张量表示占主导地位的方向轴突大片,矢量场的3-D,其中每个向量表示的纤维取向。目前,有几种不同的方法来重建可分为两种类型:第一类是基于线传播算法使用本地张量信息的每个步骤中的纤维束的传播2,8,9洗衣机大片。第二类是基于全局能量最小化的能量上最有利的路径之间的两个WM区域,导致道为基础的空间统计方法(TBSS)10中使用的其它算法,如各向异性分数统计tractwise(TFAS已 – 看到协议文本,第2.4节)。
立体立场的转化ARD空间
像其他先进的磁共振成像方法,DTI和FT为基础的研究,在临床情况下追求的最终目标,个别病人的脑形态进行分类,以促进诊断过程中,基于一些歧视度量11。在组级别的研究是最常见的临床表型相关的,如果被认为是由于损坏一个或多个特定脑区域或特定的神经解剖学网络。这里,不同科目的平均业绩是有用的,以评估微观结构改变的常见模式。每个单独的大脑有要传输到立体的空间中,这样,在第二步骤中,在体素的体素水平的算术平均的结果是可能的。空间标准化允许从不同的受试者中获得的结果,以提高信号噪声比(SNR),并进行比较,样品的患者和续算术平均的ROLS,以便分析计算pathoanatomy特定的疾病, 例如做作,这是与一个特定的大脑系统的神经变性疾病。
早期的做法规范化,标准化的立体空间12建议变换算法涉及识别各种脑头痛医头,脚痛医脚的地标和缩放脑象限的标准图集。如今,最先进的磁共振成像数据分析软件包使用正常化蒙特利尔神经学研究所(MNI)立体空间13。对于这种转变,半自动和自动化的大脑登记算法研究特定的模板,开发出14,15。在英国贸工部,特别注意的绘制过程中保持方向信息的正常化进程16,17。 DT-MR图像的空间变换中的应用所必需的空间标准化数据集的集合,翘曲标量图像,并发DT的一个事实,即包含取向信息,再次通过转换的影响相反。此效果,必须考虑,以确保转换后的图像的解剖的正确性。这里,DTI数据集应用仿射变换的技术。
DTI脑部疾病中的应用
纵向DTI数据的比较需要一个主体彼此之间的数据对齐/注册。在这方面,方向信息的保存是必要的( 即在仿射变换的弥散张量的旋转)。神经退行性疾病的可能的应用已被以前的报告( 例如,18,19)。
英国贸工部已被确立为一个强大的非侵入性的技术工具, 在体内神经病理学调查OGY的WM神经大片( 例如 11,20,21,22)。的扩散过程的DTI的定量度量, 例如,在FA,已经被示出是敏感的标志物,用于学习一个宽范围内的WM病理学,如中风20,多重硬化症23,肌萎缩性脊髓侧索硬化症24,25,阿耳茨海默氏病26和几个其他WM障碍的27,28。
此外,DTI可用于与FT识别WM大片23。这种技术,而仍然没有在常规临床使用,正在评估途径特异性异常,神经系统疾病的一个强大的工具。在所确定的大片,各种来自英国贸工部和额外的收购( 如 T2加权图像和/或磁化传递(MT)成像)MRI定量指标,解剖配准贸工部的数据可以衡量的。因此,每个索引可以演算ATED道内的位置作为一个函数,指情节描绘道型材的空间变化。
在下面的,人类的DTI扫描上进行1.5特斯拉核磁共振扫描仪(德国埃尔兰根西门子医疗)被用来研究各种分析技术检测脑白质异常病人团体以及个人的潜力。消除运动等各类文物损坏的卷和卷的自动质量检查后,标准化的后处理程序准备DTI数据连续分析。在下面将说明不同的分析方法, 即第一,整个大脑的空间统计(网路自助服务),第二,FT,第三,Tractwise的各向异性分数统计(TFAS)。网路自助服务是运行在基于体素的形态学(VBM),通常被称为基于体素的形态学测量/ DTI数据统计(VBM / DTI比喻的方法) <e米。VBM是最初运行在对比度的图像对比度差异在单独的扫描中必须加以解决,而网路自助服务是一种方法,该方法使用voxelwise的一个物理参数的比较的方法。因此,虽然算法类似,区分网路自助服务和VBM术语将在下面使用。
Protocol
Representative Results
Discussion
DTI数据可以实现跨学科的平均与的扩散幅度(由利用足总杯信息)和扩散方向(根据FT)就分别。平均FA地图允许学科组统计比较的WBS和TFAS。这种方法论框架给出了一个介绍DTI技术跨学科平均组比较。的立体定向正常化和FA图在组级别允许比较几种可能性学科组之间的差异进行量化。网路自助服务和TFAS似乎是遗嘱的方式来测量组受试者在集团层面的差异与大脑的改变, 如神经退行性疾病的…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
这项工作的组成部分, 即损坏的梯度方向多动障碍的患者在应用程序的数据质量控制和校正的研究,支持欧洲高清网络(EHDN项目070个)。这一定研究的MRI扫描获得伦敦站点TRACK-HD队列的一部分。
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
Referencias
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

