Ensayo basado en HPLC para supervisar extracelular de nucleótidos / nucleósidos de metabolismo en las células de la leucemia crónica humana linfocítica
Summary
The protocol described here represents an easy and reproducible method that employs reverse phase high-performance liquid chromatography (RP-HPLC) to measure purine metabolism on chronic lymphocytic leukemia (CLL) cells cultured under different conditions.
Abstract
Este método describe un cromatografía sensible, específico, fiable y reproducible de fase inversa de alto rendimiento líquido (RP-HPLC) ensayo desarrollado y validado para la cuantificación de nucleótidos extracelulares de purina y nucleósidos producidos por la leucemia linfocítica crónica purificada (CLL) las células bajo diferentes condiciones de cultivo . La separación cromatográfica de la adenosina 5'-monofosfato (AMP), adenosina (ADO) e inosina (INO) se lleva a cabo a temperatura ambiente en una columna a base de sílice, de fase inversa que se utiliza para la retención de compuesto polar. El método incluye una fase móvil binaria, que consiste en acetato de amonio 7 mM y acetonitrilo con un caudal de 1,00 ml / min. Los eluatos se controlan mediante un detector de UV fotodiodo matriz de conjuntos a 260 nm. Una curva de calibración estándar se genera para calcular la ecuación para la cuantificación de análisis de cada compuesto purina. se llevan a cabo entonces el control del sistema, adquisición de datos y análisis. La aplicación de este protocolo, AMP, INO y ADO eluyen a los 7, 11 y 11,9 min, respectivamente, y el tiempo total de funcionamiento para cada muestra es de 20 min. Este protocolo se puede aplicar a diferentes tipos de células y líneas celulares (tanto de suspensión y adherentes), utilizando medios de cultivo como matriz. Las ventajas son fáciles y rápidos de preparación de muestras y la exigencia de una pequeña cantidad de sobrenadante para el análisis. Además, el uso de un medio libre de suero permite omitir el paso de la precipitación de proteínas con acetonitrilo que afecta a la concentración final de los compuestos de purina. Una de las limitaciones del método es el requisito de la columna de equilibrado ejecutar antes de cada muestra de ejecución única, haciendo que el tiempo total de funcionamiento del experimento más largo y la prevención de las aplicaciones de cribado de alto rendimiento.
Introduction
La adenosina (ADO) es un nucleósido de purina con una molécula de adenina unido a un resto de azúcar ribosa molécula a través de un enlace glucosídico. Cuando está presente en el medio extracelular, que protege las células del daño excesivo por la acción del sistema inmune. Este papel se ha puesto de relieve el uso de diferentes modelos de enfermedades, tales como la colitis 1, diabetes tipo 2, asma 3, 4 sepsis, lesión isquémica y 5. Una de las principales funciones de ADO es la inhibición de las respuestas inmunes en el microambiente tumoral, lo que contribuye a la evasión inmune tumor 6. Por esta razón, los mecanismos implicados en la formación de ADO y la señalización son de considerable interés terapéutico 7.
los niveles de ADO en el microambiente del tejido son relativamente bajos en condiciones fisiológicas normales y ciertamente por debajo del umbral de sensibilidad de las células inmunes. Sin embargo, durante la hipoxia, isquemia, inflamación, infección, metabólicasel estrés y la transformación tumoral que aumentan rápidamente 8. Los niveles elevados de ADO extracelular en respuesta a las señales perturbando tejidos tienen una doble función: reportar la lesión del tejido de una manera autocrina y paracrina y generar respuestas de los tejidos que pueden ser generalmente visto como citoprotector.
Extracelular ADO se puede formar a través de una variedad de mecanismos, que incluyen la liberación de compartimentos intracelulares mediados por transportadores de nucleósidos 9 o acumulación debido a la degradación deteriorado operado por la adenosina desaminasa. La principal vía que conduce a un aumento de los niveles extracelulares de ADO implica la acción de una cascada de ectonucleotidasas, que están asociadas a la membrana ectoenzimas generando ADO phosphohydrolysis de nucleótidos liberadas de las células muertas o moribundas. Esta vía procede a través de la acción secuencial de CD39 (trifosfato de ectonucleoside diphosphohydrolase-1) que convierte extracelular de adenosina 5'-trifosfato (ATP) o adenosina 5'-difosfato (ADP) a la adenosina 5'-monofosfato (AMP) y de CD73 (5'-nucleotidasa), que convierte AMP a ADO 10.
ADO extracelular provoca sus respuestas fisiológicas mediante la unión a receptores de cuatro transmembrana ADO, es decir, A1, A2A, A2B y A3. Cada receptor tiene diferentes afinidades por ADO y distribución de tejidos específicos. Todos los receptores tienen siete dominios transmembrana y son acoplados a proteína G a las proteínas intracelulares de unión a GTP (proteínas G), que puede inducir (proteína Gs) o inhibir (proteína Gi) la actividad de la adenilato ciclasa y, posteriormente, la producción de cAMP intracelular. Por lo tanto, los cambios en los niveles de cAMP citoplasmática impacto sobre la actividad de la proteína quinasa intracelular durante 11 respuestas fisiológicas. En condiciones fisiológicas ADO extracelular está por debajo de 1 m, que pueden activar indiscriminadamente A1, A2A y receptores A3. Sin embargo, la activación de subtipo A2B requiere considerablemente más altoconcentraciones de nucleósido, tales como los generados en condiciones fisiopatológicas. Alternativamente, ADO extracelular puede degradarse a inosina (INO) por la adenosina desaminasa (ADA) y CD26, una proteína de ADA complejante localización de ADA en la superficie celular. Otra posibilidad es que ADO es internalizado por la célula a través de los transportadores de nucleósidos equilibrador (ENT) y fosforilado a AMP por ADO proteína quinasa 12,13.
El objetivo de este protocolo es describir un método analítico de cromatografía líquida de alta resolución en fase inversa (RP-HPLC) para cuantificar en una sola ejecución del AMP sustrato y el ADO y productos INO, tal como se genera por los linfocitos humanos. Nuestra experiencia se obtuvo inicialmente utilizando células de pacientes crónicos leucemia linfocítica (CLL), que se caracterizan por la expansión de una población madura de linfocitos CD19 + / CD5 + B constitutivamente expresan CD39 14,15. Demostramos aproximadamente el 30%de los pacientes CLL expresan la CD73 ectoenzyme y que este fenotipo se correlaciona con un mal pronóstico 16. Esta subpoblación de células leucémicas co-expresan CD39 y CD73 puede producir activamente ADO extracelular a partir de ADP y / o AMP. La preincubación de las células CD73 + CLL con α, la síntesis de ADO extracelular β-metilen-ADP (APCP), un conocido inhibidor de la actividad enzimática de CD73, bloquea completamente confirmando que CD73 representa la enzima de cuello de botella de la que caen en cascada 16.
las células de LLC también expresan ADA y la ADA proteína CD26 de complejos, que son responsables de la conversión de ADO en INO. Mediante el uso de inhibidores específicos de la ADA, como eritro-9- (2-hidroxi-3-nonil) I wiadenine (EHNA) y clorhidrato de desoxicoformicina (dCF), es posible bloquear la degradación ADO extracelular en INO. Además, el pretratamiento con un inhibidor de ADA en combinación con dipiridamol, que bloquea los transportadores de nucleósidos, aumenta la acumulación de células en ADOsobrenadantes.
a continuación, hemos ampliado este protocolo para las células derivadas de otros linajes, incluyendo linfocitos T y células mieloides, lo que confirma la producción de ADO CD73-dependiente. Estos hallazgos sugieren que este protocolo HPLC es muy versátil y que puede ser aplicado a diferentes linajes de células y para diferentes condiciones de cultivo (Figura 1).
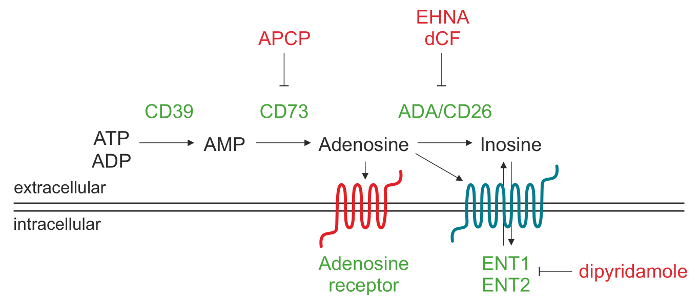
Figura 1. Representación esquemática de la maquinaria enzimática responsable de la producción ADO extracelular. La adenosina 5'-trifosfato (ATP) y / o adenosina 5'-difosfato (ADP) puede ser degradado por CD39 a la adenosina 5'-monofosfato (AMP), el cual a su vez, se convierte por CD73 en el nucleósido adenosina (ADO). Una vez ADO se produce en el espacio extracelular, se puede volver a entrar en la célula a través de los transportadores de nucleósidos (ENT), se convierte en inosina (INO) ose unen a diferentes tipos de receptores P1 ADO. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El protocolo descrito aquí permite evaluar la actividad de la CD39 / CD73 maquinaria adenosinérgico en medios de cultivo celular a partir de células leucémicas humanas purificadas. A través de este método HPLC podemos seguir y medir cuantitativamente la generación enzimática de ADO (CD73-dependiente) y su consiguiente degradación a INO (CD26 / ADA dependiente). El uso de inhibidores de la enzima permite controlar el protocolo y tener controles internos. Las ventajas y las novedades de este protocolo son que: i)…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Este trabajo es apoyado por Associazione Italiana Ricerca Cancro (IG # 12754).
Materials
| Human blood | |||
| Milli-Q water | Millipore | double deionised water | |
| Ficoll-Paque Plus | GE-Healthcare | 17-1440-03 | |
| purified anti-CD3, -CD14, -CD16 | made in-house | mouse monoclonal | |
| PE-labeled anti-CD19 | Miltenyi Biotec | 120-014-229 | |
| FITC-labeled anti-CD5 | Miltenyi Biotec | 130-096-574 | |
| Dynabeads sheep anti-mouse IgG | Invitrogen | 11031 | |
| Phosphate-buffered saline (PBS) | Amresco | E404-200TABS | tablets |
| bovine serum albumin (BSA) | ID bio | 1000-70 | standard grade |
| isolation buffer | PBS 0.1 % BSA 2 mM EDTA, pH 7.4 | ||
| AIM V serum free medium | GIBCO | 12055-091 | liquid (research grade) |
| adenosine 5’-diphosphate (ADP) | Sigma-Aldrich | A2754 | |
| adenosine 5’-monosphate (AMP) | Sigma-Aldrich | A1752 | |
| adenosine (ADO) | Sigma-Aldrich | A9251 | |
| inosine (INO) | Sigma-Aldrich | I4125 | |
| α,β-methylene-ADP (APCP) | Sigma-Aldrich | M8386 | CD73 inhibitor |
| EHNA hydrochloride | Sigma-Aldrich | E114 | adenosine deaminase inhibitor |
| Deoxycoformycin (dCF) | Tocris | 2033 | adenosine deaminase inhibitor |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dipyridamole | Sigma-Aldrich | D9766 | nucleoside transporter inhibitor |
| acetonitrile (CHROMASOLV Plus) | Sigma-Aldrich | 34998 | HPLC-grade |
| ammonium acetate | Sigma-Aldrich | 9688 | 7 mM, pH 3.0 |
| hydrochloric acid | Sigma-Aldrich | 30721-1L | min. 37 % |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Bürker cell counter | VWR | 631-0920 | hemocytometer |
| DynaMag-15 Magnet | Invitrogen | 12301D | Dynal magnetic bead separator |
| microcentrifuge safe-lock tubes | Eppendorf | 030-120-0086 | 1.5 ml |
| PET centrifuge tubes | Corning | 430053/430304 | 15 – 50 ml |
| Minisart RC4 syringe filters | Sartorius Stedim Biotech | 17821 | membrane 0.2 µm |
| short thread vials | VWR | 548-0029 | 1.5 ml/glass |
| micro-inserts | VWR | 548-0006 | 0.1 ml/glass |
| screw caps | VWR | 548-0085 | 9 mm/PP blue |
| Atlantis dC18 Column | Waters | 186001344 | 5 µm, 4.6 x 150 mm |
| Atlantis dC18 Guard Column | Waters | 186001323 | 5 µm, 4.6 x 20 mm |
| Waters Alliance 2965 Separations Module | Waters | HPLC separation module | |
| Waters 2998 Photodiode Array (PDA) Detector | Waters | UV detector | |
| Waters Empower2 software | Waters |
Referencias
- Naganuma, M., Wiznerowicz, E. B., Lappas, C. M., Linden, J., Worthington, M. T., Ernst, P. B. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunology. 177 (5), 2765-2769 (2006).
- Nemeth, Z. H., et al. Adenosine receptor activation ameliorates type 1 diabetes. FASEB J. 21 (10), 2379-2388 (2007).
- Fan, M., Jamal Mustafa, S. Role of adenosine in airway inflammation in an allergic mouse model of asthma. Int Immunopharmacol. 6 (1), 36-45 (2006).
- Csoka, B., et al. A2B adenosine receptors protect against sepsis-induced mortality by dampening excessive inflammation. J Immunol. 185 (1), 542-550 (2010).
- Peart, J. N., Headrick, J. P. Adenosinergic cardioprotection: multiple receptors, multiple pathways. Pharmacol Ther. 114 (2), 208-221 (2007).
- Ohta, A., et al. A2A adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci U S A. 103 (35), 13132-13137 (2006).
- Hasko, G., Linden, J., Cronstein, B., Pacher, P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov. 7 (9), 759-770 (2008).
- Cronstein, B. N. Adenosine, an endogenous anti-inflammatory agent. J Appl Physiol (1985). 76 (1), 5-13 (1994).
- Molina-Arcas, M., Casado, F. J., Pastor-Anglada, M. Nucleoside transporter proteins. Curr Vasc Pharmacol. 7 (4), 426-434 (2009).
- Deaglio, S., et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression. J Exp Med. 204 (6), 1257-1265 (2007).
- Linden, J. Regulation of leukocyte function by adenosine receptors. Adv Pharmacol. 61, 95-114 (2011).
- Antonioli, L., Blandizzi, C., Pacher, P., Hasko, G. Immunity, inflammation and cancer: a leading role for adenosine. Nat Rev Cancer. 13 (12), 842-857 (2013).
- Antonioli, L., Csoka, B., Fornai, M., et al. Adenosine and inflammation: what’s new on the horizon. Drug Discov Today. 19 (8), 1051-1068 (1051).
- Chiorazzi, N., Rai, K. R., Ferrarini, M. Chronic lymphocytic leukemia. N Engl J Med. 352 (8), 804-815 (2005).
- Abousamra, N. K., Salah El-Din, M., Hamza Elzahaf, E., Esmael, M. E. Ectonucleoside triphosphate diphosphohydrolase-1 (E-NTPDase1/CD39) as a new prognostic marker in chronic lymphocytic leukemia. Leuk Lymphoma. 56 (1), 113-119 (2015).
- Serra, S., et al. CD73-generated extracellular adenosine in chronic lymphocytic leukemia creates local conditions counteracting drug-induced cell death. Blood. 118 (23), 6141-6152 (2011).
- Chen, L. S., Keating, M. J., Gandhi, V. Blood collection methods affect cellular protein integrity: implications for clinical trial biomarkers and ZAP-70 inn CLL. Blood. 124 (7), 1192-1195 (2014).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Deaglio, S., et al. CD38 and ZAP-70 are functionally linked and mark CLL cells with high migratory potential. Blood. 110 (12), 4012-4021 (2007).
- Sachsenmeier, K. F., et al. Development of a novel ectonucleotidase assay suitable for high-throughput screening. J Biomol Screen. 17 (7), 993-998 (2012).

