前臨床患者由来の腫瘍新規抗がん療法の調査のための異種移植モデルの開発とメンテナンス
Summary
皮下前臨床モデルで患者由来の腫瘍を利用する新しい治療法、予測バイオマーカーの発見、および薬剤耐性経路の有効性を研究するための優れた方法です。このモデルは、薬物開発プロセスにおいて、臨床試験の前に、多くの新規抗癌療法の運命を決定する上で不可欠です。
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
大腸癌(CRC)は、米国における癌死亡に多大な貢献です。 2015年には、49700人が死亡1とCRCの推定132700新たな症例がありました。限局性疾患を有する患者における予後は良好であるが、進行した疾患を有する患者は、新しい治療法の開発に、この主要な優先順位を作り、予後不良を持っています。この疾患に対してデプロイされているケアの化学療法レジメンと新しい生物製剤の標準にもかかわらず、全体的な生存率の増分のみ増加しています。従って、この疾患における腫瘍増殖の促進に関与するドライバの経路を理解するのに多大な努力があります。 WNT、PI3キナーゼ(PI3K)、RAS、成長因子β(TGF-βの)とTP53 2を変換する:がんゲノムアトラスネットワークは最近、CRCの調節不全に関与し、含まれている多数の主な経路を特定しています。一緒に、OTを記述調査でCRCの成長を増強する彼女の経路は大きく、この患者集団3-5の生存率の改善を目的とした新しい治療法の開発に火をつけています。腫瘍学の薬剤開発における利用前臨床モデルでは、これらの新規化合物の臨床活性を予測するには、このプロセスに不可欠でした。
種々の前臨床モデルは、薬物開発プロセスで利用されてきました。前臨床のトランスジェニック動物モデルおよび細胞株は、主としてヒト腫瘍の複雑さを反映することができないことに、新規な腫瘍治療薬の臨床活性を決定するのに成功していない不死化することを考慮すると、患者由来の腫瘍異種移植片(PDTX)モデルが確立されています。このモデルの最大の利点は、腫瘍の不均一性が損なわれないままと密接に元患者の腫瘍6-9の分子特性およびクローン性を反映していることです。 PDTXモデルは、in vivoで優れを提供します新規な薬剤を研究するための前臨床プラットフォーム、薬剤耐性経路、組み合わせ戦略、がん幹細胞生物学10。
PDTXプロセスの概要を図1に示されている。これは、その過剰な腫瘍組織のいくつかは、この研究のために使用することができるように患者の同意、診療所で始まります。次に、手術で腫瘍の作品は、病理学者によって儲けされ、研究員に輸送するメディアに入れました。その直後に、腫瘍の部分を小片に切断され、免疫不全マウスの皮下に移植します。腫瘍が成長すると、それは腫瘍10を維持するために、マウスの異なる世代に継代されます。典型的には、F3世代後の腫瘍は、新規な化合物および/または組み合わせ治療が評価される処置試験に拡張することができます。利用次世代のSeq(ExomeのSeq、RNAのSeqおよびSNPアレイ)の潜在的な予測バイオマーカーが発見されています特定の治療から利益を得ることができる患者の選択を支援編。
1)単剤として、または組み合わせて新しい治療法の有効性を評価し、2)前臨床研究への感受性または耐性を予測するバイオマーカーを同定:PDTXモデルを使用しての包括的な目標はにあります。本稿では、我々は、CRC PDTXバンクの開始および維持における方法論を提供し、薬剤開発の発見で、このモデルの利点と限界を提供します。
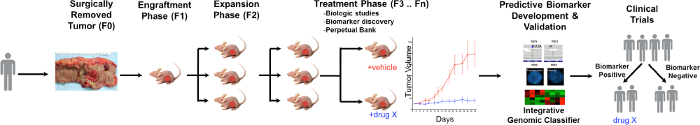
CRC PDTXモデル議定書の 図1. 概要。患者由来の腫瘍は手術から受信し、すぐに皮下無胸腺ヌードマウスに注射されます。腫瘍が成長したら、それが次の世代へと拡大し、最終的には治療の研究のために拡張されます。治療RESPONSEが評価され、予測バイオマーカーは、患者の選択を助けることができることが確認されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
PDTX創薬プラットフォームは、新規化合物の臨床活性を予測する際の信頼性が低い他の前臨床モデルの欠点を改良モデルを提供しています。重要なことは、このモデルにおける腫瘍は転移能を保持し、生物学的に安定しており、世代から世代へ同様の薬剤応答性を示します。このモデルでは、患者由来の腫瘍を、無胸腺ヌードマウスに注射継代し、続いて治療の評価に使用されます。含ま成?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
Referencias
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

