Errichtung eines klinischen Biorepositorys
Summary
Kutane Tumoren werden oft nach Mohs mikrographischen Chirurgie verworfen. Hier wird ein Protokoll beschrieben, das es dem klinischen Hilfspersonal ermöglicht, kutane Tumor- ( zB Plattenepithelkarzinom-, Basalzellkarzinom- und Melanom-) Proben für nachgeschaltete Laboranwendungen effektiv zu verarbeiten und zu speichern, ohne die klinischen Operationen zu beeinträchtigen.
Abstract
Die Inzidenz von Hautkrebs ( z. B. Plattenepithelkarzinom, Basalzellkarzinom und Melanom) hat in den vergangenen Jahren zugenommen. Es wird erwartet, dass es eine parallele Nachfrage nach kutanen Tumorproben für biomedizinische Forschungsstudien gibt. Die Verfügbarkeit der Gewebe ist jedoch aufgrund der Kosten für die Etablierung eines Biorepositorys und des Mangels an Protokollen, die für die Erlangung von klinischen Proben zur Verfügung stehen, die die klinischen Operationen nicht beeinträchtigen, begrenzt. Es wurde ein Protokoll erstellt, um kutane Tumor und assoziierte Blut- und Speichelproben zu sammeln und zu verarbeiten, die minimale Auswirkungen auf routinemäßige klinische Verfahren am Tag einer Mohs-Chirurgie haben. Tumorproben werden gesammelt und verarbeitet von Patienten, die sich ihrer ersten Schicht der Mohs-Chirurgie für biopsie-bewährte Hautmalignitäten durch den Mohs-Histotechnologen unterziehen. Angrenzendes normales Gewebe wird zum Zeitpunkt des chirurgischen Verschlusses gesammelt. Zusätzliche Proben, die gesammelt werden können, sind Vollblut und bukkale Tupfer. Durch die Verwendung von Gewebeproben, die normalerweise verworfen werden, wurde ein Biorepository erzeugt, das mehrere wesentliche Vorteile bietet, indem es in der Klinik gegenüber der Laborumgebung basiert. Dazu gehören eine breite Palette von gesammelten Proben; Zugang zu erkannten Patientenakten, einschließlich Pathologieberichten; Und, für den typischen Spender, Zugang zu zusätzlichen Proben bei Folgebesuchen.
Introduction
Krebs- und Biomarkerforschung beruht auf einer Versorgung mit hochwertigen menschlichen Gewebeproben, und begrenztes Angebot hat die Forschung behindert 1 , 2 . Viele dermatologische Studien sind durch die unzureichende Versorgung, die variable Qualität und die Kosten im Zusammenhang mit der Verwendung von menschlichem Gewebe begrenzt. Die Kosten für die Gründung einer großen, dedizierten Biobank wurde auf etwa zwei Millionen Dollar 3 geschätzt, und diese Kosten legen die Verwendung von menschlichem Gewebe aus der Reichweite vieler Forscher. Darüber hinaus stellt der Prozess der Erzeugung und Speicherung von Forschungsproben das Risiko dar, klinische Operationen zu beeinträchtigen und die Patientenversorgung zu verzögern, wenn sie nicht sorgfältig durchgeführt wird. Es wurde ein kostengünstiges, klinikbasiertes Biorepository etabliert, das sich auf Hautkrebsproben nach empfohlenen Best Practices und Probenvalidierung 4 , 5 , 6 konzentriert.
<pEnglisch: www.tab.fzk.de/en/projekt/zusammenf…ng/ab117.htm Dieses Protokoll wurde in einer Dermatologie-Klinik entwickelt, die ein großes Volumen an Mohs-mikrographischen Operationen durchführt, um Plattenepithelkarzinome (SCC), Basalzellkarzinom (BCC) und Melanom-Hautkrebs zu entfernen. Freiwillige Spender können von dieser Patientenpopulation rekrutiert werden. Es ist wichtig, das Biorepository an der Stelle der Sammlung zu etablieren, um schnell Gewebe und Blut von assoziierten Patienten ohne Verzögerung der Behandlung zu erfassen. Das Sammeln von Proben aus der gleichen Klinik minimiert Variationen in der Sammlungstechniken und minimiert Variationen in der Qualität der Proben, was für die nachgeschalteten Anwendungen problematisch sein kann 7 , 8 .Das Ziel der Mohs mikrographischen Chirurgie Technik ist, um sicherzustellen, dass alle Krebs Gewebe entfernt wird, während die Erhaltung so viel gesundes Gewebe wie möglich. Das Verfahren beinhaltet die fortschreitende Entfernung von dünnen Schichten von Tumorgewebe. Jede aufeinanderfolgende Schicht ist seineTologisch untersucht (nach der Kryosektion des Tumorgewebes und Durchführung von H & E-Färbung) durch einen Dermatologen, um festzustellen, ob alle Krebsgewebe entfernt worden sind. Die Exzision und Untersuchung der nachfolgenden Gewebeschichten erfolgt, während der Patient im Büro bleibt. Diese Technik gilt als die beste Behandlungsoption für SCC 9 . An diesem Punkt wird die Wunde geschlossen und zur Verbesserung der Heilung und des kosmetischen Erscheinungsbildes wird neben normalem Gewebe (ANT) häufig herausgeschnitten. So ist dieses chirurgische Verfahren zur Entfernung eines Tumors ideal geeignet, um histologisch charakterisiertes Gewebe für zukünftige Studien zu sammeln.
Das Beschaffungsverfahren zur Gewinnung von Tumorgewebe, angrenzend an normalem Gewebe, Speichel und Blutproben wurde so entworfen, dass es minimale Auswirkungen auf die normalen Personalaufgaben hat (Abbildung 1 ). Medizinische Assistenten führen das Blut zieht bei der Vorbereitung des Patienten für das Verfahren. Nach Beendigung des Mohs-Verfahrens ist das M Ohs Histotechnologe bereitet zusätzliche histologische Folien der Probe vor und überträgt das Gewebe auf das Biorepository. Die Kosten für die Errichtung des Biorepositorys beinhalten den Kauf von Kryokonservierungsgefriergeräten, die Schaffung eines bescheidenen klinischen Laborraums und die Entwicklung eines Inventarverfolgungsprogramms.
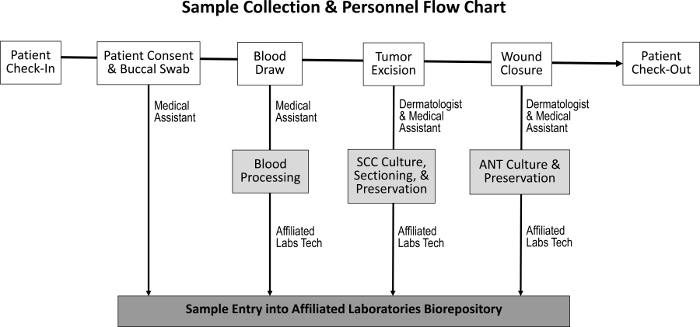
Abbildung 1: Reihenfolge der Probenahme und verantwortungsbewusstes Personal Nach dem Check-in des Patienten und dem Erreichen der Zustimmung des Patienten sammelt der medizinische Assistent einen bukkalen Tupfer und führt einen Blutentnahme durch. Der Dermatologe und der medizinische Assistent überholen dann den Tumor und schließen die Wunde, während welcher Zeit SCC- und ANT-Proben gesammelt werden. Ein engagierter Labortechniker verarbeitet das Blut und deckt die SCC- und ANT-Proben für die Gewebekultur, die Konservierung und den Eintritt in das Biorepository ab.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Die Vielfalt der gesammelten Proben ermöglicht eine Vielzahl von experimentellen Ansätzen (Abbildung 2 ). Proben, die vom Patienten gesammelt wurden, sind bukkale Tupfer (Speichel kann auch gesammelt werden, wenn nötig), Vollblut und ausgeschnittenes Gewebe. Die bukkalen Tupfer und eine Probe aus dem Vollblut werden ohne Verarbeitung für die Genotypisierung und Gewebeanpassung gerettet. Vollblut wird in weiße Blutkörperchen (WBC) und Plasmafraktionen für zukünftige Analysen getrennt. Nach der Mohs-Verarbeitung wird der gefrorene Tumor direkt in flüssigen Stickstoff gegeben und auf einen Gefrierschrank von -80 ° C übertragen. Frisches, lebensfähiges Tumorgewebe und ANT-Proben werden unter Verwendung von Modifikationen der vorherigen Techniken 10 , 11 kultiviert und dann kryokonserviert. Während der Erhebung wird die Anzahl der einzelnen Sample-Typen auf einer Kalkulationstabelle vor dem Eintritt aufgezeichnet Das Inventar-Tracking-Programm zur Erleichterung der genauen Verarbeitung ( Tabelle 1 ).
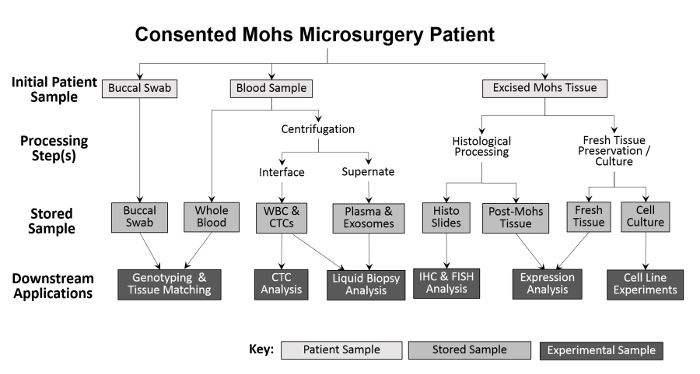
Abbildung 2: Überblick über die Klinik-basierte Biorepository Probenahme und -verarbeitung. Ein bukkaler Tupfer und eine Blutprobe werden vom Patienten gesammelt und für die nachgeschaltete Genotypisierung und Gewebeanpassung gespeichert. Vollblut wird für die Isolierung der weißen Blutkörperchen (WBC) und die CTC-Analyse sowie für die Plasmasammlung und die Flüssigbiopsieanalyse weiterverarbeitet. Gewebe, das während des Mohs-Verfahrens ausgeschnitten wird, wird für diagnostische Zwecke histologisch verarbeitet, wonach die histologischen Folien experimentell für weitere immunhistochemische Analysen eingesetzt werden können. Unter der Voraussetzung, dass die exzidierte Gewebeprobe groß genug ist, wird ein Teil des frischen Gewebes entfernt und für die Protein- und RNA-Isolierung geschnitten und für die Herstellung von kultivierten Zelllinien.55583 / 55583fig1large.jpg "target =" _ blank "> Bitte hier klicken um eine größere Version dieser Figur zu sehen.
| Abholtermin: | |||||
| Patient 1 | Patient 2 | Patient 3 | Patient 4 | Patient 5 | |
| Initialen und Geburtsdatum | |||||
| Augenfarbe | |||||
| Beispielstyp | |||||
| Beispiel Ort | |||||
| Speichel | |||||
| WLoch Blut | |||||
| Plasma | |||||
| Tumor lebensfähig | |||||
| Gewebe Normal lebensfähig | |||||
| Tumor Mohs Flüssiger Stickstoff | |||||
| Tissue Normal Liquid Stickstoff | |||||
| Rutschen |
Tabelle 1: Checkliste zum Aufnehmen von Sample-Sammlungen. Daten, die mit jeder gesammelten Probe verfolgt und aufgezeichnet wurden, beinhalten Patienteninitialen, Geburtsdatum und Augenfarbe (für die Hauttypisierung) sowie die locatiAuf Probenentfernung Die Anzahl der Speichelproben, die Blutentnahmevolumina und die Anzahl der lebensfähigen und konservierten Gewebeproben, die gesammelt wurden, werden auch als Referenzen für Zuweisungen zu späteren Verwendungen aufgezeichnet. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Um die Probenahmeverfahren zu validieren, wurde jeder Sample-Typ in nachgeschalteten Anwendungen getestet. Unter Verwendung von Modifikationen von früheren Techniken 12 wurden Tumor und ANT erfolgreich in der Protein- und RNA-Isolierung verwendet und können möglicherweise für die DNA-Isolierung verwendet werden. Lebensfähige Explantate aus den Gewebeschnitten wurden durch Mikroskopie ausgewertet, während gespeicherte histologische Objektträger für die Immunhistochemie und Immunfluoreszenz verwendet wurden.
Durch das hier beschriebene Protokoll ist es möglich, dieses Modell auf andere Dermatologiekliniken, andere Tumortypen (wie Melanom) zu erweitern,, Und andere chirurgische Spezialitäten und Praktiken, um menschliche Gewebe Proben für vielfältige Forschung in menschlichen Krebs zu liefern. Leichte Modifikationen dieses Protokolls sind wahrscheinlich für andere Praktiken notwendig, aber grundsätzlich ist dieses Protokoll auf jede chirurgische Praxis anwendbar, die routinemäßig Patientenproben, die im Laufe der Patientenbehandlung gesammelt wurden, verwischt.
Protocol
Representative Results
Discussion
Nach dem Wissen des Autors ist dieses Protokoll das erste seiner Art, das sich auf die klinische Beschaffung von Hautgewebeproben sowohl in einem kostengünstigen als auch in einem schnellen Ansatz konzentriert. Patienten, die sich einer Mohs-Mikrochirurgie unterziehen, sind typischerweise während bestimmter Zeitblöcke geplant, und die Sammlung ist auf diese Zeiträume beschränkt. Die Probenahme beinhaltet die Anstrengung des medizinischen Assistenten, der an der Patientenversorgung beteiligt ist, der Mohs-Histotechn…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch Mittel von der Midwestern University College of Health Sciences Research Facilitation Grant, verliehen an EEH und Midwestern University Office of Research und Sponsored Programme Intramural Grant, an KJL vergeben unterstützt. Zusätzliche Unterstützung wurde von angeschlossenen Laboratorien und angeschlossenen Dermatologie zur Verfügung gestellt. Wir danken Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel und Ali Zaidi für ihre technische Unterstützung.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
Referencias
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

