神経系の再構築、変調、モデリングのための解剖学的にインスパイアされた3次元マイクロ組織工学ニューラルネットワーク
Summary
この原稿では、微細組織工学ニューラルネットワークの作成について詳しく述べる。三次元のミクロンサイズの構造物は、管状ヒドロゲルに包まれた凝集ニューロン集団にまたがる長い整列した軸索路からなる。これらの生存足場は、神経回路を再構成または調節するための機能的中継として、または灰白色物質の神経解剖学を模倣するバイオフィリックテストベッドとして役立ち得る。
Abstract
機能回復は、中枢神経系(CNS)内での損傷または疾患誘発性変性の後に、抑制的環境および神経発生のための限られた能力のためにほとんど起こらない。私たちは、損傷したCNS内のニューロンおよび軸索経路の消失に同時に対処するための戦略を開発している。この原稿では、ミクロ組織工学ニューラルネットワーク(マイクロTENNs)、ニューロンと、直径が数百ミクロンであり、センチメートルに伸びる予備形成されたヒドロゲルシリンダーの細胞外マトリックス(ECM)内腔にまたがる配列された軸索路からなる移植可能な構築物長さで。ニューロン凝集体は、三次元包囲体の極端に区切られ、軸索突起によって広がっている。マイクロTENNは、脳結合サイト構造の側面をエミュレートし、潜在的にネットワーク置換の手段を提供する、CNS再構成のための戦略として独特に準備されている。ニューロナル凝集体は宿主組織とシナプス結合して、欠損または損傷した回路を修復および/または調節するための新しい機能的な中継を形成し得る。これらの構築物はまた、細胞遊走および軸索経路探索のための発生機構を利用して、再生状態に基づいて相乗的な構造的および可溶性キューを提供することができる、前駆再生的「生きた足場」として作用し得る。微小TENNは、液体ハイドロゲルを長手方向に中心の針を含む円筒形の鋳型に注入することによって製造される。ヒドロゲルがゲル化したら、針を除去し、中空マイクロカラムを残す。内腔にECM溶液を添加して、ニューロン接着および軸索伸長に適した環境を提供する。解離したニューロンは、マイクロカラムの一方または両方の端部内で正確な播種のために機械的に凝集される。この方法論は、脳の神経解剖学の特徴を再現する可能性のある長期間突出した軸索路を有する自己完結型の小型構築物を確実に産生する。シナプスイム非標識および遺伝的にコード化されたカルシウム指標は、マイクロTENNが広範なシナプス分布および固有の電気活性を有することを示唆している。したがって、マイクロTENNは、脳経路の標的化された神経外科的再建のための有望な戦略であり、インビトロで神経生物学的現象を研究するためのバイオフィジックモデルとして適用されてもよい。
Introduction
外傷性脳損傷(TBI)、脊髄損傷(SCI)、脳卒中、アルツハイマー病およびパーキンソン病などの中枢神経系(CNS)の障害および疾患の共通の特徴は、軸索経路および神経細胞の切断である損失1、2、3、4、5、6。例えば、虚血性脳卒中が治療されなくなると、軸索が1分間に軸索7マイルの速度で失われると推定される5 。米国だけで約170万人が毎年経験しているTBIの場合、初期の損傷が長期の神経変性状態を引き起こすため、軸索変性は外傷後数年間続くことがあります4 。これらの有害な影響をさらに悪化させるCNSは、再生のための都市1、7、8、9。傷害後、遠方の標的への誘導指向の欠如、神経突起伸長を妨げるミエリン関連阻害剤の存在、および反応性星状細胞によるグリア瘢痕の形成8,10,11,12を特徴とする阻害環境が生じる。グリアの傷跡は、コンドロイチン硫酸プロテオグリカンのような分子が軸索の伸長を妨害する分子で、再生に対する生化学的および物理的障壁として働く8,11。さらに、成人CNSにおいて神経幹細胞が見出されているにもかかわらず、ニューロン新生の一貫した証拠が嗅球、海馬顆粒周囲領域、および脊髄13,14の中心管を含むが、これらに限定されない。これらの障害は、傷害または疾患後の失われたニューロンおよび白質構造の機能的回復を妨げ、しばしばこれらの状態の人生の変化および長期間の影響をもたらす。
成体CNSにおける再生能力の欠如にもかかわらず、十分な環境的合図が宿主ニューロン15,16,17,18に提示される場合、軸索再生が可能であることが実証されている。研究者らは、成長因子( 例えば、神経成長因子、上皮増殖因子、グリア依存性成長因子、および神経栄養因子-3)および可塑性および軸索再生を刺激する他の誘導分子を送達し、19,19 。これらの研究は、成人軸索が成長因子に応答することができることを確認したが、これらの戦略は、血液脳関門の低透過性および再生を促進するのに必要な特定の空間的および時間的勾配によって制限される14,18,19。他のアプローチは、CNSニューロンにおける再生関連転写因子の過剰活性化に依存してきた。例えば、Stat3転写因子の過剰発現は、視神経20における軸索再生を刺激した。それにもかかわらず、転写因子の生体分子送達および過剰発現の両方が、失われたニューロン集団を置換することに失敗する。細胞ベースの戦略は、主に、神経幹細胞(NSC)をCNSに移植することに中心を置いており、CNSニューロンを置換するそれらの能力を利用し、栄養因子を放出し、損傷後に起こる神経発生の試みを支持する。それにもかかわらず、移植された神経細胞が生存し、宿主と一体化し、損傷領域6,14,17,21に空間的に制限されたままである妨げられた能力を含む、このアプローチを妨げる挑戦が依然として強く残っている。さらに、細胞送達だけでは、損傷または失われた軸索経路の細胞構造を回復することができない。細胞および薬物/化学物質の送達戦略に直面する問題に対処する別のアプローチは、これらのアプローチを生体材料14,22,23の使用と組み合わせることである。ヒドロゲルなどの生体材料は、細胞外マトリックス(ECM)の生化学的および物理的特性を模倣することができ、細胞送達を助け、損傷部位内の保持、および制御放出を伴う成長因子および他の生物活性分子の送達22 。これらの生体材料に基づく戦略の魅力的な特徴は 、足場を病変領域24,25,26,27,28,29,30に移植した後のin vivo軸索再生の証拠をもたらした。しかしながら、無細胞生物材料戦略は、失われたニューロン集団を置換するものではない。ニューロン、神経膠またはニューロン前駆細胞の送達媒体として使用される場合、生体材料は、長距離軸索ネットワークを再構成することができない。 CNS傷害および疾患に関連する軸索経路変性およびニューロン損失の両方に対処するアプローチを開発する課題は、sup class = "xref"> 31。
私たちの研究グループは以前、アガロースヒドロゲル-ECMマイクロカラムの一端または両端に制限されたニューロン細胞体からなる「生きた足場」の一種である移植可能なマイクロ組織工学ニューネットワーク(マイクロTENN)の開発を報告したこの三次元(3D)包帯1,10,31,32の内部全体にわたって伸びている整列した軸索路を有する。この技術と以前のアプローチとの主な違いの1つは、マイクロTENNの細胞構造がインビトロで完全に作製され、その後に33,34,35,36,37,38 、sup class = "xref"> 39,40,41。 インビトロでの作製は、細胞の表現型および配向、機械的/物理的特性、生化学的キューおよび外因性因子の広範な空間的および時間的制御を提供し、移植後のこれらの足場の宿主との統合に有益である41,42 。マイクロTENNは解剖学的にインスピレーションを受けています。なぜなら、それらは脳の神経機能を模倣し、脳の別個の機能領域を橋渡しするものと同様の軸索路を示すからです( 図1A )。したがって、この戦略は、病変領域への移植後に失われた白質路およびニューロンを物理的に置き換えることができる可能性がある。この技術はまた、放射状グリア細胞および先駆軸索によって形成される「天然の生存足場」が細胞のための経路探索ガイドとして作用する発達メカニズムによっても刺激される脳室下領域からの移動および軸索伸長、それぞれ43 。これらのメカニズムは、神経細胞の移動および軸索介在軸索伸長による軸索再生のための生きている経路を提示することができるマイクロTENNの整列した軸索領域に再現される( 図1C ) 43 。さらに、この戦略は、マイクロTENNニューロンとネイティブ回路との間のシナプス統合を利用して、機能的回復に寄与する可能性がある新しいリレーを形成する( 図1B ) 43 。シナプス形成能力はまた、このアプローチに、ネットワークフィードバックに従ってCNSを調節し、宿主組織に応答する能力を付与し得る。例えば、生体スキャホールド中のオプトエレクトロニクス的に活性なニューロンは、シナプス相互作用を介して宿主ニューロンを調節するように刺激され得る( 図1D )。
さらに、生体材料に基づく管状構造物マイクロTENNの作用は、細胞接着、成長、神経突起伸長およびシグナル伝達のための適切な環境を提供する一方で、構築物の小型寸法は潜在的に最小侵襲移植を可能にし、脳への徐々に統合するための部分的に隔離された微小環境を提供する。実際、最近の刊行物は、ラットの脳への移植後に神経経路を模倣するマイクロTENNの可能性を実証している。定位固定マイクロインジェクション後、我々は先に、マイクロTENNニューロン生存、軸索管構造の維持、及びインビボで少なくとも1ヶ月までの宿主皮質への神経突起伸長の証拠を報告した10,31。さらに、シナプシンによる標識は、天然組織とのシナプス統合の組織学的証拠を提供した10,31。全体として、マイクロTENNは、損傷した組織を再構築し、調節するために失われたニューロンを置換すること、CNSを宿主回路とシナプス的に統合すること、失われた軸索の細胞構造を回復すること、および場合によっては再生軸索に適切な経路探索の手がかりを提供することによって、
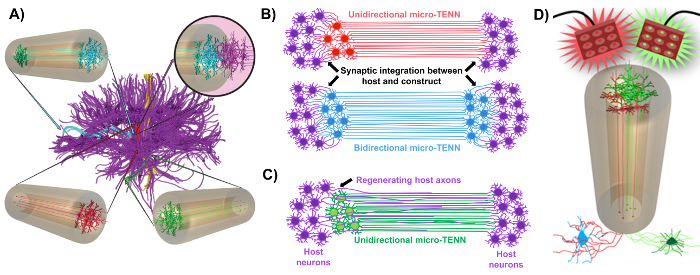
図1:マイクロティッシュエンジニアリングニューラルネットワーク(マイクロTENN)の開発の原則とインスピレーション ( A )Micro-TENNは、機能的に異なる領域が、一方向(赤、緑)または双方向(青)の様式で長い整列した軸索路によって連結されている脳結合細胞(紫)の細胞構造を模倣する。一例として、微小TENNは、皮質および神経突起の経路または嗅内皮質から海馬への有孔経路(Struzyna et al。 、2015に適合)に失われた接続を再構成することができる1 。 ( B )単方向の図1および双方向マイクロTENN(それぞれ赤色および青色)を宿主回路(紫色)とシナプス的に統合して、病変の両端間の機能的中継として機能する。 ( C )マイクロTENNが相互作用する標的に向かって軸索を促進して宿主軸索(紫色)を再生するためのガイドとして機能する一方向性マイクロTENN(緑色)の軸索路図。 ( D )興奮性または抑制性ニューロンとのシナプス統合を利用して、神経調節物質としてのオプトジェネティックに活性なマイクロTENNSの使用の概念図(下)。 この図の拡大版を見るには、ここをクリックしてください。
現在の原稿は、胚由来の大脳皮質ニューロンを用いてマイクロTENNを作製するために利用される方法論を詳述している。特に、マイクロTENNは、他のタイプの神経細胞で作製することができた。 ex十分に、成功したマイクロTENN開発の最初の報告は背側根神経節(DRG)ニューロンを特徴とした32 。ヒドロゲルマイクロカラムは、カスタムメイドのレーザーカット円筒状チャンネルアレイまたは毛細管(これはともに整列した鍼針を含む)に液体アガロースを添加することによって生成することができる( 図2A )。ニードルは内腔を形成し、マイクロカラムの内径(ID)を決定する一方、毛細管IDおよびレーザー切断装置内のシリンダーの直径は構造体の外径(OD)を決定する。 ODおよびIDは、デバイス/キャピラリーチューブおよび鍼針の異なる直径をそれぞれ選択することによって、所望の用途に応じて選択することができる。マイクロカラムの長さも変えることができる。今日まで、我々は、長さ20mmまでのマイクロTENNの構築を報告しており、より長い時間を積極的に追求している。アガロースゲルおよび鍼n後eedlesを除去し、一般にI型コラーゲンおよびラミニンからなるECM溶液を構築物の内腔に添加する( 図2C )。 ECMコアは、ニューロン細胞接着および軸索伸長を支持する足場を提供する。最初に、解離した細胞懸濁液10,31,32を用いて、初代ラット皮質ニューロンをマイクロカラムに播種した。しかしながら、このアプローチは、全ての場合において標的細胞構造を生成せず、これはマイクロカラムの端部に限定された神経細胞体として定義され、中心管腔は純粋に整列した軸索管で構成された。それ以来、強制的なニューロン凝集法(Ungrin らのプロトコールに基づくプロトコル)を使用することにより、理想的な構造( 図2B )のマイクロTENNのより信頼性の高い一貫した作製が可能になった。電流の説明に加えてこの記事では、最終的な標的細胞構造だけでなく、経時的な軸索管の形成を示すマイクロTENNの代表的な位相差および共焦点画像を示す。この原稿はまた、プロトコルの注目すべき側面と、残りの課題と、マイクロTENN技術の将来の方向性を拡大する予定です。
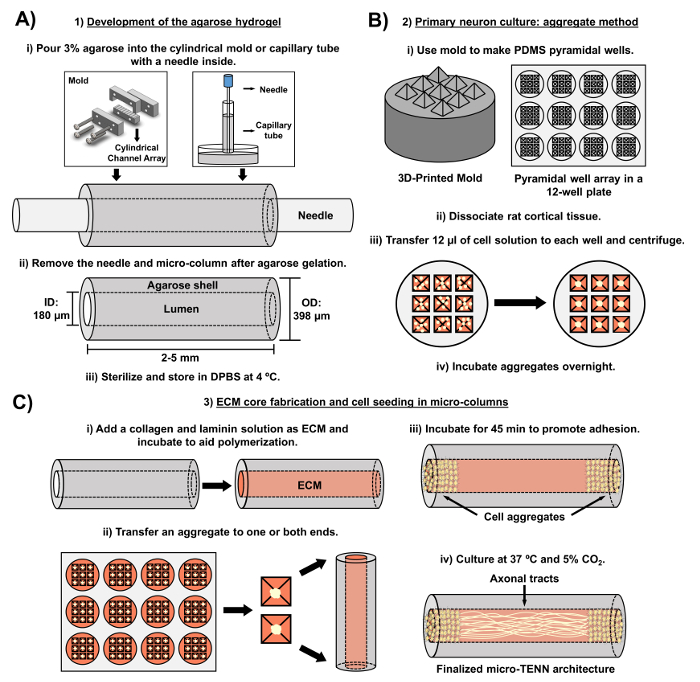
図2:3段マイクロTENN製作プロセスの概略図 ( A )アガロースヒドロゲルの開発:(i)最初に、小径の針( 例えば直径180~350μm)をカスタムメイドのレーザーカットモールドまたはキャピラリーチューブの円筒チャネルに挿入する。 、直径380~700μm)。次のステップでは、DPBS中の液体アガロースを円筒形チャネルまたは毛管に導入する。 (ii)アガロースゲル後、針を外し、金型を解体して中空アガロースマイクロカラムを得る。 (iii)これらの構築物を滅菌し、DPBSに保存する。 ( B )一次ニューロン培養および凝集法:(i)ニューロン凝集は、12ウェル培養プレートのウェルに適合する、3D印刷された鋳型から鋳造された角錐マイクロウェルアレイにおいて行われる。 (ii)Micro-TENNには、18日目のラットの胎児の脳から解離した初代ラットニューロンが含まれる。トリプシン-EDTAおよびDNase Iによる組織解離に続いて、1.0〜2.0×10 6細胞/ mLの密度を有する細胞溶液を調製する。 (iii)この溶液12μLを角錐マイクロウェルアレイの各ウェルに移す。これらのマイクロウェルを含むプレートを遠心分離して細胞凝集体を生成する。 (iv)これらをマイクロカラムに播種する前に一晩インキュベートする。 ( C )ECMコア作製および細胞播種:(i)細胞播種の前に、1mg / mLのI型コラーゲンおよび1mg / mLを含有するECM溶液ラミニンをマイクロTENNの内部に移し、重合させる。 (ii)一方向性または双方向性のマイクロTENNが製造されているかどうかに応じて、凝集体をマイクロカラムの一方または両方の極端に置く。 (iii)接着を促進するためのインキュベーションの期間の後、マイクロTENNを、補充された胚ニューロン基底培地で満たされたペトリ皿で培養する。 (iv)培養3〜5日後、最終的なマイクロTENN構造は、その長さに及ぶ軸索路を有するマイクロカラムの極端に細胞凝集体を示すはずである。 この図の拡大版を見るには、ここをクリックしてください。
Protocol
Representative Results
Discussion
CNS傷害および疾患は、典型的には、付随するニューロン変性の有無にかかわらず、脳結合細胞を含む長距離軸索経路の喪失または機能不全をもたらす。これは、神経新生および再生を促進するCNSの限られた能力によって増強される。個々のまたはコンビナトリアルアプローチとしての成長因子、細胞および生体物質送達などの修復戦略の追求にもかかわらず、これらの技術は、神経細胞の変…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
財政的支援は、米国国立衛生研究所(U01-NS094340(Cullen)、T32-NS043126(Harris)、F31-NS090746(Katiyar))、Michael J. Fox財団(Therapeutic Pipeline Program#9998(Cullen) (Cullen)、国立科学財団(大学院研究フェローシップDGE-1321851(Struzyna and Adewole))、退役軍人局(RR&Dメリットレビュー#B1097-I(カレン))、アメリカン・アソシエーション神経外科医および神経外科医会議(2015-2016年の神経外傷および重大なケアにおけるコッドマンフェローシップ(ペトロフ))および米国陸軍医学研究および物質試験(#W81XWH-13-207004(カレン)およびW81XWH- 0466(カレン))。
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
Referencias
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

