Ein Millimeter Skala Biege-Prüfsystem zur Messung der mechanischen Eigenschaften von marinen Schwamm Knochensplitter
Summary
Wir präsentieren Ihnen ein Protokoll für die Durchführung von drei-Punkt-Biegeversuche auf Sub-Millimeter Skala Fasern mit einer speziell angefertigten mechanische Prüfeinrichtung. Das Gerät kann Kräfte von 20 µN bis zu 10 N bis hin zu messen und kann daher eine Vielzahl von Faser Größen unterbringen.
Abstract
Viele Laden mit biologischen Strukturen (LBBSs) — wie Feder Rachises und Knochensplitter — sind klein (< 1 mm) aber nicht mikroskopisch. Messung der Biegefestigkeit Verhaltens dieser LBBSs ist wichtig für das Verständnis der Ursprünge ihrer bemerkenswerten mechanischen Funktionen.
Wir beschreiben ein Protokoll für die Durchführung von drei-Punkt-Biegeversuche mit einer Custom-Built mechanische Prüfeinrichtung, die messen können Kräfte von 10-5 bis 101 N und Verschiebungen von 10-7 bis 10-2 m. Der Hauptvorteil dieser mechanischen Prüfgerät ist, dass die Gewalt und Vertreibung Kapazitäten für unterschiedliche LBBSs leicht angepasst werden können. Das Gerät Funktionsprinzip ist ähnlich wie ein Rasterkraftmikroskop. Kraft ist nämlich auf die LBBS durch einen Lastpunkt angewendet, bis zum Ende des Freischwinger angefügt ist. Die Last Punkt Vertreibung ist ein Faser-optischen Wegsensor gemessen und umgewandelt in eine Kraft mit der gemessenen Cantilever-Steifigkeit. Das Gerät Kraftbereich einstellbar mit Kragarmen der verschiedenen Steifigkeiten.
Die Gerätefunktionen werden demonstriert, indem die drei-Punkt-Biegeversuche auf das Skelett Elemente des marinen Schwammes Euplectella Aspergillus. Die skelettartigen Elementen – bekannt als Knochensplitter — sind Kieselsäure-Fasern, die ca. 50 µm im Durchmesser sind. Wir beschreiben die Verfahren für die Kalibrierung der mechanischen Messgerät, Montage der Knochensplitter auf eine Dreipunkt-Biege Vorrichtung mit einer ≈1.3 mm Spannweite, und testen Sie ausführen, eine Biegung. Die Krafteinwirkung auf das Spicule und die Durchbiegung am Standort der angewandten Kraft gemessen werden.
Introduction
Durch das Studium der Architekturen von Tragkonstruktionen biologische (LBBSs), wie Shell und Knochen, haben Ingenieure neue composite-Materialien entwickelt, die stark und zäh 1sind. Es hat sich gezeigt, dass die bemerkenswerten mechanischen Eigenschaften von LBBSs und ihre Kollegen bioinspirierte mit ihrer komplizierten internen Architekturen 2zusammenhängen. Die Beziehungen zwischen LBBS Architekturen und mechanischen Eigenschaften sind jedoch nicht vollständig geklärt. Ein LBBS mechanische Reaktion gemessen, ist der erste Schritt zum Verständnis, wie die Architektur seiner mechanischen Eigenschaften verbessert.
Es ist jedoch wichtig, dass die Art des Tests verwendet, um eine LBBS mechanische Reaktion messen mit seiner mechanischen Funktion übereinstimmt. Da Federn aerodynamischen Belastungen unterstützen müssen, ist die primäre Funktion einer Feder Rachis beispielsweise Biege Steifigkeit 3liefern. Daher ist ein Biegeversuch bevorzugt, einen einachsigen Zugversuch für seine mechanische Reaktion gemessen. In der Tat, viele LBBSs — z. B. Feder Rachises 3, Rasen ergibt 4und Knochensplitter 5,6,7,8— in erster Linie durch Biegen verformen. Deshalb, weil diese LBBSs schlank sind –d. h., ihre Länge ist deutlich größer als ihre Breite oder Tiefe. Jedoch durchführen Biegeversuche auf diese LBBSs ist eine Herausforderung, weil die Kräfte und Verschiebungen, die sie, bevor ein Fehler auftritt widerstehen können von 10-2 bis 10 reichen2 N und 10-4 10-3 m, bzw. 3 , 4 , 5 , 7 , 8. Infolgedessen das Gerät verwendet, um diese mechanische Tests durchzuführen müssen Gewalt und Vertreibung Auflösungen von ≈10-5 N und ≈10-7 m (d.h. 0,1 % der Maximalkraft messbar und Verschiebung des Sensors), beziehungsweise.
Im Handel erhältlich, in großem Maßstab, nicht mechanische Prüfsysteme in der Regel messen Kräfte und Verschiebungen mit dieser Auflösung. Während Rasterkraft Mikroskop-basierte 9,10 oder mikroelektromechanische Systeme-basierte 11 Prüfgeräte ausreichende Auflösung haben, können sie messen, die Maximalkraft (jeweiligen Verschiebung) ist kleiner als die Maximalkraft (jeweiligen Verschiebung), die die LBBS standhalten können. Daher muss zum Durchführen von Biegeversuche auf diese LBBSs, Ingenieure und Wissenschaftler auf kundenspezifische mechanische Tests Geräte 5,7,12,13verlassen. Der Hauptvorteil dieser Custom-Built Geräte ist, dass sie große Bereiche der Kräfte und Verformungen aufnehmen können. Jedoch, den Bau und Betrieb dieser Geräte ist nicht gut dokumentiert in der Literatur.
Ein Protokoll wird beschrieben, für die Durchführung von drei-Punkt-Biegeversuche mit einer Custom-Built mechanische Prüfeinrichtung, die messen können Kräfte von 10-5 bis 101 N und Verschiebungen von 10-7 bis 10-2 m. Technische Zeichnungen, darunter alle Dimensionen, die Komponenten der mechanischen Prüfeinrichtung sind in das ergänzende Material zur Verfügung gestellt. Der Hauptvorteil dieser mechanischen Prüfgerät ist, dass die Gewalt und Vertreibung reicht leicht angepasst werden können verschiedene LBBSs. Das Gerät Funktionsprinzip ist ähnlich wie ein Rasterkraft-Mikroskop- 9. In diesem Gerät befindet sich eine Probe über einen Graben in eine Edelstahlplatte geschnitten (siehe Abbildung 1A-C). Die Spanne des Grabens wird vom optischen Mikrographen zu 1278 ± 3 µm gemessen (Mittelwert ± Standardabweichung; n = 10). Die Trench-Kanten unterstützen die Probe bei Biegeversuch (siehe Abbildung 1und D). Diese Probentisch eine dreiachsige Verschiebetisch befestigt und unter einem Aluminium-Keil so positioniert, dass der Keil auf halbem Weg über den Graben Spannweite befindet (siehe Abbildung 1C). Durch Bewegen der Bühne in der 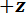 Richtung (siehe Abbildung 1A, und C), die Probe in den Keil, wodurch die Probe biegen geschoben.
Richtung (siehe Abbildung 1A, und C), die Probe in den Keil, wodurch die Probe biegen geschoben.
Wir verweisen auf den Keil der Last Point Spitze (LPT) sowie die Komponente des Geräts, das den Keil als Lastpunkt (LP) enthält. Die LP ist bis zum Ende des Freischwinger angebracht deren Verdrängung durch eine Faser-optischen Wegsensor (FODS) gemessen wird. Die FODS strahlt infrarotes Licht, die auf der Oberseite der LP von einem Spiegel reflektiert wird (siehe Abbildung 1B) und erhielt durch eine Glasfaser in die FODS. Ein ≈5 mm quadratischen Stück einen polierten Siliziumwafer dient als LP-Spiegel und ist angebracht, um die LP mit Epoxy. Die FODS misst Verschiebungen durch den Vergleich der Intensität des emittierten und reflektierten Lichts. Der Freischwinger Steifigkeit und Vertreibung werden verwendet, um die Kraft zu berechnen 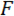 , von der Keil durch seine Wechselwirkung mit der Probe erlebt. Die Cantilever-Verschiebung dient auch zur Verschiebung der Querschnitt der Probe unter den Keil, berechnen
, von der Keil durch seine Wechselwirkung mit der Probe erlebt. Die Cantilever-Verschiebung dient auch zur Verschiebung der Querschnitt der Probe unter den Keil, berechnen 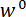 . Freischwinger-basierte Kraftsensoren wurden in einer Reihe von Mikro- und Makroebene mechanische Tests Studien 10,11,12,13,14verwendet. Die konkrete Ausgestaltung, die hier vorgestellt wird von einem mechanischen Tests Gerät verwendet für die Durchführung von Klebstoff Kontakt Experimente 14angepasst. Ein ähnliches Design wurde auch in einem handelsüblichen Micro-Tribometer 15,16eingesetzt.
. Freischwinger-basierte Kraftsensoren wurden in einer Reihe von Mikro- und Makroebene mechanische Tests Studien 10,11,12,13,14verwendet. Die konkrete Ausgestaltung, die hier vorgestellt wird von einem mechanischen Tests Gerät verwendet für die Durchführung von Klebstoff Kontakt Experimente 14angepasst. Ein ähnliches Design wurde auch in einem handelsüblichen Micro-Tribometer 15,16eingesetzt.
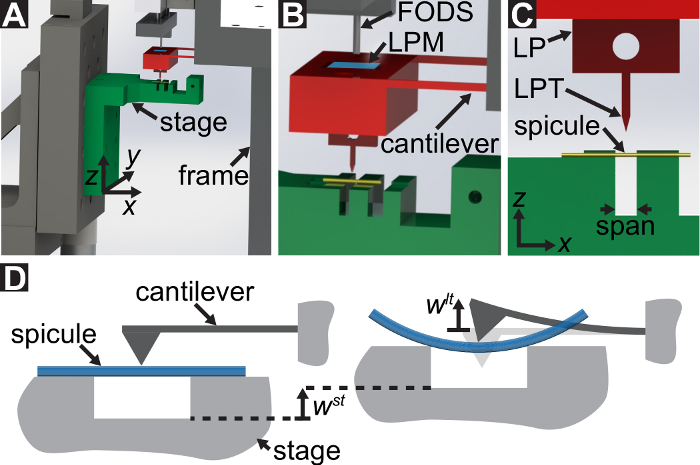
Abbildung 1: Übersicht über die Custom-Built mechanische Prüfeinrichtung. (A) A Computer-aided Design Rendering des Geräts. Die Bühne-Komponenten sind in grün hervorgehoben. Die Force sensing-Unterbaugruppe (Freischwinger, Lastpunkt (LP)) ist rot markiert. (B) ein vergrößert Ansicht von (A). Der LP-Spiegel zeigt in blau auf der Oberseite der LP unter dem FODS und LPM beschriftet ist. (C) das Koordinatensystem verwendet, um die Bewegung der Übersetzung Bühne beschreiben. Durch Abgleich the-Bühne im Schritt 1.9 des Protokolls, die 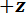 Richtung erfolgt zeitgleich mit der Vektor senkrecht zur Fläche des Spiegels LP. (D) eine schematische Darstellung der Dreipunkt-Biege-Konfiguration zeigt die Verformung der Spicule und die gemessenen Verformungen
Richtung erfolgt zeitgleich mit der Vektor senkrecht zur Fläche des Spiegels LP. (D) eine schematische Darstellung der Dreipunkt-Biege-Konfiguration zeigt die Verformung der Spicule und die gemessenen Verformungen 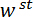 , und
, und 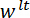 . Bitte klicken Sie hier für eine größere Version dieser Figur.
. Bitte klicken Sie hier für eine größere Version dieser Figur.
Die Gerätefunktionen werden demonstriert, indem die drei-Punkt-Biegeversuche auf das Skelett Elemente des marinen Schwammes Euplectella Aspergillus6,7. Dieser Schwamm Skelett ist eine Versammlung von Filamenten, genannt Schwammnadeln (siehe Abb. 2A). Die Nadeln sind ≈50 µm dick und bestehen hauptsächlich aus Kieselsäure 6. Biosilica-basierte Knochensplitter befinden sich in Schwämmen, die Zugehörigkeit zu den Klassen Demospongiae, Homoscleromorpha und Hexactinellida. Schwämme, wie E. Aspergillus, die gehören zu der Klasse Hexactinellida sind auch bekannt als “Glas Schwämme.” Während die Knochensplitter Glas Schwämme in erster Linie aus Kieselsäure bestehen, hat sich gezeigt, dass die Kieselsäure oft eine organische Matrix bestehend aus entweder Kollagen 17,18 oder Chitin 19,20 enthält , 21. dieser organische Matrix spielt eine wichtige Rolle in Kieselsäure Biomineralisation 18,20. Darüber hinaus in einigen Knochensplitter dient die organische Matrix auch als Vorlage für die Biomineralisation von Kalzium 22. Zusätzlich innerhalb der Kieselsäure verteilt wird, kann die organische Matrix auch unterschiedliche Schichten bilden, die das Spicule Kieselsäure in konzentrischen, zylindrische Lamellen 6,23zu partitionieren. Es hat sich gezeigt, dass diese konzentrischen, lamellare Architektur die Knochensplitter Verformung Verhalten 6,7,8,24,25,26 beeinflussen können . Infolgedessen die Knochensplitter mechanischen Eigenschaften werden durch eine Kombination von ihrer Chemie bestimmt (zB., die chemische Struktur des Verbundes Kieselsäure-Protein) und ihre Architektur- 27. Die chemische Struktur und Architektur des Glas Schwamm Knochensplitter sind noch in der Untersuchung 24,28,29.
Die meisten der Knochensplitter in E. Aspergillus werden zusammen bilden einen steifen Skelett Käfig zementiert. An der Basis des Skeletts ist jedoch eine Büschel von sehr langen (≈10 cm) Knochensplitter bekannt als der Anker Schwammnadeln (siehe Abb. 2A). Wir beschreiben das Protokoll für die Durchführung von drei-Punkt-Biegeversuche auf kleine Abschnitte der Anker Schwammnadeln.
In Schritt 1 des Protokolls wird das Verfahren für die Montage und Ausrichtung der Komponenten der Custom-Built mechanische Prüfeinrichtung beschrieben. Schritte 2 und 4 des Protokolls bieten Anleitungen für Erzeugung von Kalibrierdaten verwendet, um Kräfte und Verschiebungen in der Biegeversuch berechnen. Die Schritte unternommen, um einen Abschnitt eines Spicule vorbereiten und montieren Sie es auf die Prüfvorrichtung sind in Schritt 3beschrieben. Das Verfahren für die Durchführung der Biegeversuch im Abschnitt Spicule wird in Schritt 5beschrieben. Zu guter Letzt im Abschnitt Vertreter Ergebnisse die Kalibrierdaten erhalten Sie in Schritte 2 und 4 dienen zusammen mit der Biegung Testdaten in Schritt 5 erhaltenen berechnen 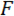 und
und 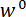 .
.

Abbildung 2: Verfahren für Schnitt und Inspektion E. Aspergillus Schwammnadeln. (A) das Skelett des E. Aspergillus. Die Büschel der freistehenden Anker Knochensplitter ist an der Basis des Skeletts dargestellt. Die Maßstabsleiste beträgt ~ 25 mm (B), die einen einzigen Anker Spicule auf einen Objektträger mit einem #00000 rot Sable Pinsel und geschnitten, mit einer Rasierklinge gehalten ist. Die Maßstabsleiste beträgt ~ 12 mm (C) ein Abschnitt einer E. Aspergillus -Spicule über den Graben auf der Probe-Bühne platziert. Der Graben Kanten und Graben Ridge sind blaugrün und Orange, hervorgehoben. Das Spicule wird gegen die Kante des Grabens geschoben, um sicherzustellen, dass ihre Achse senkrecht bis an den Rand des Grabens ist. (D) ein Schliffbild von einem Spicule, der vergeht der Inspektion beschriebene in Schritt 3.4 des Protokolls, das beschreibt, wie um festzustellen, ob ein Spicule Abschnitt beschädigt ist und verworfen werden muss. (E) ein Schliffbild von eine Spicule enthält viele Risse und große Teile der Silizium-Schichten, die dem in Schritt 3.4 des Protokolls beschriebenen Prüfverfahren scheitern würde fehlen. Skalieren von Balken = 250 µm (C), 100 µm (D) und 100 µm (E). Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Mehrere Schritte des Protokolls sind besonders wichtig, um sicherzustellen, dass Kräfte und Verschiebungen genau gemessen werden. Während einige dieser kritischen Schritte universell für alle drei-Punkt-Biegeversuche, sind andere einzigartig für diese mechanische Prüfeinrichtung.
In Schritt 1.2 des Protokolls der LP-Spiegel ist gereinigt und überprüft auf Kratzer und im Schritt 1.6 des Protokolls ist die FODS Verstärkung eingestellt. Es ist wichtig fü…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde unterstützt durch National Science Foundation [Mechanik der Werkstoffe und Strukturen Programm, Anzahl 1562656 gewähren]; und der American Society of Mechanical Engineers [Haythornthwaite Young Investigator Award].
Materials
| TMC 36" x 48" isolation table with 4" CleanTop breadboard | TMC | 63-563 | Isolation Table |
| Diffeential Screw Adjuster | Thorlabs | DAS110 | For stage leveling plate |
| 1" Travel Micrometer Head with 0.001" Graduations | Thorlabs | 150-801ME | For stage leveling plate |
| Right-Angle Bracket for PT Series Translation Stages, 1/4"-20 Mounting Holes | Thorlabs | PT102 | For microscope mount |
| 1" Dovetail Translation Stage, 1/4"-20 Taps | Thorlabs | DT25 | For microscope mount |
| 1" Translation Stage with 1/4"-170 Adjustment Screw, 1/4"-20 Taps | Thorlabs | PT1B | For microscope mount |
| 12" Length, Dovetail Optical Rail | Edmund Optics | 54-401 | For microscope mount |
| 2.5" Width, Dovetail Carrier | Edmund Optics | 54-404 | For microscope mount |
| 0.5" Width, Dovetail Carrier | Edmund Optics | 54-403 | For microscope mount |
| InfiniTube Mounting C-Clamp with ¼-20 | Edmund Optics | 57-788 | Microscope component |
| Standard (with no In-Line Attachment), InfiniTube | Edmund Optics | 56-125 | Microscope component |
| Standard In-Line Attachment (Optimized at 2X-10X), InfiniTube | Edmund Optics | 56-126 | Microscope component |
| Mitutoyo/Achrovid Objective Adapter (M26 to M27) | Edmund Optics | 53-787 | Microscope component |
| 5X Infinity Achrovid Microscope Objective | Edmund Optics | 55-790 | Microscope component |
| 0.316" ID, Fiber Optic Adapter SX-6 | Edmund Optics | 38-944 | Microscope component |
| ¼" x 36", Flexible Fiber Optic Light Guide | Edmund Optics | 42-347 | Microscope component |
| 115V, MI-150 Fiber Optic Illuminator w/IR Filter and Holder | Edmund Optics | 55-718 | Microscope component |
| Allied Vision Manta G-223 2/3" Color CMOS Camera | Edmund Optics | 88-452 | Microscope component |
| Power Supply for Manta/ Guppy Pro/ Stingray/ Pike | Edmund Optics | 68-586 | Microscope component |
| 1/4" Travel Single Axis Translation Stage | Thorlabs | MS1S | FODS micrometer |
| Analog Reflectance Dependent Fiber Optic Displacement Sensor | Philtec | D20 | FODS |
| 30V, 3A DC Power Supply | Agilent | U8001A | Power supply for DAQ and FODS |
| 14-Bit, 48 kS/s Low-Cost Multifunction DAQ | National Instruments | USB-6009 | DAQ for FODS |
| Three Axis Motorized Translation Stage | Thorlabs | Thorlabs T25 XYZ-E/M | Translation stage |
| T-Cube DC Servo Motor Controller | Thorlabs | TDC001 | Motor controller for stage |
| T-Cube Power Supply | Thorlabs | TPS001 | Power supply for motor controller |
| National Instruments LabVIEW (2013 SP1) | National Instruments | Used for running software | |
| National Instruments LabVIEW Vision Acquisition Software (2016) | National Instruments | Used for running software | |
| Nikon Eclipse Ci-POL Main Body | MVI | MDA96000 | Polarized light microscope |
| Nikon Pi Intermediate Tube with Analyzer Slider | MVI | MDB45305 | Polarized light microscope |
| Nikon Dia-Polarizer | MVI | MDN11920 | Polarized light microscope |
| Power Cord – 7'6" | MVI | 79035 | Polarized light microscope |
| Nikon P-Amh Mechanical Stage | MVI | MDC45000 | Polarized light microscope |
| Nikon Lwd Achromat Condenser | MVI | MBL16100 | Polarized light microscope |
| Nikon LV-NBD5BD-CH Manual Quint Nosepiece ESD | MVI | MBP60125 | Polarized light microscope |
| Nikon C-TF Trinocular Tube F | MVI | MBB93100 | Polarized light microscope |
| Nikon CFI 10X Eyepiece FN 22mm NC | MVI | MAK10110 | Polarized light microscope |
| Nikon TU Plan Flour BD 10x Objective | MVI | MUE42100 | Polarized light microscope |
| Venus Flower Basket Sponge | Denis Brand | N/A | Sponge skeleton |
| 3.5X Headband Flip-Up Magnifier | McMaster Carr | 1490T5 | Used for spicule sectioning |
| Ø1" Silicon Wafer, Type P / <100> | Ted Pella | 16011 | Used for load point mirror |
| Low Lint Tapered Tip Cotton Swab | McMaster Carr | 71035T31 | Used for cleaning LP mirror |
| Rubber grip precision knife | McMaster Carr | 35575A68 | Used for sectioning spicules |
| Microscope Slides, frosted end, 75 x 25 x 1mm | Ted Pella | 260409 | Used for sectioning spicules |
| Sable Brushes, #00000, 0.08mm W x 4.0mm L | Ted Pella | 11806 | Used for handling spicules |
| PELCO Pro High Precision Tweezers, extra fine tips, superior finish | Ted Pella | 5367-5NM | Used for handling spicules |
| Dual Axis Linear Scale Micrometer | Edmund Optics | 58-608 | Used for calibrating the microscopes |
| FLEX-A-TOP FT-38 CAS | ESD Plastic Containers | FT-38-CAS | Used for storing spicules |
| Plastic Vial Bullseye Level | McMaster Carr | 2147A11 | Used for leveling the stage |
| Analytical Balance | Mettler Toledo | MS105DU | Used to mass calibration weights |
Referencias
- Wegst, U. G., Bai, H., Saiz, E., Tomsia, A. P., Ritchie, R. O. Bioinspired structural materials. Nat. Mater. 14 (1), 23-36 (2015).
- Meyers, M. A., McKittrick, J., Chen, P. Y. Structural biological materials: critical mechanics-materials connections. Science. 339 (6121), 773-779 (2013).
- Bodde, S. G., Meyers, M. A., McKittrick, J. Correlation of the mechanical and structural properties of cortical rachis keratin of rectrices of the Toco Toucan (Ramphastos toco). J. Mech. Behav. Biomed. Mater. 4 (5), 723-732 (2011).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. J. R. Soc. Interface. , (2012).
- Monn, M. A., Kesari, H. A new structure-property connection in the skeletal elements of the marine sponge Tethya aurantia that guards against buckling instability. Sci. Rep. 7, (2017).
- Monn, M. A., Weaver, J. C., Zhang, T., Aizenberg, J., Kesari, H. New functional insights into the internal architecture of the laminated anchor spicules of Euplectella aspergillum. Proc. Natl. Acad. Sci. U.S.A. 112 (16), 4976-4981 (2015).
- Monn, M. A., Kesari, H. Enhanced bending failure strain in biological glass fibers due to internal lamellar architecture. J. Mech. Behav. Biomed. Mater. , (2017).
- Levi, C., Barton, J. L., Guillemet, C., Bras, E., Lehuede, P. A remarkably strong natural glassy rod: the anchoring spicule of the Monorhaphis sponge. J. Mater. Sci. Letters. 8 (3), 337-339 (1989).
- Kesari, H., Doll, J. C., Pruitt, B. L., Cai, W., Lew, A. J. Role of surface roughness in hysteresis during adhesive elastic contact. Philos. Mag. Lett. 90 (12), 891-902 (2010).
- Croisier, F., et al. Mechanical testing of electrospun PCL fibers. Acta Biomater. 8 (1), 218-224 (2012).
- Haque, M. A., Saif, M. T. A review of MEMS-based microscale and nanoscale tensile and bending testing. Exp. Mech. 43 (3), 248-255 (2003).
- Gudlavalleti, S. . Mechanical testing of solid materials at the micro-scale. , (2002).
- Tohmyoh, H., Ishihara, M., Akanda, M. S., Yamaki, S., Watanabe, T., Iwabuchi, T. Accurate determination of the structural elasticity of human hair by a small-scale bending test. J. Biomech. 44 (16), 2833-2837 (2011).
- Waters, J. F. . Contact mechanics of biologically-inspired interface geometries. , (2009).
- Dai, Z., Gorb, S. N., Schwarz, U. Roughness-dependent friction force of the tarsal claw system in the beetle Pachnoda marginata (Coleoptera, Scarabaeidae). J. Exp. Biol. 205 (16), 2479-2488 (2002).
- Tramacere, F., Kovalev, A., Kleinteich, T., Gorb, S. N., Mazzolai, B. Structure and mechanical properties of Octopus vulgaris suckers. J. R. Soc. Interface. 11 (91), (2014).
- Ehrlich, H., et al. Nanostructural organization of naturally occurring composites: Part I. Silica-Collagen-based biocomposites. J. Nanomater. 53, (2008).
- Ehrlich, H., et al. Mineralization of the meter-long biosilica structures of glass sponges is templated on hydroxylated collagen. Nat. Chem. 2, 1084-1088 (2010).
- Ehrlich, H., et al. First evidence of the presence of chitin in skeletons of marine sponges. Part II. Glass sponges (Hexactinellida: Porifera). J. Exp. Zoo. 308 (4), 473-483 (2007).
- Ehrlich, H. Chitin and collagen as universal and alternative templates in biomineralization. Int. Geol Rev. 52, 661-699 (2010).
- Ehrlich, H., et al. Supercontinuum generation in naturally occurring glass sponge spicules. Adv. Opt. Mater. 4 (10), 1608-1613 (2016).
- Ehrlich, H., et al. Calcite reinforced silica-silica joints in the biocomposite skeleton of deep-sea glass sponges. Adv. Funct. Mater. 21, 3473-3481 (2011).
- Werner, P., Blumtritt, H., Zlotnikov, I., Graff, A., Dauphin, Y., Fratzl, P. Electron microscope analyses of the bio-silica basal spicule from the Monorhaphis chuni sponge. J. Struct. Biol. 191 (2), 165-174 (2015).
- Kolednik, O., Predan, J., Fischer, F. D., Fratzl, P. Bioinspired Design Criteria for Damage-Resistant Materials with Periodically Varying Microstructure. Adv. Funct. Mater. 21 (19), 3634-3641 (2011).
- Weaver, J. C., et al. Unifying design strategies in demosponge and hexactinellid skeletal systems. J. Adhes. 86 (1), 72-95 (2010).
- Walter, S. L., Flinn, B. D., Mayer, G. Mechanisms of toughening of a natural rigid composite. Mater. Sci. Eng. C. 27 (3), 570-574 (2007).
- Ehrlich, H. Silica biomineralization in Sponges. Encyclopedia of Geobiology. , 796-808 (2011).
- Zlotnikov, I., Werner, P., Fratzl, P., Zolotoyabko, E. Eshelby Twist as a possible source of lattice rotation in a perfectly ordered protein/silica structure grown by a simple organism. Small. 11 (42), 5636-5641 (2015).
- Zlotnikov, I., et al. A perfectly periodic three-dimensional protein/silica mesoporous structure produced by an organism. Adv. Mater. 26 (11), 1682-1687 (2014).
- Gere, J. M., Timoshenko, S. P. Chapter 5: Stresses in Beams. Mechanics of materials. , 205-217 (1997).
- Baratta, F. I., Matthews, W. T., Quinn, G. D. . Errors associated with flexure testing of brittle materials. , (1987).
- Quinn, G. D., Sparenberg, B. T., Koshy, P., Ives, L. K., Jahanmir, S., Arola, D. D. Flexural strength of ceramic and glass rods. J. Test. Eval. 37 (3), 1-23 (2009).
- Tattersall, H. G., Tappin, G. The work of fracture and its measurement in metals, ceramics and other materials. J. Mater. Sci. 1 (3), 296-301 (1966).

