Un milímetro a la flexión prueba sistema de la escala para medir las propiedades mecánicas de espículas de esponja marina
Summary
Presentamos un protocolo para la realización de pruebas de flexión de tres puntos en las fibras de escala submilimétrica utilizando un dispositivo mecánico a la medida. El aparato puede medir las fuerzas que van desde 20 µN hasta 10 N y por lo tanto puede acomodar una variedad de tamaños de fibra.
Abstract
Muchos cargan teniendo estructuras biológicas (LBBSs) — como estimará pluma y espículas, son pequeños (< 1 mm) pero no microscópica. Medir el comportamiento a la flexión de estos LBBSs es importante para comprender los orígenes de sus notables funciones mecánicas.
Se describe un protocolo para realizar pruebas de flexión de tres puntos mediante un dispositivo mecánico de prueba a la medida que puede medir fuerzas hasta de 10-5 101 N y desplazamientos que van desde 10-7 10-2 m. La principal ventaja de este dispositivo mecánico de prueba es que las capacidades de fuerza y el desplazamiento se pueden ajustar fácilmente para diferentes LBBSs. Principio de funcionamiento del dispositivo es similar a la de un microscopio de fuerza atómica. Es decir, la fuerza se aplica a la LBBS por un punto de carga que se adjunta al final de un cantilever. El desplazamiento del punto de carga es medido por un sensor de desplazamiento óptico de fibra y convertido en una fuerza con la rigidez de la medida del voladizo. Gama de fuerza del dispositivo se puede ajustar mediante el uso de voladizos de diferentes rigideces.
Se demuestran las capacidades del dispositivo mediante la realización de pruebas de flexión de tres puntos en los elementos esqueléticos de la esponja marina Euplectella aspergillum. Los elementos esqueléticos — conocidos como espículas, son fibras de sílice que son aproximadamente de 50 μm de diámetro. Se describen los procedimientos para calibrar el dispositivo de pruebas mecánico, montaje de las espículas en un accesorio de flexión de tres puntos con un palmo de ≈1.3 mm, y realizar una flexión prueba. Se mide la fuerza aplicada a la Espícula y su desviación en la ubicación de la fuerza aplicada.
Introduction
Mediante el estudio de las arquitecturas de estructuras biológicas (LBBSs), como la cáscara y el hueso de soporte de carga, los ingenieros han desarrollado nuevos materiales compuestos que son fuertes y duros 1. Se ha demostrado que las propiedades mecánicas notables de LBBSs y sus contrapartes bio-inspirados están relacionados con sus intrincadas arquitecturas internas 2. Sin embargo, las relaciones entre arquitecturas LBBS y propiedades mecánicas no se entienden completamente. Medición de respuesta mecánica de un LBBS es el primer paso hacia la comprensión de cómo la arquitectura mejora sus propiedades mecánicas.
Sin embargo, es importante que el tipo de examen utilizado para medir la respuesta mecánica de un LBBS es coherente con su función mecánica. Por ejemplo, desde plumas deben soportar cargas aerodinámicas, la función primaria de un raquis de pluma es darle rigidez a la flexión 3. Por lo tanto, una prueba de flexión es preferible a una prueba de tensión uniaxial para medir su respuesta mecánica. De hecho, muchos LBBSs, como pluma estimará 3, hierba tallos 4y espículas 5,6,7,8— sobre todo deforme por flexión. Esto es porque estos LBBSs son delgados,es decir, su longitud es mucho mayor que su anchura o profundidad. Sin embargo, realizar pruebas de flexión en estos LBBSs es un reto porque las fuerzas y desplazamientos que pueden soportar antes de fallar la gama de 10-2 a 102 N y 10-4 10-3 m, respectivamente 3 , 4 , 5 , 7 , 8. en consecuencia, el dispositivo utilizado para realizar estas pruebas mecánicas debe tener resoluciones de fuerza y el desplazamiento de ≈10-5 N y ≈10-7 m (es decir, el 0.1% de fuerza máxima mensurable y desplazamiento del sensor), respectivamente.
Disponible comercialmente a gran escala, los sistemas mecánicos de prueba típicamente no pueden medir fuerzas y desplazamientos con esta resolución. Mientras que fuerza atómica microscopio base 9,10 o micrométrica basadas en sistemas 11 aparatos de control tienen la resolución adecuada, la fuerza máxima (desplazamiento respectivo) que pueden medir es menor que la fuerza máxima (desplazamiento respectivo) que puede soportar el LBBS. Por lo tanto realizar las pruebas de flexión en estos LBBSs, ingenieros y científicos debe confiar en a la medida mecánica pruebas dispositivos 5,7,12,13. La principal ventaja de estos dispositivos a la medida es que puede acomodar las gamas grandes de las fuerzas y desplazamientos. Sin embargo, la construcción y operación de estos dispositivos no está bien documentado en la literatura.
Un protocolo es descrito para realizar pruebas de flexión de tres puntos mediante un dispositivo mecánico de prueba a la medida que puede medir fuerzas hasta de 10-5 101 N y desplazamientos que van desde 10-7 10-2 m. Dibujos técnicos, incluyendo todas las dimensiones, de los componentes del dispositivo de pruebas mecánico se encuentran en el Material complementario. La principal ventaja de este dispositivo mecánico de prueba es que los rangos de fuerza y desplazamiento se pueden ajustar fácilmente para adaptarse a diferentes LBBSs. Principio de funcionamiento del dispositivo es similar a la de un microscopio de fuerza atómica 9. En este dispositivo, se coloca un espécimen a través de una zanja en una placa de acero inoxidable (ver figura 1A-C). El palmo de la zanja se mide desde la ópticas micrografías que 1278 ± 3 μm (media ± desviación estándar, n = 10). Los bordes de la zanja apoyan al espécimen durante la prueba de flexión (véase figura 1y D). Esta etapa muestra es conectada a una etapa de la traducción de tres ejes y coloca debajo de una cuña de aluminio de modo que la cuña se encuentra a medio camino a través del palmo de la zanja (véase figura 1C). Moviendo el escenario en el 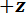 la dirección (véase figura 1Ay C), la muestra se empuja en la cuña causando el espécimen para doblar.
la dirección (véase figura 1Ay C), la muestra se empuja en la cuña causando el espécimen para doblar.
Nos referimos a la cuña como la punta del punto de carga (LPT) y el componente del dispositivo que contiene la cuña como el punto de carga (LP). El LP se une al extremo de un voladizo cuyo desplazamiento se mide por un sensor de desplazamiento óptico de fibra (FODS). La FODS emite luz infrarroja, que se refleja en un espejo situado en la parte superior del LP (ver figura 1B) y recibido por una fibra óptica en la FODS. Una pieza cuadrada de ≈5 milímetro de una oblea de silicio pulido se utiliza como el espejo de LP y se encuentra en el LP con resina. La FODS medidas de desplazamientos mediante la comparación de las intensidades de la luz emitida y reflejada. La rigidez del voladizo y desplazamiento se utilizan para calcular la fuerza, 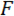 , experimentado por la cuña debido a su interacción con la muestra. El desplazamiento de voladizo se utiliza también para calcular el desplazamiento de la sección transversal del espécimen debajo de la cuña,
, experimentado por la cuña debido a su interacción con la muestra. El desplazamiento de voladizo se utiliza también para calcular el desplazamiento de la sección transversal del espécimen debajo de la cuña, 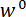 . Sensores basados en voladizo se han utilizado en un número de micro y macro escala mecánica pruebas estudios 10,11,12,13,14. El diseño específico aquí presentado es una adaptación de un dispositivo mecánico utilizado para realizar experimentos de contacto adhesivo 14. Un diseño similar también se ha utilizado en un tribómetro de micro disponibles en el mercado 15,16.
. Sensores basados en voladizo se han utilizado en un número de micro y macro escala mecánica pruebas estudios 10,11,12,13,14. El diseño específico aquí presentado es una adaptación de un dispositivo mecánico utilizado para realizar experimentos de contacto adhesivo 14. Un diseño similar también se ha utilizado en un tribómetro de micro disponibles en el mercado 15,16.
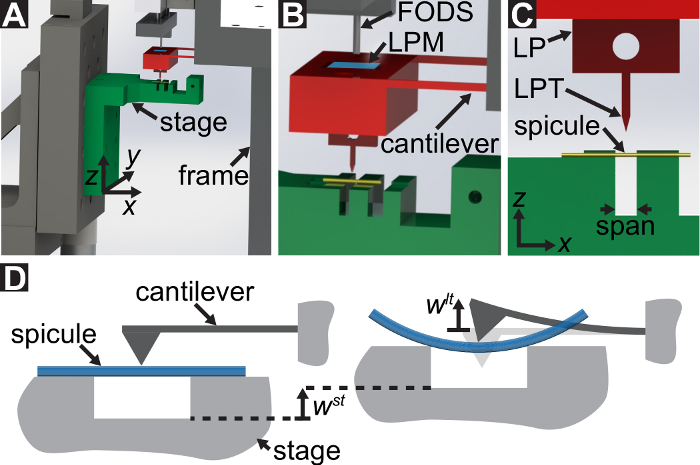
Figura 1: Resumen del dispositivo prueba mecánico a la medida de. (A) A representación de diseño asistido por ordenador del dispositivo. Los componentes de la etapa se resaltan en verde. La fuerza de detección de subconjunto (cantilever, punto de carga (LP)) está resaltada en rojo. (B) una magnifica vista de (A). El espejo LP aparece en azul en la superficie superior del LP bajo la FODS y está etiquetado como LPM. (C) el sistema de coordenadas utilizado para describir el movimiento de la etapa de la traducción. Por nivelación de thetapa e paso 1.9 del Protocolo, la 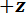 la dirección es hecho para coincidir con el vector normal a la superficie del espejo del LP. (D) A esquema de la configuración de flexión de tres puntos que muestra la deformación de la Espícula y los desplazamientos medidos
la dirección es hecho para coincidir con el vector normal a la superficie del espejo del LP. (D) A esquema de la configuración de flexión de tres puntos que muestra la deformación de la Espícula y los desplazamientos medidos 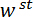 , y
, y 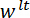 . Haga clic aquí para ver una versión más grande de esta figura.
. Haga clic aquí para ver una versión más grande de esta figura.
Están demostradas las capacidades del dispositivo mediante la realización de pruebas de flexión de tres puntos en los elementos esqueléticos de la esponja marina Euplectella aspergillum6,7. Esqueleto de la esponja es un conjunto de filamentos, llamados espículas (ver figura 2A). Las espículas son ≈50 μm de espesor y se componen principalmente de sílice 6. Espículas basado en Biosilica se encuentran en esponjas pertenecientes a la clase Hexactinellida, Demospongiae y Homoscleromorpha. Esponjas, como E. aspergillum, que pertenecen a la clase Hexactinellida también son conocidos como “esponjas de cristal”. Mientras que las espículas de esponjas de cristal se componen principalmente de sílice, se ha demostrado que la sílice a menudo contiene una matriz orgánica compuesta de cualquier colágeno 17,18 o quitina 19,20 , 21. esta matriz orgánica juega un papel importante en sílice biomineralización 18,20. Además, en algunas espículas la matriz orgánica también sirve como una plantilla para la biomineralización de calcio 22. Además de ser distribuidos en la sílice, la matriz orgánica también puede formar capas distintas que la partición de sílice de la Espícula en laminillas concéntricas, cilíndrico 6,23. Se ha demostrado que esta arquitectura laminar concéntrica puede afectar deformación comportamiento 6,7,8,24,25,26 las espículas . Por lo tanto, propiedades mecánicas de las espículas están determinados por una combinación de la química (es decir., la estructura química del compuesto de sílice en proteínas) y su arquitectura 27. La estructura química y la arquitectura de espículas de esponja de vidrio están todavía bajo investigación 24,28,29.
La mayoría de las espículas en E. aspergillum se cementa juntos para formar una jaula esquelética rígida. Sin embargo, en la base del esqueleto hay un penacho de muy largas espículas de (≈10 cm) conocido como las espículas de anclaje (ver figura 2A). Describimos el protocolo para la realización de pruebas de flexión de tres puntos de pequeñas secciones de las espículas de anclaje.
En el paso 1 del Protocolo, se describe el procedimiento para el montaje y alineación de los componentes del dispositivo prueba mecánico a la medida. Pasos 2 y 4 del protocolo proporcionan las instrucciones para generar datos de calibración utilizados para calcular las fuerzas y desplazamientos en la prueba de flexión. Los pasos para preparar una sección de una Espícula y montarlo en la lámpara de prueba se describen en el paso 3. El procedimiento para la realización de la prueba de flexión en la sección de la Espícula se describe en el paso 5. Por último, en la sección de Resultados de la representante de la calibración de los datos obtenidos en los pasos 2 y 4 se utiliza junto con los datos de prueba de flexión obtenidos en el paso 5 para calcular 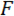 y
y 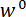 .
.

Figura 2: Procedimiento de seccionamiento e inspección espículas E. aspergillum. (A) el esqueleto de E. aspergillum. El penacho de espículas de anclaje independiente se muestra en la base del esqueleto. La barra de escala es de ~ 25 mm. (B) una Espícula de anclaje de un solo se sostiene en un portaobjetos de microscopio con un cepillo de sable #00000 rojo y seccionada con una cuchilla de afeitar. La barra de escala es ~ 12 mm. (C) una sección de una Espícula aspergillum E. colocada a través de la fosa en el escenario de la muestra. Los bordes de la zanja y canto de trinchera se resaltan en verde azulado y naranja, respectivamente. La Espícula es empujado contra la cresta de la zanja para que su eje sea perpendicular a los bordes de la zanja. (D) una micrografía de una Espícula que pasa el procedimiento de inspección descrito en el paso 3.4 del Protocolo, que se describe cómo determinar si una sección de Espícula está dañada y debe ser desechada. (E) A micrografía de una Espícula que contiene muchas fisuras y que faltan grandes secciones de capas de sílice que no el procedimiento de inspección descrito en el paso 3.4 del protocolo. Barras de escala = 250 μm (C), (D) de 100 μm y 100 μm (E). Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Varios pasos del protocolo son particularmente importantes para asegurar que las fuerzas y los desplazamientos se miden con precisión. Mientras que algunos de estos pasos fundamentales son universales a todas las pruebas flexión de tres puntos, otros son exclusivos para este dispositivo mecánico de prueba.
En el paso 1.2 del protocolo el espejo LP se limpia y se inspecciona para arañazos y en paso 1.6 del Protocolo se establece la ganancia FODS. Es importa…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue financiado por National Science Foundation [mecánica de materiales y estructuras de programa, número 1562656]; y la sociedad americana de ingenieros mecánicos [Premio al investigador joven Haythornthwaite].
Materials
| TMC 36" x 48" isolation table with 4" CleanTop breadboard | TMC | 63-563 | Isolation Table |
| Diffeential Screw Adjuster | Thorlabs | DAS110 | For stage leveling plate |
| 1" Travel Micrometer Head with 0.001" Graduations | Thorlabs | 150-801ME | For stage leveling plate |
| Right-Angle Bracket for PT Series Translation Stages, 1/4"-20 Mounting Holes | Thorlabs | PT102 | For microscope mount |
| 1" Dovetail Translation Stage, 1/4"-20 Taps | Thorlabs | DT25 | For microscope mount |
| 1" Translation Stage with 1/4"-170 Adjustment Screw, 1/4"-20 Taps | Thorlabs | PT1B | For microscope mount |
| 12" Length, Dovetail Optical Rail | Edmund Optics | 54-401 | For microscope mount |
| 2.5" Width, Dovetail Carrier | Edmund Optics | 54-404 | For microscope mount |
| 0.5" Width, Dovetail Carrier | Edmund Optics | 54-403 | For microscope mount |
| InfiniTube Mounting C-Clamp with ¼-20 | Edmund Optics | 57-788 | Microscope component |
| Standard (with no In-Line Attachment), InfiniTube | Edmund Optics | 56-125 | Microscope component |
| Standard In-Line Attachment (Optimized at 2X-10X), InfiniTube | Edmund Optics | 56-126 | Microscope component |
| Mitutoyo/Achrovid Objective Adapter (M26 to M27) | Edmund Optics | 53-787 | Microscope component |
| 5X Infinity Achrovid Microscope Objective | Edmund Optics | 55-790 | Microscope component |
| 0.316" ID, Fiber Optic Adapter SX-6 | Edmund Optics | 38-944 | Microscope component |
| ¼" x 36", Flexible Fiber Optic Light Guide | Edmund Optics | 42-347 | Microscope component |
| 115V, MI-150 Fiber Optic Illuminator w/IR Filter and Holder | Edmund Optics | 55-718 | Microscope component |
| Allied Vision Manta G-223 2/3" Color CMOS Camera | Edmund Optics | 88-452 | Microscope component |
| Power Supply for Manta/ Guppy Pro/ Stingray/ Pike | Edmund Optics | 68-586 | Microscope component |
| 1/4" Travel Single Axis Translation Stage | Thorlabs | MS1S | FODS micrometer |
| Analog Reflectance Dependent Fiber Optic Displacement Sensor | Philtec | D20 | FODS |
| 30V, 3A DC Power Supply | Agilent | U8001A | Power supply for DAQ and FODS |
| 14-Bit, 48 kS/s Low-Cost Multifunction DAQ | National Instruments | USB-6009 | DAQ for FODS |
| Three Axis Motorized Translation Stage | Thorlabs | Thorlabs T25 XYZ-E/M | Translation stage |
| T-Cube DC Servo Motor Controller | Thorlabs | TDC001 | Motor controller for stage |
| T-Cube Power Supply | Thorlabs | TPS001 | Power supply for motor controller |
| National Instruments LabVIEW (2013 SP1) | National Instruments | Used for running software | |
| National Instruments LabVIEW Vision Acquisition Software (2016) | National Instruments | Used for running software | |
| Nikon Eclipse Ci-POL Main Body | MVI | MDA96000 | Polarized light microscope |
| Nikon Pi Intermediate Tube with Analyzer Slider | MVI | MDB45305 | Polarized light microscope |
| Nikon Dia-Polarizer | MVI | MDN11920 | Polarized light microscope |
| Power Cord – 7'6" | MVI | 79035 | Polarized light microscope |
| Nikon P-Amh Mechanical Stage | MVI | MDC45000 | Polarized light microscope |
| Nikon Lwd Achromat Condenser | MVI | MBL16100 | Polarized light microscope |
| Nikon LV-NBD5BD-CH Manual Quint Nosepiece ESD | MVI | MBP60125 | Polarized light microscope |
| Nikon C-TF Trinocular Tube F | MVI | MBB93100 | Polarized light microscope |
| Nikon CFI 10X Eyepiece FN 22mm NC | MVI | MAK10110 | Polarized light microscope |
| Nikon TU Plan Flour BD 10x Objective | MVI | MUE42100 | Polarized light microscope |
| Venus Flower Basket Sponge | Denis Brand | N/A | Sponge skeleton |
| 3.5X Headband Flip-Up Magnifier | McMaster Carr | 1490T5 | Used for spicule sectioning |
| Ø1" Silicon Wafer, Type P / <100> | Ted Pella | 16011 | Used for load point mirror |
| Low Lint Tapered Tip Cotton Swab | McMaster Carr | 71035T31 | Used for cleaning LP mirror |
| Rubber grip precision knife | McMaster Carr | 35575A68 | Used for sectioning spicules |
| Microscope Slides, frosted end, 75 x 25 x 1mm | Ted Pella | 260409 | Used for sectioning spicules |
| Sable Brushes, #00000, 0.08mm W x 4.0mm L | Ted Pella | 11806 | Used for handling spicules |
| PELCO Pro High Precision Tweezers, extra fine tips, superior finish | Ted Pella | 5367-5NM | Used for handling spicules |
| Dual Axis Linear Scale Micrometer | Edmund Optics | 58-608 | Used for calibrating the microscopes |
| FLEX-A-TOP FT-38 CAS | ESD Plastic Containers | FT-38-CAS | Used for storing spicules |
| Plastic Vial Bullseye Level | McMaster Carr | 2147A11 | Used for leveling the stage |
| Analytical Balance | Mettler Toledo | MS105DU | Used to mass calibration weights |
Referencias
- Wegst, U. G., Bai, H., Saiz, E., Tomsia, A. P., Ritchie, R. O. Bioinspired structural materials. Nat. Mater. 14 (1), 23-36 (2015).
- Meyers, M. A., McKittrick, J., Chen, P. Y. Structural biological materials: critical mechanics-materials connections. Science. 339 (6121), 773-779 (2013).
- Bodde, S. G., Meyers, M. A., McKittrick, J. Correlation of the mechanical and structural properties of cortical rachis keratin of rectrices of the Toco Toucan (Ramphastos toco). J. Mech. Behav. Biomed. Mater. 4 (5), 723-732 (2011).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. J. R. Soc. Interface. , (2012).
- Monn, M. A., Kesari, H. A new structure-property connection in the skeletal elements of the marine sponge Tethya aurantia that guards against buckling instability. Sci. Rep. 7, (2017).
- Monn, M. A., Weaver, J. C., Zhang, T., Aizenberg, J., Kesari, H. New functional insights into the internal architecture of the laminated anchor spicules of Euplectella aspergillum. Proc. Natl. Acad. Sci. U.S.A. 112 (16), 4976-4981 (2015).
- Monn, M. A., Kesari, H. Enhanced bending failure strain in biological glass fibers due to internal lamellar architecture. J. Mech. Behav. Biomed. Mater. , (2017).
- Levi, C., Barton, J. L., Guillemet, C., Bras, E., Lehuede, P. A remarkably strong natural glassy rod: the anchoring spicule of the Monorhaphis sponge. J. Mater. Sci. Letters. 8 (3), 337-339 (1989).
- Kesari, H., Doll, J. C., Pruitt, B. L., Cai, W., Lew, A. J. Role of surface roughness in hysteresis during adhesive elastic contact. Philos. Mag. Lett. 90 (12), 891-902 (2010).
- Croisier, F., et al. Mechanical testing of electrospun PCL fibers. Acta Biomater. 8 (1), 218-224 (2012).
- Haque, M. A., Saif, M. T. A review of MEMS-based microscale and nanoscale tensile and bending testing. Exp. Mech. 43 (3), 248-255 (2003).
- Gudlavalleti, S. . Mechanical testing of solid materials at the micro-scale. , (2002).
- Tohmyoh, H., Ishihara, M., Akanda, M. S., Yamaki, S., Watanabe, T., Iwabuchi, T. Accurate determination of the structural elasticity of human hair by a small-scale bending test. J. Biomech. 44 (16), 2833-2837 (2011).
- Waters, J. F. . Contact mechanics of biologically-inspired interface geometries. , (2009).
- Dai, Z., Gorb, S. N., Schwarz, U. Roughness-dependent friction force of the tarsal claw system in the beetle Pachnoda marginata (Coleoptera, Scarabaeidae). J. Exp. Biol. 205 (16), 2479-2488 (2002).
- Tramacere, F., Kovalev, A., Kleinteich, T., Gorb, S. N., Mazzolai, B. Structure and mechanical properties of Octopus vulgaris suckers. J. R. Soc. Interface. 11 (91), (2014).
- Ehrlich, H., et al. Nanostructural organization of naturally occurring composites: Part I. Silica-Collagen-based biocomposites. J. Nanomater. 53, (2008).
- Ehrlich, H., et al. Mineralization of the meter-long biosilica structures of glass sponges is templated on hydroxylated collagen. Nat. Chem. 2, 1084-1088 (2010).
- Ehrlich, H., et al. First evidence of the presence of chitin in skeletons of marine sponges. Part II. Glass sponges (Hexactinellida: Porifera). J. Exp. Zoo. 308 (4), 473-483 (2007).
- Ehrlich, H. Chitin and collagen as universal and alternative templates in biomineralization. Int. Geol Rev. 52, 661-699 (2010).
- Ehrlich, H., et al. Supercontinuum generation in naturally occurring glass sponge spicules. Adv. Opt. Mater. 4 (10), 1608-1613 (2016).
- Ehrlich, H., et al. Calcite reinforced silica-silica joints in the biocomposite skeleton of deep-sea glass sponges. Adv. Funct. Mater. 21, 3473-3481 (2011).
- Werner, P., Blumtritt, H., Zlotnikov, I., Graff, A., Dauphin, Y., Fratzl, P. Electron microscope analyses of the bio-silica basal spicule from the Monorhaphis chuni sponge. J. Struct. Biol. 191 (2), 165-174 (2015).
- Kolednik, O., Predan, J., Fischer, F. D., Fratzl, P. Bioinspired Design Criteria for Damage-Resistant Materials with Periodically Varying Microstructure. Adv. Funct. Mater. 21 (19), 3634-3641 (2011).
- Weaver, J. C., et al. Unifying design strategies in demosponge and hexactinellid skeletal systems. J. Adhes. 86 (1), 72-95 (2010).
- Walter, S. L., Flinn, B. D., Mayer, G. Mechanisms of toughening of a natural rigid composite. Mater. Sci. Eng. C. 27 (3), 570-574 (2007).
- Ehrlich, H. Silica biomineralization in Sponges. Encyclopedia of Geobiology. , 796-808 (2011).
- Zlotnikov, I., Werner, P., Fratzl, P., Zolotoyabko, E. Eshelby Twist as a possible source of lattice rotation in a perfectly ordered protein/silica structure grown by a simple organism. Small. 11 (42), 5636-5641 (2015).
- Zlotnikov, I., et al. A perfectly periodic three-dimensional protein/silica mesoporous structure produced by an organism. Adv. Mater. 26 (11), 1682-1687 (2014).
- Gere, J. M., Timoshenko, S. P. Chapter 5: Stresses in Beams. Mechanics of materials. , 205-217 (1997).
- Baratta, F. I., Matthews, W. T., Quinn, G. D. . Errors associated with flexure testing of brittle materials. , (1987).
- Quinn, G. D., Sparenberg, B. T., Koshy, P., Ives, L. K., Jahanmir, S., Arola, D. D. Flexural strength of ceramic and glass rods. J. Test. Eval. 37 (3), 1-23 (2009).
- Tattersall, H. G., Tappin, G. The work of fracture and its measurement in metals, ceramics and other materials. J. Mater. Sci. 1 (3), 296-301 (1966).

