Potentialisation des anticorps anticancéreux efficacité par les médicaments anticancéreux : détection des anticorps-médicament synergie à l’aide de l’équation d’indice de combinaison
Summary
Ce protocole décrit comment évaluer les synergies entre un anticorps anticancéreux et médicaments anticancéreux dans les modèles précliniques en utilisant l’équation d’indice de combinaison de Chou et Talalay.
Abstract
Potentialisation de l’hostile des anticorps monoclonaux (ACM) par des agents chimiothérapeutiques constitue une stratégie utile pour concevoir un traitement efficace et sûr contre le cancer. Ici, nous fournissons un protocole pour identifier une combinaison rationnelle à l’étape préclinique. Tout d’abord, nous décrivons un essai afin d’évaluer la synergie entre mAb anticancéreux et médicaments cytotoxiques, qui utilise l’équation d’indice de combinaison de Chou et Talalay1cellule. Cela inclut la mesure de tumeur médicament et anticorps-sensibilité cellulaire à l’aide d’un test MTT, suivi d’une analyse informatique automatisé pour calculer les valeurs d’index (CI) de combinaison. Les valeurs de CI de < 1 indiquent la synergie entre mAbs testés et agents cytotoxiques1. Pour corroborer l’in vitro résultats in vivo, nous décrivons plus loin une méthode pour évaluer l’efficacité de traitement de combinaison dans un modèle de xénogreffe de tumeur. Dans ce modèle, le schéma thérapeutique combiné retarde significativement la croissance tumorale, qui se traduit par une survie prolongée significative par comparaison monothérapie témoins. Ce qui est important, l’expérimentation in vivo révèle que le régime de la combinaison est bien toléré. Ce protocole permet l’évaluation efficace des combinaisons de médicaments anticancéreux dans les modèles précliniques et l’identification d’une combinaison rationnelle d’évaluer dans les essais cliniques.
Introduction
L’approche conventionnelle dans le traitement d’un grand nombre de différents types de cancer reposait en monothérapie. Même si elle est encore utilisée dans de nombreux cas, cette méthode rencontre plusieurs obstacles menant à opter pour des thérapies combinées2. En particulier, les cellules cancéreuses sont plus susceptibles de développer une résistance lorsque traités avec un médicament unique en induisant la survie alternative mécanismes3, entraînant un échec thérapeutique dans les patients4. En outre, en monothérapie, médicaments sont généralement administrés à fortes doses. Souvent, cette situation se traduit par l’apparition de forts effets secondaires de dose-dépendante pouvant être intolérable et forcer les médecins à arrêter le traitement2. Pour ces raisons, l’association de molécules anticancéreuses est désormais préféré à une monothérapie.
Combinaisons de médicaments idéal serait ceux qui agissent en synergie contre les cellules tumorales, sans toxicité accrue contre les cellules normales. Synergie se réfère à l’interaction de deux ou plusieurs médicaments qui produit un effet thérapeutique supérieur à la somme de chaque médicament agissant séparément. Ces interactions peuvent entraîner de meilleure efficacité thérapeutique clinique2. Il limite la résistance au traitement, augmente l’efficacité et permet également de réduire la toxicité2. En fait, la dose de chaque médicament peut être réduite pour diminuer leurs effets secondaires en ciblant les différentes voies. En outre, une des molécules peut servir aussi comme un agent sensibilisant contre les cellules cancéreuses. L’effet de la deuxième drogue peut encore être amélioré sur les cellules sensibilisées et dosages moins peuvent être utilisé5.
Thérapie combinée peut inclure deux ou plusieurs médicaments chimiothérapeutiques et/ou des produits biologiques, tels que les anticorps monoclonaux6. Ces mAbs ciblent spécifiquement les cellules exprimant un antigène de surface de cellules d’intérêt et sont capables de tuer les cellules tumorales par des voies immunologiques, y compris la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC), avec la participation de cellules effectrices immunitaire 7et6de la cytotoxicité dépendante du complément (CDC). Ils peuvent également agir par un mécanisme non immunologiques médié par apoptose8,9,10,11. Dans ce cas, l’induction du processus de mort cellulaire programmée peut sensibiliser les cellules cancéreuses, affaiblir leur fonction et accroître l’efficacité du médicament chimiothérapeutique associé à une posologie plus faible. Par conséquent, pro-apoptotique mAb sont de bons candidats pour la conception de schémas de combinaison avec des médicaments antinéoplasiques.
Différents modèles mathématiques ont été décrites pour évaluer la synergie de la drogue ; l’un d’eux repose sur la combinaison indice méthode1. Cette méthode repose sur le principe de la médiane-effet développé par Chou1. L’équation de la médiane-effet met en corrélation la dose de médicament et l’effet de la drogue comme suit.
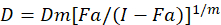
Ici, D est la dose de médicament ; DM est la dose médiane-effet ; Fa est la fraction affectée par la dose ; m est un exposant qui signifie la forme de la relation dose-effet tracé1. La dose médiane-effet est utilisée pour calculer la dose Dx d’un médicament qui inhibe ou tue «x» pour cent des cellules. La CI est ensuite calculée pour évaluer l’effet additif de la combinaison de médicaments, comme suit :1.
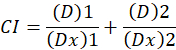
CI la valeur 1 indique un effet additif et la valeur CI 1 indique l’antagonisme1. L’application de cette méthode est facilitée par la disponibilité d’un programme d’ordinateur, CompuSyn, qui détermine la synergie et l’antagonisme à toutes les doses ou concentrations simulant automatiquement12.
Notre groupe a développé le mAb 8B6 spécifique pour O-acétyl-GD2 ganglioside (OAcGD2) neuroblastome antigène13 et encore démontré que cette mAb est capable d’induire la mort cellulaire avec les attributs de l’apoptose,11. Pour tester si mAb 8B6 peut sensibiliser les cellules de neuroblastome au topotécan agent antinéoplasique, nous avons adapté la méthode susmentionnée, développée par Chou1. Tout d’abord, nous déterminons les dose efficace 50 (ED50) valeurs mAb 8B6 et topotécan. Ensuite, les cellules de neuroblastome équipotentes ratios des deux composés selon ED50 valeurs sont exposées pour déterminer les valeurs de CI à l’aide du logiciel de simulation mentionnés ci-dessus. Cette méthode nous permet de démontrer la synergie entre mAb 8B6 et topotécan in vitro. Ensuite, les auteurs décrivent un protocole pour évaluer plus précisément la puissance et la sécurité de cette combinaison régime in vivo. Ce protocole peut être facilement appliqué pour sélectionner le mAb anticancéreux puissant et sûr et combinaisons agent chimiothérapeutique dans les études précliniques. Une représentation schématique de la présente étude est fournie à la Figure 1.
Protocol
Representative Results
Discussion
Pour prévoir l’effet des interactions médicamenteuses, trois méthodes peuvent être utilisées : la méthodologie d’isobologram17, le mélange non linéaire modèle18et la combinaison de l’index1. L’analyse d’index combinaison est le plus couramment utilisé parce que son application est simplifiée par l’existence d’un programme informatique facile à utiliser. À cette fin, nous avons d’abord caractérisé la réponse dose-effet…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Accorder un soutien : Fondation de Projet de L ‘Université de Nantes, les Bagouz » à Manon, La Ligue contre le Cancer comité de Loire-Atlantique, comité du Morbihan et comité de Vendée, une rose verser S.A.R.A.H, de L’Etoile de Martin et de la Société Française de Lutte contre les Les cancers et les leucémies de l’enfant et de l’adolescent (FSEA). M.B. et J.F. sont pris en charge par La Ligue Contre Le Cancer. Les auteurs remercient l’UTE-installation de la Structure Fédérative de Recherche Bonamy François. Les auteurs remercient également le Dr S. Suzin (Inserm, Paris) pour fournir les cellules IMR5 et Mme H. Estéphan pour son aide technique.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
Referencias
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Investigación sobre el cáncer. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Investigación sobre el cáncer. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

