Realização de espectroscopia em nanopartículas Plasmonicas com microscopia de contraste de interferência diferencial de tipo Nomarski baseado em transmissão
Summary
O objetivo deste protocolo é detalhar uma abordagem comprovada para a preparação de amostras de nanopartículas plasmonicas e para a realização de espectroscopia de partícula única neles com microscopia de contraste de interferência diferencial (DIC).
Abstract
A microscopia do contraste da interferência diferencial (DIC) é uma ferramenta poderosa da imagem latente que seja empregada a mais geralmente para objetos da microescala da imagem latente usando a luz da visível-escala. O objetivo deste protocolo é detalhar um método comprovado para a preparação de amostras de nanopartículas plasmonicas e realizar espectroscopia de partícula única neles com microscopia DIC. Várias etapas importantes devem ser seguidas cuidadosamente, a fim de realizar experimentos de espectroscopia repetível. Primeiro, os pontos de referência podem ser gravados no substrato da amostra, que auxilia na localização da superfície da amostra e no rastreamento da região de interesse durante os experimentos. Em seguida, o substrato deve ser devidamente limpo de detritos e contaminantes que podem de outra forma dificultar ou obscurecer o exame da amostra. Uma vez que uma amostra é preparada corretamente, o trajeto ótico do microscópio deve ser alinhado, usando a iluminação de Kohler. Com um microscópio padrão do estilo de Nomarski DIC, a rotação da amostra pode ser necessária, particular quando as nanopartículas plasmônicas exibem propriedades óticas orientação-dependentes. Porque a microscopia de DIC tem dois campos ortogonais inerentes da polarização, o padrão comprimento de onda-dependente do contraste de DIC revela a orientação de nanopartículas plasmônicas rod-shaped. Finalmente, a aquisição de dados e análises de dados devem ser cuidadosamente executadas. É comum representar dados de espectroscopia com base em DIC como um valor de contraste, mas também é possível apresentá-lo como dados de intensidade. Nesta demonstração de DIC para espectroscopia de partícula única, o foco está em nanopartículas de ouro esféricas e em forma de haste.
Introduction
Desde a década de 1980, a microscopia de contraste de interferência diferencial (DIC) tem sido largamente vista como um importante método de imagem reservado para objetos de microescala dentro das ciências biológicas. No entanto, durante o seu desenvolvimento na década de 1950 e 1960, foi concebido como uma técnica para a ciência dos materiais1. Com os avanços recentes nas ciências materiais relacionadas às nanopartículas plasmônicas, ocorreu um interesse aumentado na caracterização dos materiais com microscopia ótica.
Muitas técnicas ópticas estão certamente disponíveis para a caracterização nanomaterial (por exemplo, campo escuro, brightfield, luz polarizada, fluorescência, etc.). O campo escuro é amplamente popular na pesquisa da nanopartícula, mas confia unicamente na coleção do scatter e fornece a informação limitada sobre amostras complexas2. A fluorescência pode ser útil, mas somente com amostras que luminesce ou que podem corretamente ser manchadas. A microscopia de DIC tem diversos traços que o fazem uma ferramenta valiosa para a análise das nanopartículas. As vantagens mais frequentemente indicadas do DIC em comparação com outros métodos e em relação às nanopartículas plasmonicas são: nenhuma coloração da amostra exigida, nenhuns efeitos do Halo, profundidade de campo rasa, e definição lateral elevada3. DIC tem pontos fortes adicionais que são valiosos para a pesquisa de nanopartículas plasmônicas. Em primeiro lugar, dois campos de polarização inerente e ortogonal estão presentes, podendo ser medidos simultaneamente para fins de espectroscopia2. Em segundo lugar, o sinal depolarizado de nanopartículas não é capturado na imagem final2, que pode ser uma causa para a preocupação séria em medições de espectroscopia de campo escuro.
A finalidade deste artigo é fornecer uma metodologia desobstruída para utilizar a microscopia de Nomarski DIC da luz transmitida para executar a espectroscopia em nanopartículas plasmônicas. Embora DIC é uma técnica poderosa que pode ser aplicada a materiais altamente diversificados, é também uma técnica que requer grande habilidade e compreensão para operá-lo corretamente quando nanopartículas de imagem. A microscopia de Nomarski DIC baseada em transmissão tem um caminho de luz complexo1 que só será brevemente revisto aqui. O trem óptico de DIC é exibido na Figura 1. A luz é transmitida através do microscópio primeiramente sendo passada através de um polarizador e de um prisma de Nomarski da feixe-rachadura antes de ser focalizada pelo condensador no plano da amostra. Depois de passar pelo objetivo, a luz encontra um prisma de Nomarski feixe-combinando e um analisador antes de sair para o detector. Os dois polarizadores e prismas Nomarski são fundamentais para a formação da imagem DIC e são responsáveis pela produção de dois campos de polarização ortogonal do DIC1. Para o leitor interessado em saber mais sobre os princípios de funcionamento e o trajeto ótico de microscópios de Nomarski DIC, ou as diferenças entre Nomarski DIC e outros estilos de DIC, refira por favor outras contas bem escritas nestes tópicos1, 4. º , 5. º , 6 anos de , o 7.
É igualmente importante compreender a natureza básica das nanopartículas plasmonicas antes de tentar realizar espectroscopia neles, seja com Nomarski DIC, campo escuro ou qualquer outra técnica de microscopia. No campo da plasmómica, as nanopartículas são definidas como particulados com dimensões na escala de 10-100 nm8,9. As nanopartículas podem assumir muitas formas (por exemplo, esferas, hastes, estrelas, halteres, etc.), e a maioria de suas propriedades importantes surgem de interações com a luz na faixa infravermelha ultravioleta-visível-próxima do espectro eletromagnético. O termo “plasmonico” não se restringe a nanopartículas10; Entretanto, ao discutir nanopartículas, é usado na referência à ressonância de superfície localizada do Plasmon (LSPR). LSPR é um fenômeno em que os elétrons de condução em uma nanopartícula oscilam devido a uma interação Coulombic com radiação eletromagnética de uma faixa de freqüência altamente específica e relativamente estreita8. Nessas mesmas frequências, as nanopartículas plasmonicas exibem aumento da absorção e dispersão da luz, tornando-as observáveis com microscopia óptica. Em muitos casos, é preferível observar as nanopartículas ao colocar filtros de bandpass antes do condensador2, para melhorar o contraste de imagem e para eliminar a luz que não induz o efeito lspr. Usando filtros também torna possível realizar experimentos de espectroscopia de partícula única.
O comportamento óptico relacionado ao LSPR é altamente dependente do tamanho e da forma das nanopartículas, podendo ser investigado com muitas técnicas de microscopia óptica. No entanto, a fim de decifrar as informações de orientação de nanopartículas plasmonicas com uma forma anisotrópica (i.e., não esférica), é necessário utilizar a polarização do campo de luz. Ao girar cuidadosamente o campo de polarização ou o substrato da amostra em pequenos incrementos, é possível monitorar as propriedades espectroscópicas dependentes da orientação de nanopartículas individuais. A rotação e a polarização podem igualmente ajudar em determinar se uma característica espectral é devido a uma oscilação dipolar ou mais elevada da ordem dos elétrons de superfície da nanopartícula. No entanto, no caso de nanopartículas isotrópicas (i.e., esféricas), o perfil espectral permanece essencialmente inalterado ao girar a amostra luz polarizada.
Quando visualizado através de um microscópio DIC (Figura 2), as nanopartículas têm um disco arejado com uma aparência branca e preta projetada em sombra contra um fundo cinza. As nanopartículas esféricas conservarão esta aparência a rotação e com a mudança de filtros do bandpass; Entretanto, as partículas desvanecem-se gradualmente da vista porque o comprimento de onda central do filtro torna-se mais separado do comprimento de onda dipolar único11da esfera. A aparência de Nanorods pode mudar muito dramaticamente como eles são girados2. Os Nanorods têm duas bandas LSPR com comportamento dipolar, cuja localização é baseada nas dimensões físicas dos Nanorods. Quando o eixo longitudinal de um diamante é orientado paralelamente a um dos campos de polarização DIC, o disco arejado aparecerá todo branco ou preto, se visualizado com um filtro de passe associado a esse comprimento de onda lspr. Depois de girar a amostra 90 °, ele vai assumir a cor oposta. Alternativamente, uma vez que a linha central transversal de um diamante é perpendicular ao eixo longitudinal, a haste tomará na cor oposta ao comutar entre os filtros que combinam os comprimentos de onda de lspr para os dois machados. Em outras orientações e configurações de filtro, os Nanorods parecerá mais como esferas, apresentando uma variedade de padrões de disco arejados de sombra-Cast. Para Nanorods com um eixo transversal < 25 nanômetro, pode ser difícil detectar o sinal nesse comprimento de onda do LSPR usando a microscopia de DIC.
Para realizar a espectroscopia de partícula única, é importante usar os componentes ópticos corretos e alinhá-los corretamente. Um objetivo capaz da microscopia de DIC deve ser usado. Para experimentos de partículas únicas, os objetivos do óleo 80x ou 100x são ideais. Os prismas de Nomarski DIC ordinariamente vêm em três variedades: padrão, alto contraste, e alta resolução. O tipo ideal depende altamente da finalidade do experimento e do tamanho das nanopartículas. Prismas padrão são bons para muitos experimentos; Mas ao trabalhar com nanopartículas menores (< 50 nm), os prismas de alto contraste podem ser benéficos, pois o contraste de partículas diminui à medida que as partículas diminuem no tamanho11. Ajustar o contraste de DIC é conseguido girando um polarizador ou traduzindo um dos prismas de DIC, dependendo da marca do microscópio ou do modelo6.
Depois de definir a iluminação Kohler e as configurações de polarizador, é fundamental não reajustar essas configurações ao coletar dados de espectroscopia. Além disso, um sinal de fundo médio constante deve ser mantido em todos os momentos durante a coleta de dados, mesmo quando se alterna entre filtros e configurações angulares. O valor de fundo ideal real depende da faixa dinâmica da câmera científica, mas em geral, o fundo deve estar no intervalo de 15% – 40% do nível máximo de detecção da câmera. Isso reduz a probabilidade de saturar o sensor da câmera, permitindo o contraste de partículas ideal. Para coletar dados de espectroscopia, é necessário trabalhar com uma câmera científica que capture imagens em preto e branco, em oposição a uma câmera colorida.
A preparação da amostra é outro aspecto crítico das nanopartículas plasmonicas de imagem. É imperativo que os operadores da microscopia DIC tenham uma compreensão das propriedades ópticas da amostra e do substrato da amostra. O vidro do microscópio “pre-limpado” não é preparado suficientemente para nanopartículas da imagem latente, e deve corretamente ser re-limpada antes da deposição da amostra para assegurar a observação desobstruída da amostra. Muitos protocolos da limpeza para corrediças do microscópio foram documentados previamente12, mas não é uma etapa que seja relatada normalmente em estudos experimentais.
Finalmente, os métodos de análise de dados são o componente final para a espectroscopia de partícula única. As intensidades máximas e mínimas para cada nanopartícula devem ser medidas, bem como a média de fundo local. As partículas de interesse devem estar localizadas em áreas sem detritos de fundo, defeitos de substrato ou iluminação irregular. Um método para determinar o perfil espectral de uma nanopartícula é calcular o contraste de partículas em cada comprimento de onda, utilizando a equação abaixo de11,13,14,15:
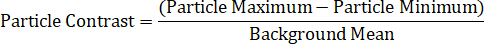
Alternativamente, o espectro de uma única partícula pode ser dividido em seus componentes máximos e mínimos individuais do sinal, que representam os dois campos da polarização de DIC, assim exibindo os dois espectros direccionalmente-dependentes simultaneamente-recolhidos, através das duas equações:
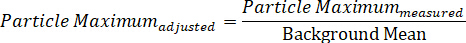
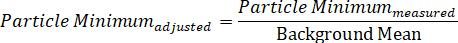
Protocol
Representative Results
Discussion
Quando a imagem latente com microscopia de DIC, é crítico aperfeiçoar os componentes óticos antes de coletar dados. Mesmo pequenos ajustes para o polarizador no meio de um experimento podem resultar em impactos significativos para os dados finais6. Além disso, os materiais diferentes exigem ajustes diferentes do polarizador. Embora os tamanhos grandes da etapa fossem utilizados aqui para demonstrar o efeito do ângulo da polarização, em um experimento real, é imperativo aperfeiçoar o ajus…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Dr. Anthony S. Stender deseja reconhecer o apoio técnico através do nanoscale e Quantum fenômenos Institute (NQPI) na Universidade de Ohio. Este artigo foi tornado possível com o financiamento do start-up fornecido ao Dr. Stender pela Universidade de Ohio.
Materials
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
Referencias
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That’s Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. . Plasmonics: Fundamentals and Applications. , (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).

