幼児期の昼寝中の睡眠依存性記憶統合の基礎となる神経機構の測定
Summary
このプロトコルは、幼児期の昼寝中に睡眠依存性メモリ統合の基礎となる神経機構を調べるために使用される方法について説明する。これは、行動記憶のパフォーマンスに睡眠の効果を調べるための手順だけでなく、ポリソムノグラフィーとアクティグラフィーの両方のアプリケーションと記録が含まれています。
Abstract
睡眠は毎日の機能に不可欠です。睡眠の重要な機能の1つは、記憶の統合、それらを強くし、干渉に対して脆弱にするプロセスです。記憶のための睡眠の利点の基礎となる神経機構は、ポリソムノグラフィー(PSG)を使用して調査することができる。PSGは、脳からの信号(EEG)、眼(EOG)、および睡眠段階を分類するために使用される筋肉(EMG)を含む生理学的記録の組み合わせである。このプロトコルでは、PSGを行動記憶評価、アクティグラフィー、および親レポートと組み合わせて使用して、睡眠依存型メモリの統合を調べる方法について説明します。このプロトコルの焦点は、幼児期に焦点を当てています, 子供が二葉性睡眠(昼寝と一晩の睡眠からなる)から単葉睡眠(一晩の睡眠のみ)に移行する重要な期間です。睡眠がメモリパフォーマンスに及ぼす影響は、睡眠と覚醒休息の期間にわたって、目視空間記憶評価を使用して測定されます。アクティグラフィーと親レポートの組み合わせは、睡眠リズムを評価するために使用されます(すなわち、子供を習慣的または非習慣的なナッパーとして特徴付ける)。最後に、PSGは昼寝中にそれらの段階(周波数やスピンドルの存在など)の睡眠段階と資質を特徴付けるために使用されます。PSGを使用する利点は、それが現在、睡眠の質と睡眠アーキテクチャを評価するために利用可能な唯一のツールであり、メモリの統合をサポートする関連する脳の状態を指しています。PSGの主な制限は、録音モンタージュの準備にかかる時間の長さと、録音は通常、購入した1つの睡眠を介して引き継がれているです。これらの制限は、アプリケーション中に気を散らすタスクに若い参加者を従事させ、睡眠サイクルを特徴付けるために活動学と自己/親レポート対策とPSGを組み合わせることによって克服することができます。一緒に、方法のこのユニークな組み合わせは、昼寝が就学前の子供の学習をサポートする方法の調査を可能にします。
Introduction
私たちの毎日のルーチンで睡眠の有病率を考えると、その機能を理解することが重要です。この目的を持つ研究は、睡眠の正確な測定を必要とします。ポリソムノグラフィー(PSG)は、睡眠のゴールドスタンダード尺度です。PSGは高い時間分解能の睡眠の客観的、定量的な測定を可能にし、研究および臨床目的の両方のために有用でありうる。PSGは生理学的記録の組み合わせである。少なくとも、PSGモンタージュには、脳波検査(EEG)、電気学(EOG)、筋電図(EMG)が含まれます。これらの測定は、それぞれ脳、目、筋肉からの電位を評価し、睡眠段階の分類を可能にする(図1参照)。心電図(ECG)、呼吸、脈拍酸化測定などの他の手段は、障害のある睡眠の存在を識別するために含まれてもよい。
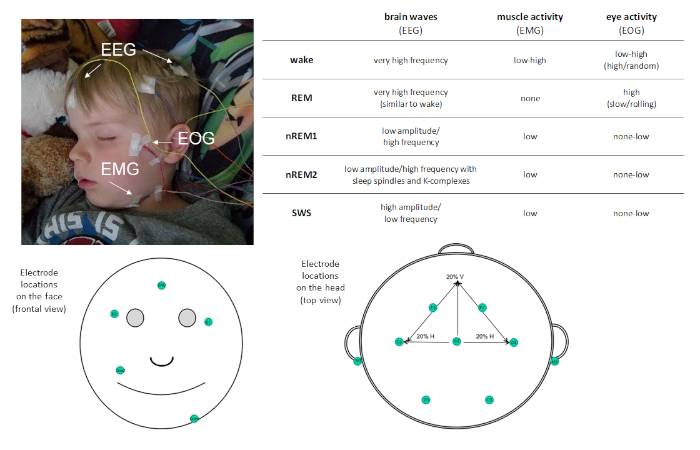
図1:例の電極配置とPSGを介して記録された活動の説明。この図のより大きなバージョンを表示するには、ここをクリックしてください。
PSGは、睡眠を4つの異なる睡眠段階に特徴付けることを可能にする:非急速眼球運動(非レム1)ステージ1(nREM1;4−7 Hz)、非レムステージ2(nREM2;12−15 Hz)、および非REMステージ3(より一般的にスローウェーブスリープ[SWS];0.5−4Hz)、および急速な眼球運動(REM)。)睡眠。nREM1は睡眠発症をマークし、EMGリコーディングにおける筋緊張の低下と、安静時覚醒で観察されるアルファに対する混合振幅EEG振動に基づいて同定される。その後、睡眠スピンドル(シグマ周波数活性の短いバースト、11−16 Hz)とK複合体(周囲の活動から目立つ単一の遅波)の存在によって区別することができるnREM2が続きます。SWSは、異なる低速周波数高振幅EEG振動によって特徴付けされる。レム睡眠は、覚醒中に観察されるのと非常によく似た高速低振幅振動脳活動によって特徴付けられます。しかし、レム睡眠と覚醒を区別するのは、ファシックな急速な眼球運動(したがってモニカーレム)と筋肉アトニアによっても特徴付けられる。睡眠の試合の過程で、睡眠段階は周期的に経験され、約90分/サイクルの割合で。
睡眠はまた、24時間のサイクルで行われる睡眠の試合で、概日リズムに従います。睡眠のタイミングと一貫性は、睡眠機能に影響を与える可能性があり、評価することも重要です。PSGは睡眠段階を特徴付ける必要がありますが、適用には時間がかかるため、複数の睡眠の試合(例えば、複数の睡眠、昼寝、一晩の睡眠)を評価するのに理想的ではありません。このために、アクティグラフィーは有益です。アクティグラフィーは、通常手首に三軸加速度計を使用して、運動の不在に基づいて睡眠を推定します。アクティグラフィーは睡眠段階を特徴付けるために使用することはできませんが、乳幼児1から高齢者2までの集団の範囲で睡眠発症および覚醒発症(睡眠の断片化または睡眠発症後の覚醒を含む)を検出する上で信頼できないことが示されています。.PSGとアクティグラフィーの両方が、自己/親レポートの測定よりも好ましい方法です。自己/親レポート対策は管理が容易で比較的安価ですが、バイアスやコンプライアンス違反の影響も受けます。最後に、これらの方法は、それぞれの強みを活用するために組み合わせて使用できることに注目してください。例えば、PSGはアクティグラフィーや自己/親レポートと組み合わせることで、一晩の睡眠の質だけでなく、睡眠量や睡眠覚醒サイクルの検証、特に長期間(週または数ヶ月)の両方を得ることができます。
特に関心を集めている睡眠の機能の1つは、睡眠依存型のメモリの統合であり、それらが強く、干渉に対して脆弱なままにする記憶の処理3である。記憶の統合は、子供4と大人5の覚醒中に行うことができますが、睡眠中に統合が強化されるという実質的な証拠があります。過去の研究では、睡眠間隔(例えば、午後8時~8時)に続くメモリ性能の変化と、目覚めた同等の間隔(例えば、午前8時~午後)に対する変化を比較することにより、睡眠依存型メモリ統合の行動例を提供してきました。成人では、記憶は睡眠の間隔に続いて6または7を保護され、一方、記憶は通常、覚醒の同等の間隔にわたって崩壊する。概日影響8、9、10からパフォーマンスの変化を解離するコントロールが採用されています。たとえば、昼寝中のパフォーマンスを同等の昼間の覚醒期間9と比較する場合、睡眠の同様の利点が観察されます。
睡眠はかつて受動的なプロセスを反映すると考えられていたが、単に腐敗や干渉から記憶を保護する、現代の理論は、睡眠がより積極的な役割を果たし、実際に再活性化を通じて記憶を促進することを示唆している11,12、13.このサポートは、睡眠中の記憶統合の行動測定(睡眠前と比較した睡眠後の記憶リコールの変化)と睡眠生理学の特定の側面との間の観察された相関関係から来る。多くの宣言型メモリ タスクでは、メモリの統合は、非 REM スリープの側面、特に nREM2 および SWS で見つかった SWS または睡眠スピンドルの測定に関連付けられています。睡眠の役割が干渉からの受動的な保護である場合、そのような相関関係は期待されません。むしろ(睡眠段階に関係なく)睡眠時間とパフォーマンスの間の相関関係は、より多くの時間が干渉14からより多くの保護を提供するように、期待されます。
メモリ統合における SWS のアクティブな役割に対する追加のサポートは、ターゲット メモリの再アクティブ化の研究で明らかです。これらの研究では、記憶は知覚的な手がかり、例えば臭気の文脈で学習され、睡眠中にキューが再提示された場合、記憶の記憶は、特に15の後に記憶の記憶が大きくなる。根本的なメカニズムは16、17、1つの著名な理論、システム統合理論が議論されているが、海馬にコードされた記憶は海馬と新生物の対話にもかかわらず皮質で安定していると主張する。具体的には、皮質遅い波と睡眠紡錘は、記憶再活性化に関連する海馬波紋と共に起こり、メモリ転送3をサポートする。
開発中のメモリ統合における睡眠の役割はあまり明確ではありません。幼児期は、子供たちが二葉病(昼寝と一晩の睡眠の試合からなる)から単一の睡眠パターンに移行し始めるにつれて、特に関心のある期間です。最近の研究は、この遷移が脳の成熟を反映するかもしれないことを示唆しています18.この議論は、一晩の睡眠における発達的変化(すなわち、遅波活動の地形)が皮質成熟19のそれを反映する経験的データと一致する。
20、21、幼児22の子供の一晩睡眠依存的統合のいくつかの行動デモンストレーションがありますが、昼間の睡眠との記憶統合の神経基盤に関する研究は、調査を始めたばかりです。就学前の子供の記憶に対する昼間の昼寝の役割を調べる画期的な研究では、最近学んだ情報の記憶を保護するために昼寝が示されたのに対し、記憶力は減少した(約12%)。子供たちが昼寝間隔23の間に目を覚ましていたとき.この「昼寝の利益」は、年齢に関係なく、習慣的に昼寝をした小児(すなわち、週に5回以上、行動性で測定される)で最も大きかった。昼寝中にPSGを記録することにより、昼寝期間中のメモリ性能の変化は、睡眠スピンドル密度(nREMの1分あたりの睡眠スピンドル数)に特異的に関連していることが判明し、昼寝の質(量ではない)が重要な要因であったメモリ保持の促進を促進します (代表的な結果セクションを参照)。
本研究は、開発中の睡眠と記憶の関係を探求する際のPSGの意義を強調する。これは、メモリ統合のための昼寝中に睡眠マクロ(睡眠段階)とマイクロ(周波数やスピンドルの存在などのそれらの段階の質)構造を特徴付ける重要性を指摘する。また、睡眠リズムを評価することの重要性を強調しています (子供を習慣的または非習慣的なナッパーとして特徴付けます)。私たちの研究は、視空間学習(そして最近では感情的な24と手続き25学習)における昼寝の機能を特徴としていますが、多くの疑問が残っています。例えば、これらの知見の一般化性を評価し、就学前の教室で使用されるタスクを評価して、特定のパラメータ(例えば、学習に対する昼寝の利益の量)を理解するために、他の宣言的なメモリタスクを調べることが重要です。生態学的に有効なタスク。また、メモリの統合にウェイクで十分なタイミングを理解するために追加の作業も必要です。したがって、我々の目的は、子供の睡眠と睡眠依存性記憶の統合を測定するプロセスを解明することです。私たちは、コンピュータ化された空間記憶タスクを使用して、一般的に発達中の未就学児(約3~4歳)の宣言的な記憶に対する午後の昼寝の利点を調べるための実用的なヒントと、昼寝の習慣性を評価するための方法を提供します。PSGを使用してアクティグラフィー、親レポート、および昼寝生理学を使用しています。これらの方法は、様々な頻度で昼寝をする就学前の子供のために開発されたが、これらの方法は、任意の年齢層に適応することができる。
Protocol
Representative Results
Discussion
この記事では、幼児期の昼寝中の宣言型メモリの睡眠依存的な統合を調査する方法について説明します。方法には、昼寝と覚醒状態全体のメモリの行動評価、睡眠サイクルを評価するアクティグラフィーと親レポート、睡眠アーキテクチャを評価するPSGが含まれます。このユニークな組み合わせは、メモリを評価し、睡眠サイクルを特徴付け、メモリ上の睡眠の利点の基礎となる神経機構を?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
著者らは、メリーランド大学の神経認知発達研究所、カレッジパーク、マサチューセッツ大学のソムニューロ研究所に感謝したいと思います。資金は、NIH(HD094758)とNSF(BCS 1749280)からTRおよびRSに提供されました。代表的な結果はNIH HL111695によって資金提供された。
Materials
| Actiwatch Spectrum Plus Starter Kit | Philips Respironics | 1109516 | Includes: Actiwatch Spectrum Plus Device, Actiware Software License, and manual |
| Actiware software | Philips Respironics | 1114828 | Alternatives may be available. |
| Brain Analyzer | Brain Products | BV-BP-170-1000 | Alternatives may be available. |
| Dell Latitude 5580 Laptop | Dell | X5580T [210-AKJR] | Laptop for running MatLab, Actiware, and RemLogic as well as storing/uploading data |
| EC2 cream | Grass | 12643 | Possible alternatives include Ten20 paste and Lic2 electride cream |
| Embla REMLogic software | Natus Medical Inc. | 21475 | Alternatives may be available. |
| Embletta MPR PG Sys – XR – US | Natus Medical Inc. | 12077 | Embletta system for PSG recordings |
| Embletta MPR ST + Proxy Kit | Natus Medical Inc. | 12696 | Attachment to Embletta to record PSG sensors |
| Nuprep cleaning solution | Natus Medical Inc. | 12643 | Possible alternatives may be available. |
| Sleep Supplies Starter Kit for Embletta MPR ST/ST + Proxy | Natus Medical Inc. | 12643 | Started kit for sleeping including guaze, EC2 cream, NuPrep cleaning solution, cotton swabs and more. |
Referencias
- Sadeh, A., Acebo, C., Seifer, R., Aytur, S., Carskadon, M. A. Activity-based assessment of sleep-wake patterns during the 1st year of life. Infant Behavioral Development. 18 (3), 329-337 (1998).
- Sadeh, A., Urbach, D., Lavie, P. Actigraphically-based automatic bedtime sleep-wake scoring: Validity and clinical applications. Journal Ambulatory Monitoring. 2 (3), 209-216 (1989).
- Rasch, B., Born, J. About sleep’s role in memory. Physiological Reviews. 93, 681-766 (2013).
- Werchan, D. M., Gómez, R. L. Wakefulness (not sleep) promotes generalization of word learning in 2.5-year-old children. Child Development. 85 (2), 429-436 (2014).
- Wang, J. Y., Weber, F. D., Zinke, K., Inostroza, M., Born, J. More effective consolidation of episodic long-term memory in children than adults-unrelated to sleep. Child Development. 89 (5), 1720-1734 (2018).
- Sonni, A., Spencer, R. M. C. Sleep protects memories from interference in older adults. Neurobiology of Aging. 36 (7), 2272-2281 (2015).
- Marshall, L., Helgadóttir, H., Mölle, M., Born, J. Boosting slow oscillations during sleep potentiates memory. Nature. 444 (7119), 610-613 (2006).
- Baran, B., Wilson, J., Spencer, R. M. C. REM-dependent repair of competitive memory suppression. Experimental Brain Research. 203 (2), 471-477 (2010).
- Diekelmann, S., Born, J. The memory function of sleep. Nature Reviews Neuroscience. 11 (2), 114-126 (2010).
- Stickgold, R. Sleep dependent memory consolidation. Nature. 437 (27), 1272-1278 (2005).
- Dudai, Y., Karni, A., Born, J. The consolidation and transformation of memory. Neuron. 88 (1), 20-32 (2010).
- Feld, G. B., Born, J. Sculpting memory during sleep: concurrent consolidation and forgetting. Current Opinion in Neurobiology. 44, 20-27 (2017).
- Staresina, B. P., et al. Hierarchical nesting of slow oscillations, spindles and ripples in the human hippocampus during sleep. Nature Neuroscience. 18 (11), 1679-1686 (2015).
- Ellenbogen, J. M., Payne, J. D., Stickgold, R. The role of sleep in declarative memory consolidation: passive, permissive, active or none?. Current Opinion Neurobiology. 16 (6), 716-722 (2006).
- Oudiette, D., Paller, K. A. Upgrading the sleeping brain with targeted memory reactivation. Trends in Cognitive Sciences. 17 (3), 142-149 (2013).
- Yonelinas, A. P., Ranganath, C., Ekstrom, A. D., Wiltgen, B. J. A contextual binding theory of episodic memory: systems consolidation reconsidered. Nature Reviews Neuroscience. 20, 364-375 (2019).
- Antony, J. W., Schapiro, A. C. Active and effective replay: systems consolidation reconsidered again. Nature Reviews Neuroscience. , (2019).
- Lam, J., Mahone, E. M., Mason, T., Scharf, S. M. The effects of napping on cognitive function in preschoolers. Journal of Developmental & Behavioral Pediatrics. 32 (2), 90-97 (2011).
- Kurth, S., Ringli, M., Geiger, A., Lebourgeois, M., Jenni, O. G., Huber, R. High-density sleep electroencephalogram study. Journal of Neuroscience. 30 (40), 13211-13219 (2010).
- Backhaus, J., Hoeckesfeld, R., Born, J., Hohagen, F., Junghanns, K. Immediate as well as delayed post learning sleep but not wakefulness enhances declarative memory consolidation in children. Neurobiology of Learning and Memory. 89 (1), 76-80 (2008).
- Wilhelm, I., Diekelmann, S., Born, J. Sleep in children improves memory performance on declarative but not procedural tasks TT – Bei Kindern verbessert Schlaf die Gedächtnisleistung für deklarative aber nicht für prozedurale Aufgaben. Learning and Memory. 15 (5), 373-377 (2008).
- Seehagen, S., Konrad, C., Herbert, J. S., Schneider, S. Timely sleep facilitates declarative memory consolidation in infants. Proceedings of the National Academy of Sciences. 112 (5), 1625-1629 (2015).
- Kurdziel, L., Duclos, K., Spencer, R. M. C. Sleep spindles in midday naps enhance learning in preschool children. Proceedings of the National Academy of the Sciences of the United States of America. 110 (43), 17267-17272 (2013).
- Kurdziel, L. B. F., Kent, J., Spencer, R. M. C. Sleep-dependent enhancement of emotional memory in early childhood. Scientific Reports. 8 (12609), 1-10 (2018).
- Desrochers, P. C., Kurdziel, L. B. F., Spencer, R. M. C. Delayed benefit of naps on motor learning in preschool children. Experimental Brain Research. 234 (3), 763-772 (2016).
- Maldonado, C. C., Bentley, A. J., Mitchell, D. A pictorial sleepiness scale based on cartoon faces. Sleep. 27 (3), 541-548 (2004).
- Stern, R. A., Arruda, J. E., Hooper, C. R., Wolfner, G. D., Morey, C. E. Visual analogue mood scales to measure internal mood state in neurologically impaired patients: Description and initial validity evidence. Aphasiology. 11 (1), 59-71 (1997).
- Plihal, W., Born, J. Effects of early and late nocturnal sleep on indicators of procedural and declarative memory. Journal of Cognitive Neuroscience. 9 (4), 534-547 (1997).
- Donohue, K. C., Spencer, R. M. C. Continuous re-exposure to environmental sound cues during sleep does not improve memory for semantically unrelated word pairs. Journal of Cognitive Education and Psychology. 10 (2), 167-177 (2015).
- Wilson, J. K., Baran, B., Pace-Schott, E. F., Ivry, R. B., Spencer, R. M. C. Sleep modulates word-pair learning but not motor sequence learning in healthy older adults. Neurobiology of Aging. 33 (5), 991-1000 (2012).
- Wamsley, E. J., et al. Reduced sleep spindles and spindle coherence in schizophrenia: Mechanisms of impaired memory consolidation?. Biological Psychiatry. 71 (2), 154-161 (2012).
- Mölle, M., Bergmann, T. O., Marshall, L., Born, J. Fast and slow spindles during the sleep slow oscillation: Disparate coalescence and engagement in memory processing. Sleep. 34 (10), 1411-1421 (2011).
- Acebo, C., et al. Sleep/wake patterns derived from activity monitoring and maternal report for healthy 1- to 5-year-old children. Sleep. 28 (12), 1568-1577 (2005).
- Acebo, C., et al. Estimating sleep patterns with activity monitoring in children and adolescents: How many nights are necessary for reliable measures?. Sleep. 22 (1), 95-103 (1999).
- Geiger, A., et al. The sleep EEG as a marker of intellectual ability in school age children. Sleep. 34 (2), 181-189 (2011).
- Wagner, U., Gais, S., Born, J. Emotional memory formation is enhanced across sleep intervals with high amounts of rapid eye movement sleep. Learning and Memory. 8, 112-119 (2001).
- Gómez, R. L., Bootzin, R. R., Nadel, L. Naps promote abstraction in language-learning infants. Psychological Science. 17 (8), 670-674 (2006).
- Konrad, C., Herbert, J. S., Schneider, S., Seehagen, S. Gist extraction and sleep in 12-month-old infants. Neurobiology of Learning and Memory. 134, 216-220 (2016).

