Decifrare gli effetti strutturali dell'attivazione delle mutazioni somatiche EGFR con la simulazione della dinamica molecolare
Summary
L’obiettivo di questo protocollo è quello di utilizzare simulazioni di dinamica molecolare per esaminare i cambiamenti strutturali dinamici che si verificano a causa dell’attivazione delle mutazioni della proteina chinasi EGFR.
Abstract
Numerose mutazioni somatiche che si verificano nella famiglia del recettore del fattore di crescita epidermico (EGFR) della chinasi della tirosina recettore (RTK) sono state segnalate da pazienti oncologici, anche se relativamente pochi sono stati testati e hanno dimostrato di causare cambiamenti funzionali negli ErbB. I recettori ErbB sono dimerizzati e attivati al momento del legame del ligando, e i cambiamenti conformazionali dinamici dei recettori sono inerenti all’induzione della segnalazione a valle. Per due mutazioni mostrate sperimentalmente per alterare la funzione EGFR, A702V e la mutazione di delezione ELREA750 di746,illustremo nel seguente protocollo come le simulazioni di dinamica molecolare (MD) possono sondare la (1) stabilità conformazionale della struttura della chinasi della tirosina mutante rispetto all’EGFR di tipo selvatico; (2) conseguenze strutturali e transizioni conformazionali e il loro rapporto con i cambiamenti funzionali osservati; (3) effetti delle mutazioni sulla forza dell’ATP vincolante e per il legame tra i domini della chinasi nel dimer asimmetrico attivato; e (4) effetti delle mutazioni sulle interazioni chiave all’interno del sito di legame EGFR associato all’enzima attivato. Il protocollo fornisce una procedura dettagliata passo-passo e una guida che può essere più generalmente utile per lo studio delle strutture proteiche utilizzando simulazioni MD come mezzo per sondare la dinamica strutturale e la relazione con la funzione biologica.
Introduction
Il recettore del fattore di crescita epidermico umano (EGFR) famiglia (ErbB) di recettori tirorosina chinasi (RTKs) comprende quattro membri – EGFR/ErbB1/HER1, ErbB2/HER2, ErbB3/HER3 e ErbB4/HER4. I recettori ErbB regolano i processi cellulari fondamentali come la crescita e la proliferazione delle cellule, la differenziazione, la migrazione e lasopravvivenza 1,2, e sono quindi potenti proto-oncogeni. L’attività aberrante dei recettori ErbB, in particolare EGFR ed ErbB2, è stata spesso associata a tumori umani che hanno reso i recettori ErbB obiettivi chiave per le terapie oncologiche2,3.
Diverse alterazioni somatiche dei geni ERBB sono state segnalate da neoplasie umane3,4,5. Gli esempi più caratterizzati includono le mutazioni ricorrenti, che attivano i punti e le brevi delezioni in-frame nel dominio della chinasi EGFR nel cancro del polmone non a piccole cellule (NSCLC). Queste mutazioni EGFR rappresentano i fattori chiave della crescita del cancro e predicono la sensibilità ai farmaciantitumoreEGFR mirati 6,7,8. Tuttavia, nella maggior parte dei tumori, le mutazioni somatiche nell’EGFR si verificano al di fuori di questi “hotspot” ricorrenti e sono distribuite nell’intera durata del recettore con 1210 residui. Infatti, la maggior parte dei residui lungo la sequenza primaria EGFR sono stati trovati per essere mutato nel cancro umano9. Tuttavia, a parte i pochi punti caldi, il significato funzionale della stragrande maggioranza delle mutazioni EGFR associate al cancro rimane sconosciuto.
La struttura monomeccatica degli ErbB è costituita da un grande dominio extracellulare amino terminale, seguito da una singola elica transmembrana che conduce al dominio della chinasi della tirosina intracellulare e alla regione della coda C-terminal che contiene siti di attracco per le proteine di segnalazione intracellulari. L’associazione Ligand innesca un drammatico cambiamento conformazionale nel dominio extracellulare, che facilita la formazione dei dimer del recettore esponendo i bracci di dimerizzazione che si incrociano simmetricamente e interagiscono con le loro superfici aromatiche/idrofobiche. Sulla formazione del recettore dei dimer i domini della tirosina chinasi entrano in contatto asimmetrico (Figura 1), con conseguente attivazione delle chinasi che fosforilate le code C-terminali dei monomeri recettori, e successivamente in attivazione della segnalazione a valle10,11.
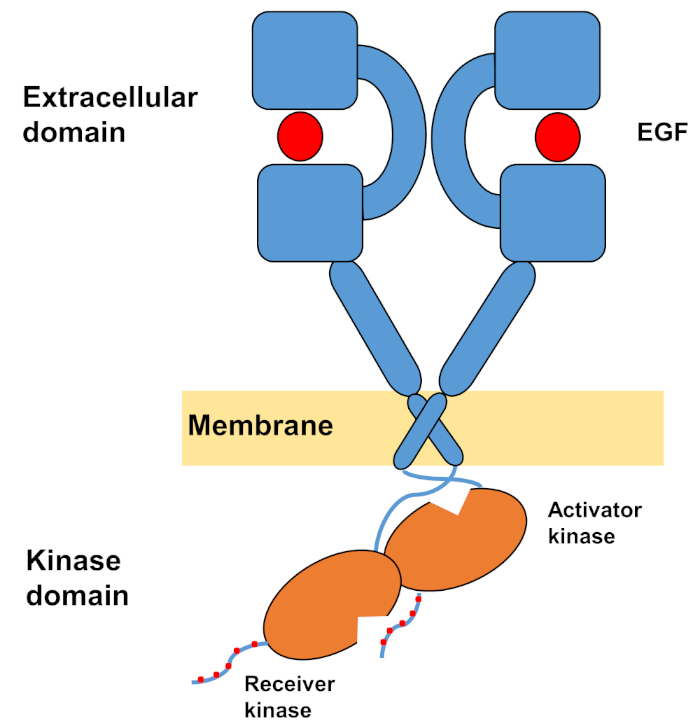
Figura 1: Struttura del dimer EGFR. EGFR si dimezza quando i domini extracellulari legano il fattore di crescita (EGF, fattore di crescita epidermico). Il dominio della chinasi del ricevitore viene quindi attivato attraverso l’interazione asimmetrica con il dominio chinasi dell’attivatore, e le code del terminale C sono autofosforilate a residui di tirosina (modificato da Tamirat et al.12). Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
A causa dei riarrangiamenti strutturali dinamici che si verificano durante 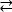 le transizioni del dimero monomero, insieme all’attivazione della chinasi associata alla formazione di un dimer asimmetrico, le mutazioni lungo l’intera lunghezza della struttura del recettore possono potenzialmente avere un effetto sulla funzione del recettore. Qui descriviamo diversi esempi dei nostri studi precedenti in cui la modellazione della mutazione e della visualizzazione erano sufficienti a spiegare le conseguenze per la funzione.
le transizioni del dimero monomero, insieme all’attivazione della chinasi associata alla formazione di un dimer asimmetrico, le mutazioni lungo l’intera lunghezza della struttura del recettore possono potenzialmente avere un effetto sulla funzione del recettore. Qui descriviamo diversi esempi dei nostri studi precedenti in cui la modellazione della mutazione e della visualizzazione erano sufficienti a spiegare le conseguenze per la funzione.
Esempio 1: Una mutazione riportata, D595V in ErbB413, ha portato ad una maggiore dimerizzazione ErbB4 e fosforilazione14. La visualizzazione della posizione della mutazione è stato un fattore critico per comprendere gli effetti funzionali osservati: D595V si è verificato al crossover simmetrico dei bracci dimerici dell’ectodomain (Figura 2A). Le braccia sono in gran parte aromatiche e idrofobiche, e la sostituzione dell’acido aspartico polare con valine dovrebbe aumentare le interazioni idrofobiche “appiccicose”, stabilizzando il dimer e quindi aumentare la lunghezza del tempo in cui avviene la fosforilazione14. All’inizio è stata una sorpresa trovare l’aspartate in ogni braccio, ma in retrospettiva si potrebbe pensare ad esso come un meccanismo di temporizzazione per l’attività, dove le catene laterali dell’acido polare riducono l’affinità e la durata del dimero intatto e quindi limitano la fosforilazione mediata dalla chinasi e la segnalazione. La sostituzione con valine rimuoverebbe quindi questa salvaguardia stabilizzando ulteriormente il dimerE ErbB4.
Figura 2: Posizione di una mutazione e mutazioni che attivano e di attivare la chinasi. (A) D595 (attivazione della mutazione D595V) si trova sui bracci dimerici aromatici/idrofobici del modello ectodomain ErbB4; le armi si associano al legame del fattore di crescita; (i residui vicini sono mostrati come bastoni). (B) In ErbB4, G802 (mutazione inattiva G802dup) aiuta a formare la tasca di legame intorno all’anello di adenina di ATP e D861 catalitico (mutazione D861Y inattiva) lega sia Mg2 (non mostrato) e il gruppo γ-fosfato di ATP. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Esempio 2: Si potrebbe prevedere che le mutazioni somatiche che prendono di mira il sito di legame ATP del dominio della chinasi altererebbero o eliminerebbero l’attività ezimatica che porta a un recettore alterato o morto in chinasi incapace di segnalare. Delle nove mutazioni segnalate da pazienti con seno, gastrico, colorettale o NSCLC15, due delle nove mutazioni al momento del test avevano un’attività di fosforilazionealtamente diminuita 16: G802dup (G → GG) e D861Y. Entrambe le mutazioni somatiche inattivanti sono state trovate all’interno del sito di legame ATP della struttura di dominio della chinasi della tirosina(Figura 2B): la glicina flessibile, duplicata, altererebbe il sito dell’anello di adenina e il piccolo acido aspartico sostituito dalla tirosina ingombrante vicino ai fosfati terminali impedirebbe fisicamente la legatura di Mg2-ATP. Tuttavia, dal momento che ErbB4 può formare un eterodimero con ErbB2 – ErbB2 non lega un fattore di crescita e dipende dall’associazione con un ErbB che fa al fine di eterodimerizzare – l’ErbB2(attivo)-ErbB4(chinasi-morto) eterodimero stimolerebbe la proliferazione cellulare attraverso il percorso di segnalazione Erk/Akt, ma le cellule non si differenziano a causa della chinasi-morto ErbB4 e la mancanza di attivazione del percorso STAT516.
In studi più recenti, è diventato evidente che i movimenti dinamici degli ErbB erano rilevanti per comprendere gli effetti di alcuni mutanti sulla funzione ErbB, in particolare le mutazioni che si verificano all’interno del dominio della chinasi tirosina. Il dominio della chinasi della tirosina è costituito da un N-lobo (principalmente fogli β) e C-lobo (in gran parte alfa elicoidale), che sono separati dal sito catalitico dove si lega l’ATP. Il lobo N include l’elica e il ciclo P, mentre i loop di attivazione (A-loop) e catalitici sono presenti nel C-lobo17,18,19. Le strutture cristalline del dominio della chinasi della tirosina hanno rivelato due conformazioni inattive, la maggior parte delle strutture hanno lo stato inattivo simile a Src. Nella conformazione attiva l’aspartato catalitico dell’A-loop punta verso il sito di rilegatura ATP e l’elica di C è orientata verso la tasca di legame ATP (conformazione “C-in”), formando una forte interazione glutammato-lysina ione-coppia.
Poiché gli ErbB e il dominio della chinasi dei componenti sono entità altamente dinamiche, e soprattutto per i casi in cui gli effetti delle mutazioni sulla funzione e sull’attività biologica sono probabilmente strettamente collegati agli stati conformazionali degli ErbB, è importante valutare le mutazioni rispetto alla gamma di cambiamenti dinamici che sperimenteranno. Le strutture cristalline a raggi X degli ErbB forniscono istantanee statiche della struttura 3D, che può o non può essere rilevante per comprendere le conseguenze dinamiche di una mutazione. Al fine di sondare la gamma di cambiamenti dinamici corrispondenti al “paesaggio energetico” disponibile per una struttura tridimensionale (3D), le simulazioni di dinamiche molecolari (MD) sonoampiamente utilizzate 20. Nel caso di mutazioni che porterebbero a cambiamenti conformazionali locali all’interno del dominio della chinasi della tirosina o alla stabilizzazione di un complesso, possono essere sufficienti simulazioni dell’ordine di 100 ns. Tuttavia, le modifiche conformazionali su scala più ampia (ad esempio, le transizioni tra le conformazioni attive e inattive del dominio chinasi) richiedono un tempo di simulazione più lungo – nell’ordine dei microsecondi21.
Per quanto riguarda il protocollo descritto di seguito si considerano due mutazioni di attivazione all’interno del dominio della chinasi tirosina (Figura 3). Entrambe le mutazioni si trovano all’interno del dominio della chinasi in luoghi che sperimentano cambiamenti conformazionali locali che determinano se la chinasi è attiva o meno, e quindi le simulazioni MD sono state applicate in entrambi i casi. Nel primo caso, consideriamo le modifiche che influenzano direttamente il sito di rilegatura ATP e i macchinari catalitici del dominio della chinasi del ricevitore EGFR, esaminando specificamente le conseguenze di una mutazione di eliminazione exon 19 che è ampiamente implicata in NSCLC4,7. La mutazione ELREA750 di746, che riduce la lunghezza del loop β3-C che precede l’elica di C – l’elica che si muove verso il sito di legame/attivo sull’attivazione della chinasi e partecipa a formare l’interazione elettrostatica critica tra E762 dell’elica e K745 posizionando l’interazione lisina per l’attivazione con ATP – predispone il dominio per l’attivazione12. Nel secondo caso, consideriamo la mutazione A702V di EGFR, che si è dimostrata una nuova mutazione attivante di guadagno di funzione rivelata dalla piattaforma iScream9 e identificata in un paziente NSCLC22. Alanine-702 sul dominio chinasi ricevitore si trova sul segmento B juxtamembrane all’interfaccia del ricevitore e i domini chinasi attivatore, in cui questo asimmetrico chinasi dimer complesso e chinasi modifiche conformazionali sono necessari per l’attivazione9.
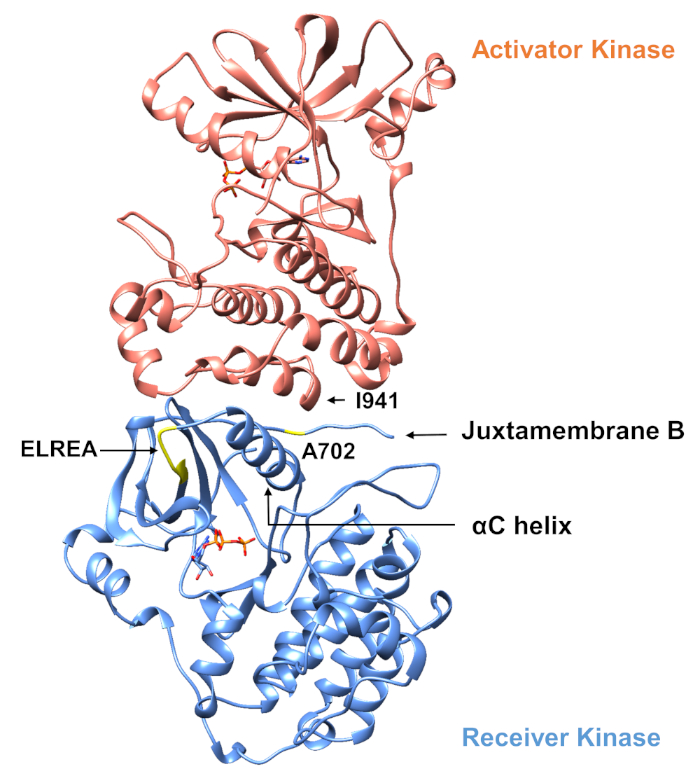
Figura 3: Il dimer di dominio della chinasi asimmetrica di EGFR. La mutazione A702V si trovava nell’interfaccia critica dei domini dell’attivatore e della chinasi del ricevitore, adiacente all’elica di C e vicino all’isolaucine 941 della chinasi dell’attivatore. I cambiamenti conformazionali indotti dalla formazione del dimer asimmetrico portano all’attivazione della chinasi. Il β3-C che contiene la sequenza ELREA precede direttamente l’elica di C; durante l’attivazione, l’elica C si sposta verso l’interno verso il sito di binding ATP. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il protocollo descritto in questo studio si concentra sull’utilizzo di simulazioni di dinamiche molecolari per studiare le alterazioni strutturali locali e globali che derivano dall’attivazione di mutazioni somatiche del dominio della chinasi EGFR. Sebbene le strutture cristalline a raggi X di tipo selvaggio e mutanti EGFR forniscano informazioni strutturali inestimabili, rappresentano una o poche rappresentazioni statiche. Tuttavia, inerente alla funzione biologica degli ErbB sono le transizioni necessarie tra la chinasi tirosina ezimaticamente inattiva e attiva, invocando cambiamenti dinamici sia nella struttura che nelle interazioni intramolecolari tra i monomeri della chinasi. Sono state quindi effettuate simulazioni MD per sondare la natura dinamica del dominio della tirosina della tirosina EGFR, tra cui la struttura di tipo selvaggio, la mutazione di delezione introdotta da EELREA e la mutazione A702V. Queste simulazioni sono riuscite a chiarire il probabile ruolo di queste mutazioni nelle strutture e come i loro effetti sulla conformazione del dominio della chinasi della tirosina avrebbero portato agli aumenti osservati sperimentalmente nell’attività della chinasi EGFR.
Un passo cruciale in questo protocollo è l’uso di una struttura rilevante per valutare l’impatto della mutazione. Un modo per selezionare una struttura di input di simulazione pertinente consiste nel visualizzare la posizione della mutazione nella struttura statica 3D ed esaminarne il possibile impatto rispetto agli amminoacidi e alle unità strutturali adiacenti. In questo studio, ad esempio, poiché la mutazione A702V EGFR si trova nel segmento juxtamembrane B che forma l’interfaccia dimer asimmetrica, l’uso della struttura dimera per la simulazione in contrapposizione al monomero è fondamentale. L’uso di una struttura monomerica avrebbe esposto il segmento juxtamembrane B della chinasi del ricevente al solvente, privarlo dalle interazioni stabilizzanti, arricchito dalla mutazione a un residuo idrofobico più grande e dalle interazioni con l’isolaucina 941 dai residui del lobo C della chinasi dell’attivatore. Inoltre, è interessante notare che la struttura 3D rappresentata dalle coordinate in un file PDB non corrisponde necessariamente alla struttura biologicamente rilevante che dovrebbe essere utilizzata per lo studio. Ad esempio, con la struttura di ErbB4, codice PDB 3BCE, le coordinate PDB corrispondono a un trimer, ma ciò è dovuto ai contatti di cristallo (pochi contatti tra i monomeri si vedono quando si visualizza questa struttura). Matrici all’interno del file PDB possono essere utilizzate (ad esempio, all’interno di Chimera) per ricostruire le strutture cristallograficamente correlate, che possono essere visualizzate per identificare le catene che corrispondono alla struttura 3D biologicamente rilevante come riportato nella pubblicazioneoriginale 42. Un altro passo essenziale del protocollo è quello di preparare correttamente la struttura di input di simulazione, come la costruzione di aminoacidi mancanti in diverse regioni del ciclo, e soprattutto dove si trova nelle vicinanze della mutazione. Sebbene nel PDB esistano numerose strutture EGFR di tipo selvaggio, sono disponibili solo un numero limitato di strutture EGFR mutanti. Di conseguenza, anche le strutture mutanti devono essere modellate; per una singola mutazione dei residui come A702V, la chimera è stata utilizzata per mutare il residuo; mentre, per la mutazione di delezione di EELREA, è stato utilizzato Modeller.
I vari parametri utilizzati nei file di input di simulazione – ad esempio, il numero di cicli di minimizzazione, il riscaldamento del sistema alla temperatura desiderata in una sola volta o invece il riscaldamento lentamente attraverso diverse temperature intermedie, il periodo di tempo per l’equilibrio e per le simulazioni di produzione – possono essere modificati in base alla molecola di studio, allo scopo del lavoro e alle proprie preferenze. Durante l’esecuzione di simulazioni MD, è anche comune imbattersi in errori che possono derivare dai file di input, problemi relativi al software di simulazione in uso o anche un errore dell’utente. Pertanto, è molto importante comprendere l’origine degli errori esaminando attentamente eventuali messaggi di errore. La maggior parte dei programmi di simulazione dispone di una mailing list in cui gli utenti possono porre domande agli sviluppatori di software e ad altri utenti con cui la maggior parte dei problemi può essere risolta. Inoltre, i manuali utente forniscono assistenza significativa per comprendere i dettagli del protocollo di simulazione, inclusi presupposti e limitazioni. Anche se la simulazione MD è uno strumento importante per esplorare le proprietà dinamiche delle molecole, ricordate che i risultati computazionali devono essere valutati attentamente in combinazione con altre fonti di informazioni per valutarne la validità. Quando possibile, collaborare con ricercatori esperti sulle proteine in esame, in particolare dove vengono effettuati studi sperimentali sul laboratorio umido pertinenti, che servono a fornire risultati per l’interpretazione strutturale e a suggerire esperimenti che possono essere fatti sulla base di osservazioni strutturali per testare ipotesi.
In questo studio, il protocollo è stato efficace nell’esaminare gli impatti strutturali dinamici delle mutazioni di EELREA e A702V sulle strutture della chinasi EGFR. Le simulazioni hanno rivelato che la zeELREA limita l’elica di C funzionalmente essenziale e promuove un passaggio conformazionale dalla chinasi inattiva a una chinasi attiva stabilizzata. I risultati della simulazione sono supportati in modo indipendente dai dati di risposta ai farmaci che hanno dimostrato gli effetti degli inibitori della chinasi della tirosina sulle linee cellulari del cancro del polmone con la mutazione della delezione di EGFR e LGFR di tipo selvaggio, dove è stata segnalata una maggiore inibizione da parte dei farmaci che riconoscono la conformazione della chinasi attiva per l’EGFR12. Con la mutazione A702V, le simulazioni MD indicano, rispetto al tipo selvaggio, una maggiore stabilizzazione dell’interfaccia chinasi attivatore-ricevitore, nonché una maggiore affinità dell’attivatore e della chinasi del ricevitore l’uno per l’altro, sostenendo insieme il mantenimento della conformazione attivata della kinase EGFR. La mutazione A702V, situata sul segmento juxtamembrane B della chinasi del ricevitore, aumenterebbe le interazioni idrofobiche con la chinasi dell’attivatore, funzionando per prolungare la durata dello stato attivato. La mutazione A702V supporta la sopravvivenza cellulare in assenza di fattore di crescita ed è stata identificata in uno screening in vitro per le mutazioni EGFR9.
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è finanziata da sovvenzioni a M.S.J dell’Accademia di Finlandia (308317, 320005), Sigrid Juselius Foundation e Tor, Joe e Pentti Borg memorial fund, e a K.E. dell’Accademia di Finlandia (274728, 316796), della Cancer Foundation of Finland e del Turku University Central Hospital. Il M.E.T. è finanziato dalla rete di biologia instrusa e strutturale dell’Akademi. Ringraziamo il CSC IT Center for Science per le risorse informatiche e il Dr. Jukka Lehtonen per il supporto IT nell’ambito della rete bioinformatica Biocenter Finland; e Biocenter Finlandia rete di infrastrutture di biologia strutturale.
Materials
| Amber software | University of California, San Francisco | Version 2018 | Executable |
| Chimera program | Resource for Biocomputing, Visualization, and Informatics at the University of California, San Francisco | Version 1.13.1 | Executable |
| EGFR struture files | The Protein Data Bank | 3D coordinates of EGFR structures | |
| Maestro | Schrödinger LLC | Version 2018-3 | Executable |
| Modeller program | The Andrej Šali Lab, Departments of Biopharmaceutical Sciences and Pharmaceutical Chemistry, University of California San Francisco | Included in the Chimera program | |
| VMD software | Theoretical and Computational Biophysics Group, University of Illinois at Urbana-Champaign | Version 1.9.3 | Executable |
Referencias
- Yarden, Y., Sliwkowski, M. X. Untangling the ErbB signalling network. Nature Reviews Molecular Cell Biology. 2, 127-137 (2001).
- Lemmon, M. A., Schlessinger, J., Ferguson, K. M. The EGFR family: not so prototypical receptor tyrosine kinases. Cold Spring Harbor Perspectives in Biology. 6, a020768 (2014).
- Arteaga, C. L., Engelman, J. A. ERBB receptors: From oncogene discovery to basic science to mechanism-based cancer therapeutics. Cancer Cell. 2, 282-303 (2014).
- Mishra, R., Hanker, A. B., Garrett, J. T. Genomic alterations of ERBB receptors in cancer: Clinical implications. Oncotarget. 8, 114371-114392 (2017).
- . cBioPortal for Cancer Genomics Available from: https://www.cbioportal.org (2020)
- Lynch, T. J., et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. New England Journal of Medicine. 350 (21), 2129-2139 (2004).
- Paez, J. G., et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science. 304 (5676), 1497-1500 (2004).
- Pao, W., et al. EGF receptor gene mutations are common in lung cancers from “never smokers” and are associated with sensitivity of tumors to gefitinib and erlotinib. Proceedings of the National Academy of Sciences U.S.A. 101 (36), 13306-13311 (2004).
- Chakroborty, D., et al. Unbiased in vitro screen for activating EGFR mutations. Journal of Biological Chemistry. 294 (24), 9377-9389 (2019).
- Leahy, D. J. Structure and Function of the Epidermal Growth Factor (EGF/ErbB) Family of Receptors. Advances in Protein Chemistry. 68, 1-27 (2004).
- Roskoski, R. ErbB/HER protein-tyrosine kinases: Structures and small molecule inhibitors. Pharmacological Research. 87, 42-59 (2014).
- Tamirat, M. Z., Koivu, M., Elenius, K., Johnson, M. S. Structural characterization of EGFR exon 19 deletion mutation using molecular dynamics simulation. PLoS ONE. 14 (9), e0222814 (2019).
- Ding, L., et al. Somatic mutations affect key pathways in lung adenocarcinoma. Nature. 455, 1069-1075 (2008).
- Kurppa, K. J., Denessiouk, K., Johnson, M. S., Elenius, K. Activating somatic ERBB4 mutations in non small-cell lung cancer. Oncogene. 35 (10), 1283-1291 (2016).
- Soung, Y. H., et al. Somatic mutations of the ERBB4 kinase domain in human cancers. International Journal of Cancer. 118, 1426-1429 (2006).
- Tvorogov, D., et al. Somatic mutations of ERBB4: selective loss-of-function phenotype affecting signal transduction pathways in cancer. Journal of Biological Chemistry. 284, 5582-5591 (2009).
- Hubbard, S. R., Till, J. H. Protein tyrosine kinase structure and function. Annual Review of Biochemistry. 69 (1), 373-398 (2000).
- Huse, M., Kuriyan, J. The conformational plasticity of protein kinases. Cell. 109 (3), 275-282 (2002).
- Jura, N., et al. Catalytic control in the EGF receptor and its connection to general kinase regulatory mechanisms. Molecular Cell. 42, 9-22 (2011).
- Karplus, M., Kuriyan, M., J, Molecular dynamics and protein function. Proceedings of the National Academy of Sciences U.S.A. 102 (19), 6679-6685 (2005).
- Shan, Y., Arkhipov, A., Kim, E. T., Pan, A. C., Shaw, D. E. Transitions to catalytically inactive conformations in EGFR kinase. Proceedings of the National Academy of Sciences U.S.A. 110 (18), 7270-7275 (2013).
- Reckamp, K. L., et al. A phase I trial to determine the optimal biological dose of celecoxib when combined with erlotinib in advanced non-small cell lung cancer. Clinical Cancer Research. 12 (11 Pt 1), 3381-3388 (2006).
- Pettersen, E. F., et al. UCSF Chimera-a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25 (13), 1605-1612 (2004).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. 28 (1), 235-242 (2000).
- Zhang, X., Gureasko, J., Shen, K., Cole, P. A., Kuriyan, J. An Allosteric Mechanism for Activation of the Kinase Domain of Epidermal Growth Factor Receptor. Cell. 125 (6), 1137-1149 (2006).
- Stamos, J., Sliwkowski, M. X., Eigenbrot, C. Structure of the epidermal growth factor receptor kinase domain alone and in complex with a 4-anilinoquinazoline inhibitor. Journal of Biological Chemistry. 277 (48), 46265-46272 (2002).
- Sogabe, S., et al. Structure-Based Approach for the Discovery of Pyrrolo[3,2-d]pyrimidine-Based EGFR T790M/L858R Mutant Inhibitors. ACS Medicinal Chemistry Letters. 4 (2), 201-205 (2013).
- Sali, A., Blundell, T. L. Comparative protein modelling by satisfaction of spatial restraints. Journal of Molecular Biology. 234 (3), 779-815 (1993).
- Yun, C. H., et al. Structures of lung cancer-derived EGFR mutants and inhibitor complexes: mechanism of activation and insights into differential inhibitor sensitivity. Cancer Cell. 11 (3), 217-227 (2007).
- Park, J. H., Liu, Y., Lemmon, M. A., Radhakrishnan, R. Erlotinib binds both inactive and active conformations of the EGFR tyrosine kinase domain. Biochemical Journal. 448 (3), 417-423 (2012).
- . Release 2018-3: Maestro Available from: https://www.schrodinger.com/maestro (2018)
- Case, D. A., et al. . AMBER 2018. , (2018).
- Maier, J. A., Martinez, C., Kasavajhala, K., Wickstrom, L., Hauser, K. E., Simmerling, C. ff14SB: Improving the Accuracy of Protein Side Chain and Backbone Parameters from ff99SB. Journal of Chemical Theory and Computation. 11 (8), 3696-3713 (2015).
- Jorgensen, W. L., Chandrasekhar, J., Madura, J. D., Impey, R. W., Klein, M. L. Comparison of simple potential functions for simulating liquid water. Journal of Chemical Physics. 79 (2), 926-935 (1983).
- Meagher, K. L., Redman, L. T., Carlson, H. A. Development of polyphosphate parameters for use with the AMBER force field. Journal of Computational Chemistry. 24 (9), 1016-1025 (2003).
- Humphrey, W., Dalke, A., Schulten, K. VMD: Visual molecular dynamics. Journal of Molecular Graphics. 14 (1), 33-38 (1996).
- Melvin, R. L., Salsbury, F. R. Visualizing ensembles in structural biology. Journal of Molecular Graphics and Modelling. 67, 44-53 (2016).
- Roe, D. R., Cheatham, T. E. PTRAJ and CPPTRAJ: Software for processing and analysis of molecular dynamics trajectory data. Journal of Chemical Theory and Computation. 9 (7), 3084-3095 (2013).
- Miller, B. R., et al. MMPBSA.py: An Efficient Program for End-State Free Energy Calculations. Journal of Chemical Theory and Computation. 8 (9), 3314-3321 (2012).
- Guha, U., et al. Comparisons of tyrosine phosphorylated proteins in cells expressing lung cancer-specific alleles of EGFR and KRAS. Proceedings of the National Academy of Sciences U.S.A. 105 (37), 14112-14117 (2008).
- Furuyama, K., et al. Sensitivity and kinase activity of epidermal growth factor receptor (EGFR) exon 19 and others to EGFR-tyrosine kinase inhibitors. Cancer Science. 104 (5), 584-589 (2013).
- Qiu, C., et al. Mechanism of Activation and Inhibition of the HER4/ErbB4 Kinase. Structure. 6 (3), 460-467 (2008).

