Eencellige optische actiepotentiaalmeting in door de mens geïnduceerde pluripotente van stamcellen afgeleide cardiomyocyten
Summary
Hier beschrijven we optische acquisitie en karakterisering van actiepotentiaalen van geïnduceerde pluripotente stamcel afgeleide cardiomyocyten met behulp van een snel modulair fotometriesysteem.
Abstract
Conventionele intracellulaire micro-elektrodetechnieken om cardiomyocytenelektrofysiologie te kwantificeren zijn uiterst complex, arbeidsintensief en worden meestal uitgevoerd in lage doorvoer. Snelle en voortdurende uitbreiding van geïnduceerde pluripotente stamceltechnologie (iPSC) vormt een nieuwe standaard in cardiovasculair onderzoek en alternatieve methoden zijn nu nodig om de doorvoer van elektrofysiologische gegevens op een enkel celniveau te verhogen. VF2.1Cl is een recent afgeleide spanningsgevoelige kleurstof die een snelle eenkanaals, hoge magnitude respons biedt op fluctuaties in membraanpotentiaal. Het bezit een kinetiek die superieur is aan die van andere bestaande spanningsindicatoren en stelt functionele gegevens beschikbaar die gelijkwaardig zijn aan die van traditionele micro-elektrodetechnieken. Hier demonstreren we vereenvoudigde, niet-invasieve actiepotentiaalkarakterisering in extern getemporeerde menselijke iPSC-afgeleide cardiomyocyten met behulp van een modulair en zeer betaalbaar fotometriesysteem.
Introduction
Elektrofysiologische modellering van cardiomyocyten en de bouw van efficiënte platforms voor cardiale geneesmiddelenscreening is essentieel voor de ontwikkeling van therapeutische strategieën voor een verscheidenheid aan aritmische aandoeningen. Snelle uitbreiding van geïnduceerde pluripotente stamcel (iPSC) technologie heeft veelbelovende inbraken in de menselijke ziekte modellering en farmacologisch onderzoek met behulp van geïsoleerde patiënt afgeleide cardiomyocyten (iPSC-CM) geproduceerd. “Gouden standaard” -technieken voor elektrofysiologische karakterisering van deze cellen door middel van patch-clamp (current-clamp) kunnen de morfologie en duur van het actiepotentiaal (AP) kwantificeren, maar deze methode is ongelooflijk complex en traag en niet goed geschikt voor gegevensacquisitie met hoge doorvoer1. iPSC-CMs hebben regelmatig een verhoogd diastolisch membraanpotentiaal en verhoogde lekstroom in vergelijking met volwassen inheemse cardiomyocyten2. Er wordt gesuggereerd dat kleinere celgrootte en verminderde membraancapaciteit waargenomen in iPSC-CMs een systematische fout kunnen veroorzaken bij het gebruik van de stroomklemtechniek, misschien als verklaring voor deze afwijkingen3. Om het nut van een iPSC-CM-platform te maximaliseren, is een extra methode waardevol om de doorvoer te verhogen en de nauwkeurigheid van gegevens te garanderen bij het karakteriseren van transmembraanspanningsveranderingen op een enkel celniveau in iPSC-CMs.
Spanningsgevoelige kleurstoffen (VSD) zijn al lang een voorgestelde methode om een snellere, niet-invasieve en gelijkwaardige analyse van cardiale AP-kinetiek te bieden in vergelijking met die van traditionele technieken4. Een recente studie heeft de geschiktheid aangetoond van ratiometrische spanningsgevoelige sondefotometrie om de cardiale AP5nauwkeurig te kwantificeren. Bovendien leent de mogelijkheid om optische fotometriebenaderingen gemakkelijk op te schalen deze techniek aan grootschalige cardiotoxiciteitsscreenings die van cruciaal belang zijn bij de ontwikkeling van therapeutische geneesmiddelen (bijv. CiPA). Ontwikkeling van gestandaardiseerde cardiotoxiciteitsprotocollen in een geblindeerde multi-site studie met behulp van micro-elektrode array en spanningsgevoelige optische technieken heeft de belangrijkste waarde van deze aanpak aangetoond6.
Veel potentiometrische kleurstoffen zijn commercieel verkrijgbaar en de voortdurende synthetische ontwikkeling van nieuwe sondes toont een opwindend potentieel voor het stroomlijnen van hun effectiviteit in een verscheidenheid aan cardiale en neurale constructies. De ideale VSD heeft een verhoogde kinetiek en gevoeligheid, terwijl de capacitieve belasting, fotobleaching en cytotoxiciteit afnemen. De onlangs gesynthetiseerde VF2.1Cl (FluoVolt) drukt veel van deze gunstige eigenschappen uit, grotendeels te danken aan de nieuwe draadgebaseerde moleculaire structuur, gedeeld door andere leden van de nieuwe VoltageFluor (VF) -familie7. In tegenstelling tot gewone elektrochrome VSD’s waarin eenvoudige sondes moleculair en elektrisch conjugeren met het plasmamembraan, bestaat deze kleurstof uit een passief ingebrachte, membraanoverspannende synthetische draad die een elektronrijke donor koppelt aan een gemodificeerde fluoresceïnefluoofoor (FITC). Mechanistische details zijn te vinden in figuur 1. Deze kleurstof toont een uitstekende gevoeligheid voor membraanspanningsfluctuaties en vertoont een verandering van 27% in emissie-intensiteit per 100 mV in tegenstelling tot ~ 10% gezien in andere veel voorkomende sondes bij vergelijkbare snelheden7. Bovendien hebben draadgebaseerde PeT-systemen geen directe interactie met het cellulaire elektrische veld, wat minimale elektrische interferentie en verwaarloosbare veranderingen in cellulaire capacitieve belasting produceert.
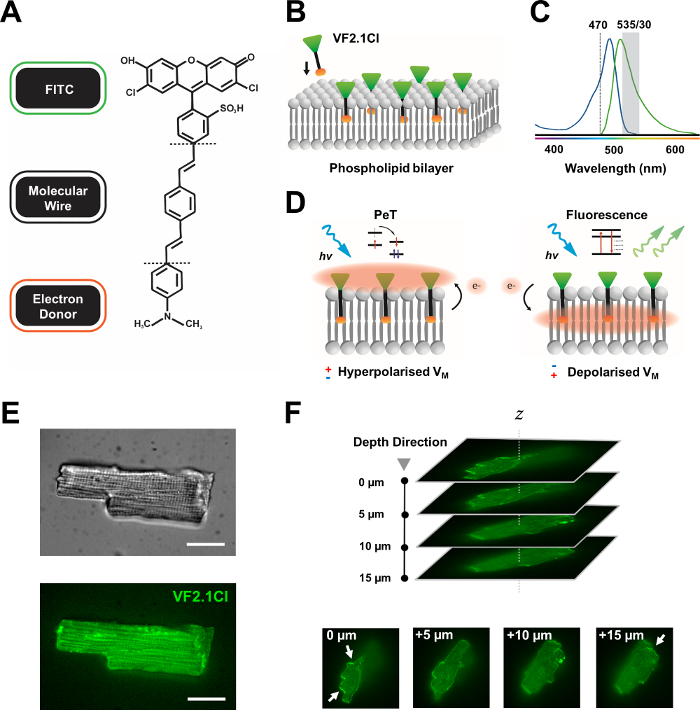
Figuur 1: Chemische, spectrale en mechanistische parameters van VF2.1Cl kleurstof. (A) Chemische structuur van VF2.1Cl. Moleculaire kenmerken om op te merken omvatten meerdere alkylgroepen in de fenyleenvinyleen moleculaire draad die het inbrengen in het plasmamembraan vergemakkelijken. Een negatief geladen sulfonzuurgroep geconjugeerd aan de FITC-sonde zorgt voor fluorofoorstabilisatie op het extracellulaire oppervlak en helpt bij het bijna loodrecht inbrengen ten opzichte van het elektrische veld van de lipide dubbellaag. B)Een vereenvoudigd schema van loodrechte VF2,1Cl inbedding in het plasmamembraan van een doelcel. (C) Absorptie- en emissiespectra van VF2.1Cl kleurstof. Spectra is identiek aan die van standaard FITC- en GFP-sondes. D)Weergave van het mechanistische werkingsmechanisme van VF2.1Cl. In rustomstandigheden (hyperpolarisch) drijven negatieve intracellulaire spanningen vrije elektronen naar de rostrale fluorofoor. Elektronenrijkdom zorgt ervoor dat foto-geïnduceerde elektronenoverdracht (PeT) de voorkeur krijgt als een pad uit de aangeslagen toestand na de optische excitatie, waardoor fluorescentie effectief wordt geblust. Daarentegen beïnvloedt een gedepolariseerde membraanpotentiaal de neerwaartse elektronenbeweging ten gunste van fluorescentie bij optische excitatie. De resulterende fluorescerende respons is lineair gerelateerd aan membraanspanning en kan nauwkeurig worden gebruikt om gedetailleerde temporele informatie over cellulaire elektrofysiologische kinetiek te verzamelen. (E) Representatieve brightfield (bovenste) en fluorescentie bij 470 nm (onderste) beelden van leporine cardiomyocyten geladen met VF2.1Cl. (F) Z stack van een enkele geladen cardiomyocyt. Pijlen geven gebieden aan met een duidelijke lokalisatie van VF2.1Cl naar het celmembraan. Beelden werden verkregen met een ronddraaiend schijf confocaal systeem bestaande uit een X-lightv3 draaiende schijf confocale kop met een 50 μm pinhole patroon; LDI-7 verlichting; Prime95B camera en een PlanApo Lambda 100x objectief. Schaalbalk: 20 μm. Klik hier om een grotere versie van deze figuur te bekijken.
De FITC-sonde geconjugeerd aan VF2.1Cl zorgt ervoor dat deze effectief kan worden gebruikt onder standaard- en GFP-filterconfiguraties, en vereist slechts een enkelkanaals acquisitiesysteem, die beide gemeenschappelijke kenmerken zijn van fluorescerende beeldvormingsplatforms. Analyse van dichte menselijke iPSC-CM monolagen met deze kleurstof is onlangs gemeld8,9,10,11. Ons protocol verschilt van deze studies vanwege ons onderzoek naar enkele, geïsoleerde iPSC-CMs, niet gestoord door de elektrische en paracriene invloeden van dichte syncytiele monolagen, en ons gebruik van een betaalbaar en aanpasbaar fotometriesysteem in tegenstelling tot complexe confocale of wide-field beeldvormingsarrangementen.
Hier beschrijven we ons protocol voor de snelle verwerving en analyse van robuuste optische AP’s van geïsoleerde menselijke iPSC-afgeleide cardiomyocyten en inheemse cardiomyocyten (zie Aanvullend bestand). We gebruiken VF2.1Cl in combinatie met een aanpasbaar state-of-the-art platform voor fotometriemetingen met één cel. Deze experimentele protocollen zijn goedgekeurd door de ethische commissie van het Universitair Medisch Centrum Göttingen (nr. 10/9/15).
Protocol
Representative Results
Discussion
Hier beschrijven we een basisprotocol om eenvoudig gedetailleerde AP-profielen te verkrijgen van geïsoleerde iPSC-CMs die geschikt zijn voor elektrofysiologische modellering en cardiale geneesmiddelenscreening. We detecteren regelmatige, robuuste AP’s van onze schaars gezaaide iPSC-CMs, wat zowel indicatorfunctionaliteit als methodologische betrouwbaarheid suggereert.
Vanwege het brede spectrum van commerciële methodologieën voor iPSC-herprogrammering en het gebrek aan standaardisatie voor …
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
De auteurs willen Cairn Research Ltd. bedanken voor hun vriendelijke financiële bijdrage die de productiekosten van deze publicatie dekte. Daarnaast bedanken we mevrouw Ines Mueller en mevrouw Stefanie Kestel voor hun uitstekende technische ondersteuning.
Het onderzoek van de auteurs wordt ondersteund door het Duitse Centrum voor Cardiovasculair Onderzoek (DZHK), de Deutsche Forschungsgemeinschaft (DFG, German Research Foundation, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 en in het kader van de Duitse Excellence Strategy – EXC 2067/1- 390729940) en de Else-Kröner-Fresenius Stiftung (EKFS 2016_A20).
Materials
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
Referencias
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Bioquímica. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).

