הדמיית זרם אוטומטי להערכת חילוף החומרים התאי
Summary
פרוטוקול זה מתאר הדמיה וניתוח פלואורסצנטי של קואנזימים מטבוליים אנדוגני, אדנין ניקוטינאמיד מופחת (פוספט) dinucleotide (NAD(P)H), ו flavin adenine dinucleotide מחומצן (FAD). הדמיה אוטופלואורסצנטית של NAD(P)H ו-FAD מספקת שיטה נטולת תוויות ולא הרסנית להערכת חילוף החומרים התאי.
Abstract
חילוף החומרים התאי הוא התהליך שבו תאים מייצרים אנרגיה, ומחלות רבות, כולל סרטן, מאופיינות בחילוף חומרים חריג. ניקוטינאמיד אדנין מופחת (פוספט) דינוקלאוטיד (NAD(P)H) ופלובין אדנין דינוקלאוטיד מחומצן (FAD) הם קואנזימים של תגובות מטבוליות. NAD(P)H ו-FAD מציגים זרימה אוטומטית וניתן לבודד אותם באופן ספקטרלי על ידי אורכי גל של עירור ופליטה. שני הקואנזימים, NAD(P)H ו- FAD, יכולים להתקיים בתצורה חופשית או כרוכה בחלבון, שלכל אחד מהם פלואורסצנטיות ייחודית לכל החיים – הזמן שעבורו הפלואורופור נשאר במצב הנרגש. הדמיה לכל החיים של פלואורסצנטיות (FLIM) מאפשרת כימות של עוצמת הפלואורסצנטיות ואורך החיים של NAD(P)H ו- FAD לניתוח ללא תוויות של חילוף החומרים התאי. ניתן למטב את עוצמת הפלואורסצנטיות ואת המיקרוסקופים לכל החיים להדמיית NAD(P)H ו- FAD על-ידי בחירת אורכי הגל המתאימים של עירור ופליטה. הפרעות מטבוליות על ידי ציאניד לאמת פרוטוקולי הדמיה autofluorescence כדי לזהות שינויים מטבוליים בתוך תאים. מאמר זה ידגים את הטכניקה של הדמיית autofluorescence של NAD(P)H ו- FAD למדידת חילוף החומרים התאי.
Introduction
חילוף החומרים הוא התהליך התאי של ייצור אנרגיה. חילוף החומרים התאי מקיף מסלולים מרובים, כולל גליקוליזה, זרחן חמצוני, גלוטמינוליזיס. תאים בריאים משתמשים במסלולים מטבוליים אלה כדי לייצר אנרגיה להתפשטות ולתפקוד, כגון ייצור ציטוקינים על ידי תאי מערכת החיסון. מחלות רבות, כולל הפרעות מטבוליות, סרטן, ניוון עצבי, מאופיינים בחילוף חומרים תאי שונה1. לדוגמה, כמה סוגי תאים סרטניים יש שיעורים גבוהים של גליקוליזה, אפילו בנוכחות חמצן, כדי ליצור מולקולות לסינתזה של חומצות גרעין, חלבונים, שומנים, שומנים2,3. תופעה זו, המכונה אפקט ורבורג, היא סימן היכר של סוגי סרטן רבים, כולל סרטן השד, סרטן ריאות, ו glioblastomas4. בגלל השינויים של חילוף החומרים התאי הקשורים עם התקדמות הסרטן, חילוף החומרים התאי יכול להיות סמן ביולוגי פונדקאי לתגובה תרופתית 5,6. יתר על כן, הבנת יעילות התרופה ברמה התאית היא חיונית כמו הטרוגניות התא יכול להוביל לתגובות סמים שונות אצל אנשים7,8.
טכנולוגיות המזהות ומכמתות שינויים בחילוף החומרים התאי חיוניות למחקרים של סרטן ותגובה לתרופות. ניתוחים כימיים וחלבון משמשים להערכת חילוף החומרים של תאים או רקמות אך חסרים רזולוציה של תא יחיד ומידע מרחבי. בדיקות המבוססות על קורא לוחות מטבוליים יכולות למדוד את צריכת החומציות והחמצן במדגם לאורך זמן ואת ההפרעה המטבולית הבאה על ידי כימיקלים. ניתן להשתמש ב- pH כדי לחשב את קצב החמצה חוץ-תאית (ECAR), המספק תובנה על הפעילות הגליקוליטית של התאים9. שיטות הדמיה לכל הגוף, כולל טומוגרפיה של פליטת פלואורו-D-גלוקוז פוזיטרונים (FDG PET) וספקטרוסקופיית תהודה מגנטית (MRS), הן שיטות הדמיה לא פולשניות המשמשות קלינית לזיהוי הישנות גידולים ויעילות התרופה באמצעות מדידות מטבוליות10,11,12,13,14.14.
FDG-PET מצלם את ספיגת הרקמות של FDG, אנלוגי גלוקוז עם תווית רדיו. ספיגה מוגברת של FDG-PET על ידי גידולים ביחס לרקמה שמסביב נובעת אפקט ורבורג12,13. MRS מדמה גרעינים נפוצים של מולקולות המשמשות לחילוף חומרים, כגון 13C ו– 31P, ויכולה לקבל מידע דינמי על האופן שבו חילוף החומרים משתנה בתגובה לגירויים, כגון פעילות גופנית או אכילה14. למרות FDG-PET ו- MRS ניתן להשתמש קלינית, טכנולוגיות אלה חסרות את הפתרון המרחבי כדי לפתור הטרוגניות תוךטומורלית. כמו כן, מדידות צריכת חמצן נעשות על אוכלוסייה בתפזורת של תאים. הדמיית Autofluorescence מתגברת על מכשול הרזולוציה המרחבית של טכנולוגיות אלה ומספקת שיטה לא פולשנית לכימות חילוף החומרים התאי.
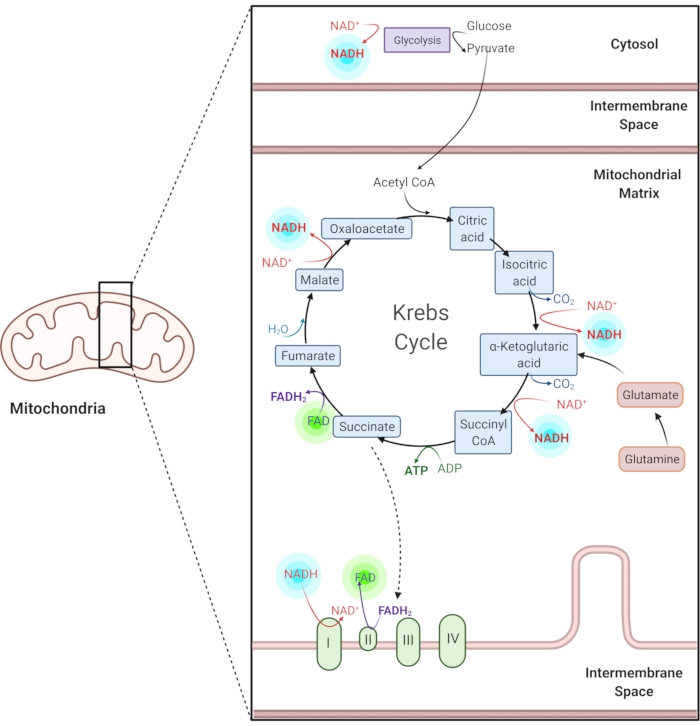
איור 1: NADH ו-FAD במסלולים מטבוליים נפוצים. NADH ו-FAD הם קואנזימים המשמשים בגליקוליזה, מחזור קרבס ושרשרת הובלת האלקטרונים. הדמיה Autofluorescence של מולקולות אלה מספק מידע על חילוף החומרים הסלולר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ניקוטינאמיד אדנין מופחת (פוספט) דינוקלאוטיד (NAD(P)H) ופלובין אדנין דינוקלאוטיד מחומצן (FAD) הם קואנזימים של תגובות מטבוליות, כולל גליקוליזה, זרחן חמצוני וגלוטמינוליזיס (איור 1). הן NAD(P)H והן FAD הם autofluorescent ומספקים ניגודיות אנדוגנית להדמיית פלואורסצנטיות1,15. ל- NADPH תכונות פלואורסצנטיות דומות ל- NADH. מסיבה זו, NAD(P)H משמש לעתים קרובות כדי לייצג את האות המשולב של NADH ו NADPH2,16.
הדמיה לכל החיים פלואורסצנטיות (FLIM) מכמתת את חיי הפלואורסצנטיות או את הזמן שעבורו פלואורופור נמצא במצב הנרגש. תקופות חיים פלואורסצנטיות מגיבות למיקרו-סביבה של הפלואורופורים ומספקות מידע על חילוף החומרים התאי17. NAD(P)H ו-FAD יכולים להתקיים בתוך תאים בקונפורמציות הקשורות לחלבון או בחינם, שלכל אחד מהם יש חיים שונים. ל-NAD(P)H החינמי יש אורך חיים קצר יותר מ-NAD(P)H הקשור לחלבון; לעומת זאת, ל-FAD בחינם יש חיים ארוכים יותר מ-FAD18,19 מאוגד. ניתן לכמת את אורך החיים ואת משקולות הרכיבים לכל החיים מנתוני ריקבון לכל החיים של פלואורסצנטיות באמצעות Eq. (1)20:
I(t) = α 1e-t/τ1 + α 2e-t/τ2 + C (1)
Eq (1) מייצג את עוצמת הפלואורסצנטיות המנורמלת כפונקציה של זמן. α 1 ו-α 2 במשוואה זו מייצגים את הרכיבים היחסיים של אורך חיים קצר וארוך (α 1+ α 2=1), בהתאמה, τ1 ו- τ2 מייצגים את אורך החיים הקצר והארוך, בהתאמה, ו- C מהווה אור רקע7,20. אורך החיים המשוקלל של משרעת, המיוצג כאן כ- τm, מחושב באמצעות Eq. (2).
τm= α 1τ1+ α 2τ2 (2)
חיים ממוצעים יכולים להיות מחושבים על ידי ממוצע “t” על דעיכה אינטנסיבית של פלואורופור, אשר עבור ריקבון דו-מעריכי מוצג על ידי Eq. (3)17,21.
τ*m= (α 1τ12+ α 2τ22)/ (α 1τ1+ α 2τ2) (3)
ניתן לחשב תמונה בעוצמה פלואורסצנטית מהתמונה לכל החיים על-ידי שילוב הריקבון של חיי הפלואורסצנטיות. הדמיה אוטופלואורסצנטית היא שיטה לא הרסנית ונטולת תוויות שניתן להשתמש בה כדי לאפיין את חילוף החומרים של תאים חיים ברזולוציה תת-תאית. יחס redox אופטי מספק מדד אנלוגי אופטי של מצב redox כימי של התא ומחושב כיחס של עוצמות NAD(P)H ו- FAD. למרות שהנוסחה לחישוב יחס ה-redox האופטי אינה מתוקננת22,23,24,25, היא מוגדרת כאן כעוצמת ה-FAD על פני העוצמות המשולבות של NAD(P)H ו-FAD. הגדרה זו משמשת מכיוון שהעוצמה המסוכמת במכנה מנרמלת את המדד בין 0 ל-1, והתוצאה הצפויה של עיכוב הציאניד היא ירידה ביחס ה- redox. חיי הפלואורסצנטיות של NAD(P)H ו-FAD בחינם מספקים תובנה לגבי שינויים במיקרו-סביבה הממסית המטבולית, כולל pH, טמפרטורה, קרבה לחמצן ואוסמולאריות17.
שינויים באורך הפלואורסצנטיות של השברים הכרוכים של NAD(P)H ו- FAD יכולים להצביע על ניצול מסלול מטבולי וחילוף חומרים ספציפי למצע26. ניתן לפרש משקולות רכיבים לשינויים בשבר החופשי עד הכרוך של קואנזים18,19. בסך הכל, מדדים כמותיים אלה של אורך החיים של autofluorescence מאפשרים ניתוח של חילוף החומרים התאי, והדמיה autofluorescence שימש לזיהוי neoplasms מרקמות נורמליות27,28, המאפיינים תאי גזע29,30, הערכת תפקוד תאי מערכת החיסון31,32,33,34,35, מודד פעילות נוירולוגית36, 37,38, והבנת יעילות התרופה בסוגי סרטן כגון סרטן השד וסרטן הראש והצוואר21,39,40,41,42. הדמיית תצפרחת אוטומטית ברזולוציה גבוהה ניתן לשלב עם פילוח תמונה לניתוח תא יחיד וכימות של הטרוגניות תוך-אוכלוסיות43,44,44,45,45,46,47.
ניתן לצלם את NAD(P)H ו- FAD במיקרוסקופים פלואורסצנטיים של פוטון יחיד או רב-פוטון המוגדרים לעוצמה או להדמיה לכל החיים. עבור מיקרוסקופים של פוטון יחיד, NAD(P)H ו- FAD מתרגשים בדרך כלל באורכי גל של 375-405 ננומטר ו- 488 ננומטר, בהתאמה, בשל מקורות לייזר נפוצים באורכי גל אלה48. בהתרגשות פלואורסצנטית דו-פוטונית, NAD(P)H ו-FAD ירגשו באורכי גל של כ-700 עד 750 ננומטר ו-700 עד 900 ננומטר, בהתאמה, 15,49. לאחר הפלורופורים מתרגשים, NAD(P)H ו- FAD פולטים פוטונים באורכי גל בין ~ 410 ננומטר ל ~ 490 ננומטר ו ~ 510 ננומטר ~ 640 ננומטר, בהתאמה. אורכי הגל של פליטת NAD(P)H ו-FAD maxa הם כ-450 ננומטר ו-535 ננומטר, בהתאמה, בהתאמה.
בגלל אורכי הגל השונים של עירור ופליטה, הפלואורסצנטיות של שני הקואנזימים המטבוליים יכולה להיות מבודדת באופן ספקטרלי. הבנה של המאפיינים הספקטרליים של NAD(P)H ו- FAD נחוצה לתכנון ואופטימיזציה של פרוטוקולי הדמיה autofluorescence. ציאניד הוא מעכב עירוי מורכב של שרשרת הובלת אלקטרונים (ETC). ההשפעות של ציאניד על חילוף החומרים התאי ואת עוצמות autofluorescence ואת אורך החיים של NAD(P)H ו FAD בתוך תאים מאופיינים היטב27,40. לכן, ניסוי הפרעת ציאניד הוא אמצעי יעיל לאימות פרוטוקולי הדמיה NAD(P)H ו- FAD. ניסוי ציאניד מוצלח מספק ביטחון כי פרוטוקול הדמיה NAD(P)H ו- FAD יכול לשמש כדי להעריך את חילוף החומרים של קבוצות לא ידועות או הפרעות.
Protocol
Representative Results
Discussion
עוצמת autofluorescence והדמיה לכל החיים היו בשימוש נרחב כדי להעריך את חילוף החומרים בתאים21,55. FLIM הוא ברזולוציה גבוהה ולכן פותר תאים בודדים, אשר חשוב עבור מחקרי סרטן כי הטרוגניות הסלולר תורם תוקפנות הגידול ועמידות לתרופות7,39,41,44,44,45,46,58.</su…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
מקורות המימון כוללים את המכון למניעת סרטן ומחקר של טקסס (CPRIT RP200668) ואוניברסיטת טקסס A&M. איור 1 נוצר עם BioRender.com.
Materials
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25×36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25×36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
Referencias
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532 (2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500 (2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271 (2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Investigación sobre el cáncer. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456 (2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014 (2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068 (2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Investigación sobre el cáncer. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer’s disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008 (2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104 (2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Investigación sobre el cáncer. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Investigación sobre el cáncer. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Investigación sobre el cáncer. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. . Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792 (2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007)
- . CellProfiler Available from: https://cellprofiler.org/releases (2007)
- Autofluorescence Imaging. GitHub Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021)
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Investigación sobre el cáncer. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Investigación sobre el cáncer. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850 (2018).
- . The bh TCSPC Handbook Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021)
- Gadella, T. W. J., Mason, W. T. . Fluorescent and Luminescent Probes for Biological Activity. 34, 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).

