مقياس التمدد الدقيق للتصور المجهري البؤري للواجهات الديناميكية
Summary
تصف هذه المخطوطة تصميم وتشغيل مقياس التمدد الدقيق/المجهر البؤري لإجراء قياسات متزامنة للتوتر البيني والريولوجيا التوسعية السطحية مع تصور المورفولوجيا بين الوجهين. وهذا يوفر البناء في الوقت الحقيقي للعلاقات بين البنية والملكية للواجهات المهمة في التكنولوجيا وعلم وظائف الأعضاء.
Abstract
إن امتزاز الجزيئات النشطة على السطح إلى واجهات السوائل والسوائل موجود في كل مكان بطبيعته. يتطلب توصيف هذه الواجهات قياس معدلات الامتزاز السطحي ، وتقييم التوترات السطحية المتوازنة كدالة لتركيز السطحي السائب ، وربط كيفية تغير التوتر السطحي بالتغيرات في المنطقة البينية بعد التوازن. يسمح التصور المتزامن للواجهة باستخدام التصوير الفلوري باستخدام المجهر البؤري عالي السرعة بالتقييم المباشر للعلاقات بين البنية والوظيفة. في مقياس الضغط الشعري الدقيق (CPM) ، يتم تثبيت فقاعة هواء نصف كروية في نهاية الشعيرات الدموية في خزان سائل بحجم 1 مل. يتم التحكم في الضغط الشعري عبر واجهة الفقاعة عبر وحدة تحكم تدفق الموائع الدقيقة التجارية التي تسمح بالضغط القائم على النموذج أو انحناء الفقاعة أو التحكم في منطقة الفقاعة بناء على معادلة لابلاس. بالمقارنة مع التقنيات السابقة مثل حوض Langmuir وإسقاط القلادة ، يتم تحسين دقة القياس والتحكم ووقت الاستجابة بشكل كبير. يمكن تطبيق اختلافات الضغط الشعري والتحكم فيها في ميلي ثانية. يتم تصور الاستجابة الديناميكية لواجهة الفقاعة عبر عدسة بصرية ثانية مع توسع الفقاعة وانكماشها. يتناسب محيط الفقاعة مع ملف تعريف دائري لتحديد نصف قطر انحناء الفقاعة ، R ، وكذلك أي انحرافات عن الدائرية من شأنها أن تبطل النتائج. تستخدم معادلة لابلاس لتحديد التوتر السطحي الديناميكي للواجهة. بعد التوازن ، يمكن فرض تذبذبات ضغط صغيرة بواسطة مضخة الموائع الدقيقة التي يتم التحكم فيها بواسطة الكمبيوتر لتذبذب نصف قطر الفقاعة (ترددات 0.001-100 دورة / دقيقة) لتحديد معامل التمدد الأبعاد الإجمالية للنظام صغيرة بما فيه الكفاية بحيث يتناسب مقياس الشد الدقيق تحت عدسة المجهر البؤري عالي السرعة مما يسمح بتتبع الأنواع الكيميائية الموسومة بالفلورسنت كميا بدقة جانبية دون الميكرون.
Introduction
واجهات الهواء والماء التي تغطيها أفلام الفاعل بالسطح منتشرة في كل مكان في الحياة اليومية. تستخدم حقن المياه الخافضة للتوتر السطحي لتعزيز استخراج النفط من الحقول المستنفدة وتستخدم كحلول تكسير هيدروليكي للغاز الصخري والنفط. الرغاوي الغازية السائلة والمستحلبات السائلة السائلة شائعة في العديد من العمليات الصناعية والعلمية كمواد تشحيم وعوامل تنظيف وهي شائعة في الغذاء. تعمل المواد الخافضة للتوتر السطحي والبروتينات في الواجهات على استقرار تكوينات الأجسام المضادة أثناء التعبئة والتغليف والتخزين والإدارة 1,2,3,4,5 ، واستقرار الفيلم المسيل للدموع في العين 6,7,8 ، والميكانيكا الرئوية 9,10,11,12,13,14 ، 15.
دراسة العوامل النشطة على السطح أو المواد الخافضة للتوتر السطحي التي تمتص الواجهات وخصائصها لها تاريخ طويل مع العديد من التقنيات التجريبية المختلفة 16،17،18،19،20،21،22،23،24،25،26،27 . أحد التطورات الحديثة هو مقياس الضغط الشعري الدقيق (CPM) ، والذي يسمح بفحص الخصائص البينية على واجهات منحنية للغاية ، على مقاييس طول أصغر بكثير ، مع استخدام مواد أقل بكثير من الطرق الشائعة الأخرى 9,23,24,25. يمكن استخدام المجهر الفلوري البؤري (CFM) لدراسة مورفولوجيا الدهون والبروتينات في واجهات الهواء والماء في CPM22 أو في أحواض Langmuir20,26,27,28,29. هنا تم الجمع بين CPM و CFM لربط الظواهر المورفولوجية بالخصائص البينية الديناميكية والمتوازنة لتطوير علاقات بين البنية والوظيفة للواجهات البيولوجية والتكنولوجية.
هناك العديد من المعلمات ذات الأهمية في أنظمة الفاعل بالسطح البينية التي يمكن الوصول إليها من قبل CPM-CFM. في CPM ، يتم تثبيت فقاعة هواء قطرها 30-200 ميكرومتر على طرف أنبوب شعري زجاجي. في الإصدارات السابقة من CPM ، تم التحكم في فرق الضغط الشعري بين داخل وخارج الفقاعة عبر عمود ماء ومضخة حقنة متذبذبة 9,30 ؛ الإصدار الجديد الموصوف هنا يحل محلها مضخة ميكروفلويديك عالية الدقة يتم التحكم فيها بواسطة الكمبيوتر. يتم تحديد التوتر السطحي (γ) عبر معادلة لابلاس ، ΔP = 2γ / R ، من انخفاض الضغط عبر الواجهة التي تحددها المضخة ، ΔP ، والتحليل البصري لنصف قطر انحناء الفقاعة ، R. يمكن تحديد التوتر السطحي الديناميكي للواجهة بدقة زمنية تبلغ 10 مللي ثانية بعد توليد فقاعة جديدة تتلامس مع سائل سائب يحتوي على خافض للتوتر السطحي قابل للذوبان. يمكن وصف ديناميكيات الامتزاز السطحي بواسطة معادلة وارد-تورداي الكلاسيكية10,31 لتحديد الخصائص الأساسية للفاعل بالسطح، بما في ذلك الانتشار والتغطية السطحية والعلاقة بين التركيز السائب والتوتر السطحي التوازني. بمجرد تحقيق التوتر السطحي المتوازن ، يمكن تذبذب المنطقة البينية لقياس معامل التمدد ، عن طريق تسجيل التغيرات في التوتر السطحي ، الناجمة عن التغيرات الصغيرة في مساحة سطح الفقاعة ، 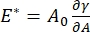 A32. بالنسبة للواجهات الأكثر تعقيدا التي تطور هياكلها الداخلية الخاصة مثل البوليمرات أو البروتينات المتشابكة ، يتم استبدال التوتر السطحي ، بإجهاد سطحي أكثر عمومية 4,33 ،
A32. بالنسبة للواجهات الأكثر تعقيدا التي تطور هياكلها الداخلية الخاصة مثل البوليمرات أو البروتينات المتشابكة ، يتم استبدال التوتر السطحي ، بإجهاد سطحي أكثر عمومية 4,33 ، 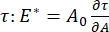 .
.
قد يرتبط استقرار الرئة أثناء التنفس ارتباطا مباشرا بالحفاظ على كل من التوتر السطحي المنخفض ومعامل التمدد العالي في واجهة الهواء السائل السنخية 9,10. تصطف جميع أسطح الرئة الداخلية بطبقة مستمرة بسماكة ميكرون من سائل البطانة الظهارية للحفاظ على ترطيب الأنسجة34. سائل البطانة الظهاري هذا هو الماء في المقام الأول ، مع الأملاح والعديد من البروتينات الأخرى والإنزيمات والسكريات والفاعل بالسطح الرئوي. كما هو الحال بالنسبة لأي واجهة منحنية بين بخار السائل ، يتم تحفيز الضغط الشعري مع ارتفاع الضغط داخل الحويصلات الهوائية (أو الفقاعة). ومع ذلك ، إذا كان التوتر السطحي ثابتا في كل مكان داخل الرئتين ، فإن معادلة لابلاس ، ΔP = 2γ / R ، توضح أن الحويصلات الهوائية الأصغر سيكون لها ضغط داخلي أعلى مقارنة بالحويصلات الهوائية الأكبر ، مما يجبر محتويات الغاز في الحويصلات الهوائية الأصغر على التدفق إلى الحويصلات الهوائية الأكبر والأقل ضغطا. يعرف هذا باسم “عدم استقرار لابلاس”9,35. والنتيجة الصافية هي أن أصغر الحويصلات الهوائية سوف تنهار وتمتلئ بالسائل ويصبح من الصعب إعادة تضخيمها مما يتسبب في انهيار جزء من الرئة ، وأجزاء أخرى سوف تتضخم بشكل مفرط ، وكلاهما من الأعراض النموذجية لمتلازمة الضائقة التنفسية الحادة (ARDS). ومع ذلك ، في الرئة التي تعمل بشكل صحيح ، يتغير التوتر السطحي ديناميكيا حيث تتوسع واجهة السائل الظهاري الهوائي في منطقة الوجه الأسناخ وتتقلص أثناء التنفس. إذا 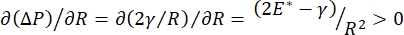 ، أو
، أو 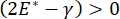 ، ينخفض ضغط لابلاس مع انخفاض نصف القطر ويزداد مع زيادة نصف القطر وذلك للقضاء على عدم استقرار لابلاس ، وبالتالي استقرار الرئة9. وبالتالي ،
، ينخفض ضغط لابلاس مع انخفاض نصف القطر ويزداد مع زيادة نصف القطر وذلك للقضاء على عدم استقرار لابلاس ، وبالتالي استقرار الرئة9. وبالتالي ، 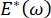 وكيف يعتمد على التردد ، قد يكون مورفولوجيا الطبقة الأحادية وتكوينها ، وتكوين السائل السنخي ضروريا لاستقرار الرئة. كما قدم CPM-CFM أول عروض توضيحية لآثار الانحناء بين الوجوه على الامتزاز السطحي25 ، ومورفولوجيا الطبقة الأحادية22 ومعامل التمدد9. يسمح الحجم الصغير (~ 1 مل) للخزان في CPM بالإدخال السريع أو الإزالة أو التبادل للطور السائل ويقلل من الكمية المطلوبة من البروتينات باهظة الثمن أو المواد الخافضة للتوتر السطحي10.
وكيف يعتمد على التردد ، قد يكون مورفولوجيا الطبقة الأحادية وتكوينها ، وتكوين السائل السنخي ضروريا لاستقرار الرئة. كما قدم CPM-CFM أول عروض توضيحية لآثار الانحناء بين الوجوه على الامتزاز السطحي25 ، ومورفولوجيا الطبقة الأحادية22 ومعامل التمدد9. يسمح الحجم الصغير (~ 1 مل) للخزان في CPM بالإدخال السريع أو الإزالة أو التبادل للطور السائل ويقلل من الكمية المطلوبة من البروتينات باهظة الثمن أو المواد الخافضة للتوتر السطحي10.
يرجع التباين في صورة CPM-CFM إلى توزيع أجزاء صغيرة من الدهون أو البروتينات الموسومة بالفلورسنت في الواجهة16,27. غالبا ما تظهر الطبقات الأحادية الفاعل بالسطح ثنائية الأبعاد فصل الطور الجانبي كدالة للتوتر السطحي أو الضغط السطحي ، π هو الفرق بين التوتر السطحي لواجهة سائلة سائلة نظيفة ، γ 0 ، وواجهة مغطاة بالفاعل بالسطح ، 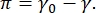 γ. يمكن اعتبار π على أنه “الضغط” 2-D الناجم عن تفاعلات جزيئات الفاعل بالسطح في الواجهة التي تعمل على خفض التوتر السطحي للسائل النقي. في الضغوط السطحية المنخفضة ، تكون الطبقات الأحادية الدهنية في حالة غير منظمة تشبه السائل. يعرف هذا باسم مرحلة السائل الموسع (LE). مع زيادة الضغط السطحي وانخفاض المساحة لكل جزيء دهني ، تتجه الدهون مع بعضها البعض ويمكن أن تخضع لمرحلة انتقالية من الدرجة الأولى إلى المرحلة المكثفة السائلة طويلة المدى (LC)16،20،27. يمكن أن تتعايش مرحلتا LE وLC عند ضغوط سطحية مختلفة ويمكن تصورهما على أنهما يستبعدان الدهون الموسومة بالفلورسنت من مرحلة LC وينفصلان عن مرحلة LE. وبالتالي ، فإن مرحلة LE مشرقة ومرحلة LC مظلمة عند تصويرها باستخدام CFM16.
γ. يمكن اعتبار π على أنه “الضغط” 2-D الناجم عن تفاعلات جزيئات الفاعل بالسطح في الواجهة التي تعمل على خفض التوتر السطحي للسائل النقي. في الضغوط السطحية المنخفضة ، تكون الطبقات الأحادية الدهنية في حالة غير منظمة تشبه السائل. يعرف هذا باسم مرحلة السائل الموسع (LE). مع زيادة الضغط السطحي وانخفاض المساحة لكل جزيء دهني ، تتجه الدهون مع بعضها البعض ويمكن أن تخضع لمرحلة انتقالية من الدرجة الأولى إلى المرحلة المكثفة السائلة طويلة المدى (LC)16،20،27. يمكن أن تتعايش مرحلتا LE وLC عند ضغوط سطحية مختلفة ويمكن تصورهما على أنهما يستبعدان الدهون الموسومة بالفلورسنت من مرحلة LC وينفصلان عن مرحلة LE. وبالتالي ، فإن مرحلة LE مشرقة ومرحلة LC مظلمة عند تصويرها باستخدام CFM16.
الهدف من هذه المخطوطة هو وصف الخطوات اللازمة لبناء وتشغيل مقياس التمدد المجهري البؤري المشترك. سيسمح ذلك للقارئ بإجراء دراسات الامتزاز ، وقياس التوتر السطحي ، والسلوك الريولوجي ، وفحص المورفولوجيا بين الوجوه في وقت واحد على واجهة هواء / ماء أو زيت / ماء على نطاق ميكرون. ويشمل ذلك مناقشة كيفية سحب الشعيرات الدموية المطلوبة وقطعها وكرهها للماء ، وتعليمات لاستخدام أوضاع التحكم في الضغط والانحناء ومساحة السطح ، والنقل البيني للفاعل بالسطح غير القابل للذوبان إلى الواجهة المنحنية لمقياس التوتر الدقيق.
Protocol
Representative Results
Discussion
يعد CPM / CFM مجتمعين أداة قوية لفحص الديناميكيات البينية والتوازنات والمورفولوجيا. يصف هذا البروتوكول الخطوات اللازمة للحصول على البيانات باستخدام CPM/CFM.
يوضح الشكل 2 تصميم الخلية مع قنوات للشفرات الدموية والمذيبات والتبادل الحراري المشار إليها. يجب أن يكون م?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
تم الحصول على جميع صور المجهر البؤري باستخدام المجهر البؤري المستقيم A1RHD من نيكون. نحن نعترف بتوجيه ومساعدة موظفي الدعم ، وخاصة غييرمو ماركيز ، في مركز التصوير الجامعي في جامعة مينيسوتا. تم دعم هذا العمل من قبل NIH Grant HL51177. تم دعم SI من قبل منحة تدريب البحوث المؤسسية من Ruth L. Kirschstein NRSA F32 HL151128.
Materials
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ – cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL – 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Referencias
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44 (2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al., Ramachadran, A., et al. . Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. , (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., Nag, K., et al. . Surfactant Progress. , (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604 (2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. . Physical Chemistry of Surfaces, Sixth ed. , 784 (1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14 (2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115 (2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).

