免疫組織化学による異常プリオンタンパク質の検出
Summary
免疫組織化学プロトコルを使用して異常なプリオンタンパク質を免疫標識するには、特定のサンプルおよび抗PrP抗体調製方法が必要です。本プロトコルは、適切なPrP免疫標識を確保し、非特異的バックグラウンド染色を最小限に抑えるためのエピトープデマスキングの重要なステップを説明しています。また、このアプローチは、プリオン感染組織を用いて免疫組織化学研究を行う際のバイオセーフティ対策を考慮する。
Abstract
異常プリオンタンパク質(PrPSc)は、細胞プリオンタンパク質の疾患関連アイソフォームであり、伝染性海綿状脳症(TSE)の診断マーカーです。これらの神経変性疾患は、ヒトおよびいくつかの動物種に影響を及ぼし、スクレイピー、人獣共通感染症のウシ海綿状脳症(BSE)、子宮頸部の慢性消耗性疾患(CWD)、および新たに特定されたラクダプリオン病(CPD)が含まれます。TSEの診断は、脳組織、すなわち脳幹(obexレベル)に対する免疫組織化学(IHC)およびウェスタンイムノブロット法(WB)の両方の適用によるPrPSc の免疫検出に依存しています。IHCは、組織切片の細胞における目的の抗原に対する一次抗体(モノクローナルまたはポリクローナル)を使用する広く使用されている方法です。抗体-抗原結合は、抗体が標的となった組織または細胞の領域に局在したままの呈色反応によって視覚化することができる。このように、プリオン病では、他の研究分野と同様に、免疫組織化学技術は診断目的だけでなく、病因研究にも使用されます。このような研究は、新しいプリオン株を同定するために、前述のものからPrPSc パターンおよびタイプを検出することを含む。BSEはヒトに感染する可能性があるため、東証サーベイランスに含まれる牛、小型反芻動物、および子宮頸管サンプルの取り扱いには、バイオセーフティ研究所レベル3(BSL-3)の施設および/または診療所を使用することが推奨されます。さらに、汚染を制限するために、可能な限り封じ込めおよびプリオン専用装置が推奨されます。PrPSc IHC手順は、この技術で使用されるホルマリン固定およびパラフィン包埋組織が感染性のままであるため、プリオン不活化手段としても機能するギ酸エピトープデマスキングステップで構成されています。結果を解釈する際には、非特異的免疫標識と標的標識を区別するように注意する必要があります。この目的のために、既知のTSE陰性対照動物において得られた免疫標識のアーティファクトを認識し、それらを特定のPrPSc 免疫標識タイプから区別することが重要であり、これはTSE株、宿主種、および prnp 遺伝子型の間で異なり得る。
Introduction
プリオン仮説によれば、異常なアイソフォーム(PrPSc)は、伝染性海綿状脳症(TSE)における感染因子の主要な、または唯一の成分です。TSEの診断の確認は、脳組織の免疫組織化学(IHC)プロトコルおよび/またはウェスタンイムノブロット法(WB)の適用によるPrPSc の免疫検出に依存しています1。
IHCは、組織切片の細胞にある目的の特異的標的抗原の免疫染色の最初のステップとして、モノクローナル抗体または場合によってはポリクローナル抗体(一次抗体として)を使用する方法です。次に、一次抗体に特異的な二次抗体を使用して、有効な一次抗体-抗原結合を視覚化します。これらの二次抗体は、西洋ワサビペルオキシダーゼ(HRP)やアルカリホスファターゼ(AP)などの酵素に結合しています。次に、これらの酵素に基質を添加し、一次抗体が標的抗原に結合している領域に局在する不溶性カラー生成物を生成することによって、視覚化が達成されます。改善された可視化は、対比染色によって達成することができ、ここで、色素は、免疫標識組織と非免疫標識組織との間のコントラストを作り出すために使用される2。
ホルマリン固定パラフィン包埋組織(FFPE)を用いたIHCでは、ホルマリン固定は、ホルムアルデヒドによる架橋やパラフィン包埋時の加熱脱水により、一次抗体の有効性を無効にする可能性があります。これらはタンパク質の立体構造を変化させ、エピトープを破壊、変性、またはマスクし、したがってそれらの検出を減少または消失させる3。そのため、これには抗原賦活化(AR)が必要です。AR技術は、抗原分子内のホルムアルデヒド関連の化学基架橋を破壊し、元の抗原-タンパク質立体構造を復元またはマスク解除します。これにより、免疫標識に対する抗体抗原(エピトープ)親和性が回復します。ARの最終的な有効性は、標的抗原および/または一次抗体の品質に依存します2。
熱誘導抗原(エピトープ)賦活化(HIER)は、AR3 の1つの手順であり、本明細書に記載されるように、PrPSc IHC検出のために日常的に使用される。IHCは診断に不可欠であり、病理学関連抗原の組織分布を決定するために研究室で使用されます。がん、神経科学、感染症の診断と研究に広く使用されています4。東証にとってIHCは、自然宿主や実験モデルにおけるPrPSc 分布を確認・調査するための診断・研究において重要な役割を果たしています。IHCは、プリオン病因研究およびPrPSc 沈着のタイプおよびパターンの分析、すなわち神経組織5において、日常的に記載されている感染からの逸脱を検出し、推定される新しいプリオン株を特定することに貢献する。
牛海綿状脳症(BSE)のプリオンはヒトに感染する可能性があるため、BSEの作業に関与する特定の検査プロトコルでは、BSL-3施設および実践の使用が必要になる場合があります6。これには、BSE感染の可能性のある組織サンプルを研究所や実験室内で輸送するための密閉された二次容器の使用が含まれます。また、可能な限り、BSEの研究と分析のための封じ込めエリアとプリオン専用機器を指定することも含まれます。これは、作業エリア外の汚染を防ぎ、除染手順が必要になるため、限られたスペースを提供するために行われます。
したがって、INIAVの病理学研究所は、TSEサーベイランスに関連する牛、小型反芻動物、および子宮頸管からの組織の潜在的なプリオン感染サンプルを管理するために、推奨されるバイオセーフティレベル3(BSL-3)施設および慣行6 に従います。
TSEの診断または研究手順に含まれるホルマリン固定およびパラフィン包埋組織は、特に中枢神経系において、潜在的に感染性である可能性があります。したがって、これらの固定組織は、組織処理の前にプリオンが存在する場合は、その感染力を低下させるためにギ酸で処理する必要があります。これは、固定されたトリミングされた組織(厚さ約2〜4 mm)を加工カセットに入れることによって行われます。次いで、カセットを98%ギ酸に浸す(1時間)。浸漬後、ティッシュを含むカセットを水道水で30分間洗浄し、さらに処理する前に固定液に戻します。組織切片が処理前に処理されない場合、組織学的染色の前に、ミクロトミック後の組織切片を希釈されていないギ酸に少なくとも5分間浸す必要があります7。PrPSc のためのIHCプロトコルは、プリオン7を不活性化する役割を果たすルーチンのギ酸エピトープデマスキング工程を含む。これらのプリオン不活性化ステップの後、得られた固定組織は、次いで、標準的なBSL-2慣行を用いてBSL-2で処理することができる。
TSEサーベイランスに含まれる動物のTSE診断の最小組織サンプリング要件は、脳幹を(obexレベルで)収集することです。さらに、非定型BSEとスクレイピーを検出するには、小脳の一部も収集することをお勧めします1,8。CWD診断では、脳幹(obex)と後咽頭リンパ節の両方を検査する必要があります PrP Scはリンパ組織で検出され、obex9では検出可能なPrPScがなかったため、Machado et al.10によってレビューされました。
脳幹の肛骨部分は、診断用TSE標的部位、すなわち、背迷走神経核(DVN)、孤立性路核(STN)および三叉神経の脊髄核(V)を含む。これらの地域は、BSEや古典的なスクレイピーの初期段階においても、一貫して二国間のPrPSc 蓄積を示しています。進行性TSEの臨床例では、脳幹内のすべての灰白質領域が広範囲のPrPSc 分布を示しています11。
切片作成と処理の前に、脳サンプルを評価し(図1)、自己消化のレベルと、IHCベースの確認診断へのサンプルの適合性を損なう可能性のある組織損傷の存在を確認します8。分取プロトコルと分析結果の完全性を検証するために、TSE陽性および陰性組織サンプルは、各アッセイのテストケースからの組織の調製と併せてコントロールとして含まれます。
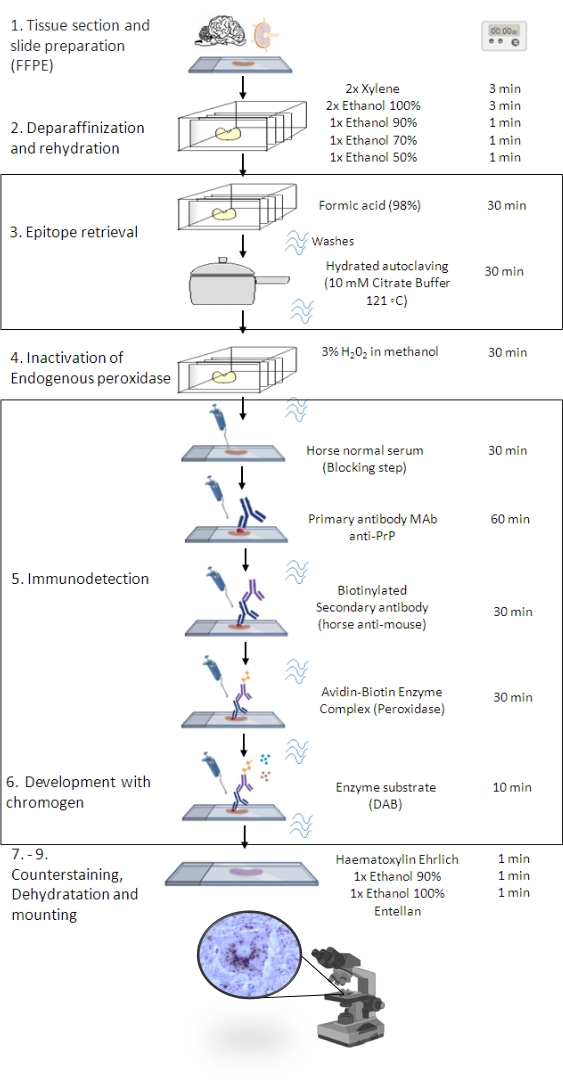
図1:PrPSc IHC手順。 組織切片の脱パラフィンから最終的な免疫染色および検出までのPrPSc IHC手順の段階的なシーケンスを示す表現(FFPE-ホルマリン固定パラフィン包埋;マブ – モノクローナル抗体。DAB – 3,3’ジアミノベンジジン)。この図は BioRender.com 年に作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
TSEは潜在的な人獣共通感染症です。1986年に英国でBSEが出現した後、ポルトガルはこの病気の発生率が高い欧州連合加盟国の1つになりました14,15。この病気を制御するために、出現した他のTSE(古典的および非定型のスクレイピー、BSEバリアント、および現在は子宮頸管の慢性消耗性疾患のサーベイランス)、食品獣医総局(DGAV)および国立農業獣医研?…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
この記事は、FCT(Fundação para a Ciência e a Tecnologia)-FEDER -Balcão2020の支援を受けたプロジェクトPOCI-01-0145-FEDER-029947「ポルトガルにおける慢性消耗性疾患リスク評価」によって資金提供されました。また、研究ユニットCECAVの著者は、プロジェクトUIDB/CVT/0772/2020の下でFCTから資金提供を受けました。
Materials
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase |
Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use |
||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum |
Gibco |
16050-122 |
Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. |
||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. |
||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
Referencias
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. – Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).

