RGBradford: Eiwitkwantificering met een smartphonecamera
Summary
Dit artikel biedt een protocol voor eiwitkwantificering met behulp van de Bradford-test en een smartphone als analytisch apparaat. Eiwitniveaus in monsters kunnen worden gekwantificeerd met behulp van kleurgegevens die zijn geëxtraheerd uit een foto van een microplaat die met een smartphone is gemaakt.
Abstract
Eiwitkwantificering is een essentiële procedure in biowetenschappelijk onderzoek. Van de verschillende andere methoden is de Bradford-test een van de meest gebruikte. Vanwege de wijdverbreide verspreiding zijn de beperkingen en voordelen van de Bradford-test uitputtend gerapporteerd, inclusief verschillende wijzigingen van de oorspronkelijke methode om de prestaties te verbeteren. Een van de wijzigingen ten opzichte van de oorspronkelijke methode is het gebruik van een smartphonecamera als analytisch instrument. Door gebruik te maken van de drie vormen van de Coomassie Brilliant Blue-kleurstof die bestaan in de omstandigheden van de Bradford-test, beschrijft dit artikel hoe eiwit in monsters nauwkeurig kan worden gekwantificeerd met behulp van kleurgegevens die zijn geëxtraheerd uit een enkele afbeelding van een microplaat. Na het uitvoeren van de test in een microtiterplaat, wordt een foto gemaakt met behulp van een smartphonecamera en worden RGB-kleurgegevens uit de foto geëxtraheerd met behulp van een gratis en open-source softwaretoepassing voor beeldanalyse. Vervolgens wordt de verhouding tussen blauwe en groene intensiteit (in de RGB-schaal) van monsters met onbekende eiwitconcentraties gebruikt om het eiwitgehalte te berekenen op basis van een standaardcurve. Er wordt geen significant verschil waargenomen tussen waarden die zijn berekend met behulp van RGB-kleurgegevens en waarden die zijn berekend met conventionele absorptiegegevens.
Introduction
Ongeacht het stroomafwaartse gebruik (bijv. ELISA, enzymkinetiek, western blotting, eiwitzuivering en massaspectrometrie), is eiwitkwantificering cruciaal voor nauwkeurige analyse in biowetenschappelijke laboratoria. Naast het gebruik ervan als secundaire uitlezingen (d.w.z. om de relatieve niveaus van analyten per massa eiwit te berekenen), kunnen eiwitniveaus in een monster ook de gewenste output zelf zijn. Men kan bijvoorbeeld geïnteresseerd zijn in het eiwitgehalte in voedselbronnen1 of in urine2. Er zijn veel methoden beschikbaar om de eiwitconcentratie in monsters3 te meten, waaronder directe UV-absorptiemetingen4, eiwit-koperchelatie 5,6, eiwit-kleurstofbindende colorimetrische assays7 en eiwit-kleurstofbindende fluorescerende assays8. De relevantie van eiwitkwantificering blijkt uit de aanwezigheid van twee artikelen die eiwitmeetmethodenbeschrijven 5,7 in de top-3 van de meest geciteerde literatuur 9,10. Ondanks het feit dat veel auteurs hun eigenlijke citaat verwaarlozen door niet-primaire referenties te citeren of helemaal niets te citeren, bedragen de originele artikelen die de Lowry-eiwittest en de Bradford-eiwittest beschrijven elk > 200.000 citaties.
De populariteit van de Bradford-test komt voort uit de betaalbaarheid, eenvoud, snelheid en gevoeligheid. De test is gebaseerd op de interactie tussen eiwitten en de kleurstof Coomassie Brilliant Blue G onder zure omstandigheden. Onder de omstandigheden van de test (d.w.z. lage pH) bestaat de kleurstof in drie vormen: een rode kationische vorm met λmax bij 470 nm; een groene neutrale vorm met λmax bij 650 nm; en een blauwe anionische vorm met λmax bij 590 nm11,12 (Figuur 1). De kationische vorm overheerst bij afwezigheid van eiwitten. Terwijl eiwitten interageren met de kleurstof, stabiliseren ze de blauwe anionische vorm, waardoor een merkbare verandering in de kleur van de oplossing ontstaat, van bruinachtig naar blauw. Gewoonlijk wordt de verandering in de concentratie van de blauwe vorm van de kleurstof spectrofotometrisch gekwantificeerd, waarvan de absorptie bij 590-595 nm evenredig is met de hoeveelheid eiwit in de test.
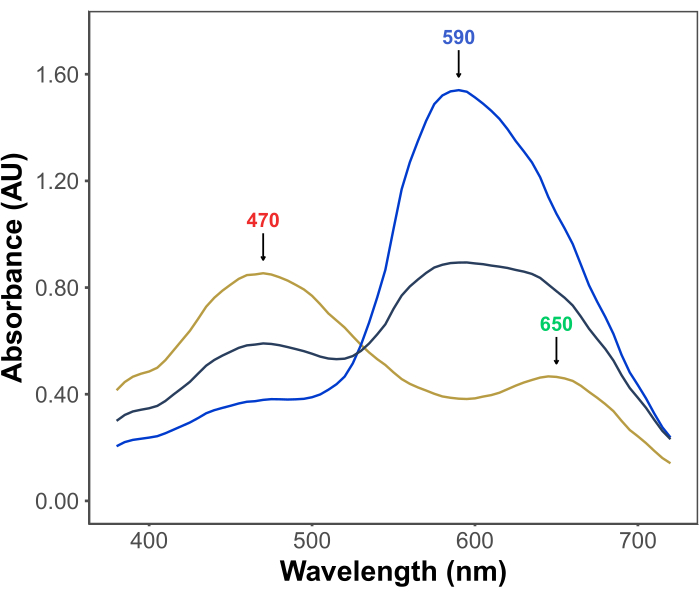
Figuur 1: Coomassie briljantblauwe G-absorptiespectra onder de omstandigheden van de Bradford-test. De drie hoofdpieken zijn gemarkeerd met pijlen die de λmax aangeven van de rode (470 nm), groene (650 nm) en blauwe (590 nm) vormen van de kleurstof. Spectra werden geregistreerd in afwezigheid van eiwit (gele lijn) en in aanwezigheid van 3 μg (grijze lijn) en 10 μg (blauwe lijn) runderserumalbumine. Klik hier om een grotere versie van deze figuur te bekijken.
Het wijdverbreide gebruik van de Bradford-test heeft geleid tot de identificatie van verschillende beperkingen (bijv. variabele reacties op verschillende eiwitten11 en interferentie door lipiden13 en wasmiddelen7) en de ontwikkeling van modificaties om de prestaties ervan te verbeteren (bijv. de toevoeging van wasmiddelen14,15, alkalinisatie14,16 en gebruik van de verhouding van absorptie17). Naast aanpassingen in de test zelf, is ook het gebruik van alternatieve apparaten, zoals smartphones of camera’s, om analytische signalen op te vangen beschreven 18,19,20. De ontwikkeling van methoden die gebruik maken van smartphones als draagbare chemische analysatoren is inderdaad een actief onderzoeksgebied geweest. De motivatie voor het gebruik van smartphones komt voort uit de betaalbaarheid, draagbaarheid, gebruiksgemak en wijdverbreide beschikbaarheid van deze apparaten.
Dit artikel biedt een protocol voor eiwitkwantificering met behulp van de RGBradford-assay20, die een smartphone als analytisch apparaat gebruikt. In tegenstelling tot de originele RGBradford-publicatie20 is hier een procedure geïntroduceerd die het kleurextractieproces stroomlijnt. Het omvat het gebruik van een vrij beschikbare softwaretoepassing om automatisch kleurinformatie uit elk putje van een microplaatafbeelding te extraheren, wat veel tijd en moeite bespaart. Dit is een alternatief voor de vorige methode om handmatig één voor één kleurgegevens uit elk putje te verkrijgen met behulp van een softwaretoepassing voor grafische editor20. Uiteindelijk kunnen eiwitniveaus in monsters worden gekwantificeerd met behulp van kleurgegevens die zijn geëxtraheerd uit een foto van een microplaat die met een smartphone is gemaakt.
Protocol
Representative Results
Discussion
Dit artikel beschrijft RGBradford, een methode die een smartphonecamera gebruikt om gegevens van een Bradford-eiwittest vast te leggen, kleurgegevens te extraheren en eiwitniveaus in biologische monsters nauwkeurig te kwantificeren, zoals oorspronkelijk onlangs beschreven20. Een verschil met de originele RGBradford-methode is dat hier een procedure werd gebruikt voor het automatisch verkrijgen van kleurgegevens met een ImageJ-plug-in22 . De belangrijkste nieuwigheid van de …
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Dit werk werd gefinancierd door de Nationale Raad voor Wetenschappelijke en Technologische Ontwikkeling (CNPq, Brazilië) [subsidienummers 428048/2018-8 en 402556/2022-4] en de Universiteit van Brasilia (Brazilië). De auteur bedankt Dr. Duarte Nuno Carvalho en Dr. Evelyn Santos (i3s, Porto, Portugal) voor het beschikbaar stellen van toegang tot hun smartphones die in dit onderzoek zijn gebruikt.
Materials
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
Referencias
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).

