RGBradford: quantificazione delle proteine con la fotocamera di uno smartphone
Summary
Questo documento fornisce un protocollo per la quantificazione delle proteine utilizzando il saggio di Bradford e uno smartphone come dispositivo analitico. I livelli di proteine nei campioni possono essere quantificati utilizzando i dati a colori estratti da un’immagine di una micropiastra scattata con uno smartphone.
Abstract
La quantificazione delle proteine è una procedura essenziale nella ricerca nel campo delle scienze della vita. Tra i molti altri metodi, il test di Bradford è uno dei più utilizzati. A causa della sua diffusione, i limiti e i vantaggi del test di Bradford sono stati riportati in modo esaustivo, comprese diverse modifiche al metodo originale per migliorarne le prestazioni. Una delle modifiche del metodo originale è l’uso della fotocamera di uno smartphone come strumento analitico. Sfruttando le tre forme del colorante Coomassie Brilliant Blue che esistono nelle condizioni del saggio di Bradford, questo documento descrive come quantificare con precisione le proteine nei campioni utilizzando i dati cromatici estratti da una singola immagine di una micropiastra. Dopo aver eseguito il test in una micropiastra, viene scattata un’immagine utilizzando la fotocamera di uno smartphone e i dati di colore RGB vengono estratti dall’immagine utilizzando un’applicazione software di analisi delle immagini gratuita e open-source. Quindi, il rapporto tra l’intensità blu e verde (nella scala RGB) di campioni con concentrazioni sconosciute di proteine viene utilizzato per calcolare il contenuto proteico in base a una curva standard. Non si osserva alcuna differenza significativa tra i valori calcolati utilizzando i dati di colore RGB e quelli calcolati utilizzando i dati di assorbanza convenzionali.
Introduction
Indipendentemente dall’uso a valle (ad esempio, ELISA, cinetica enzimatica, western blotting, purificazione delle proteine e spettrometria di massa), la quantificazione delle proteine è fondamentale per un’analisi accurata nei laboratori di scienze biologiche. Oltre al loro utilizzo come letture secondarie (ad esempio, per calcolare i livelli relativi di analiti per massa di proteine), i livelli di proteine in un campione possono anche essere l’output desiderato. Ad esempio, si può essere interessati ai livelli di proteine nelle risorse alimentari1 o nelle urine2. Sono disponibili molti metodi per misurare la concentrazione di proteine nei campioni3, tra cui le letture dirette dell’assorbanza UV4, la chelazione proteina-rame 5,6, i saggi colorimetrici di legame proteina-colorante7 e i saggi fluorescenti di legame proteina-colorante8. L’importanza della quantificazione delle proteine è evidenziata dalla presenza di due articoli che descrivono i metodi di misurazione delle proteine 5,7 nella top-3 della letteratura più citata 9,10. Nonostante il fatto che molti autori trascurino la loro citazione effettiva citando riferimenti non primari o non citando nulla, gli articoli originali che descrivono il saggio della proteina di Lowry e il saggio della proteina di Bradford ammontano > 200.000 citazioni ciascuno10.
La popolarità del test di Bradford deriva dalla sua convenienza, semplicità, velocità e sensibilità. Il test si basa sull’interazione tra le proteine e il colorante Coomassie Brilliant Blue G in condizioni acide. Nelle condizioni del saggio (cioè pH basso), il colorante esiste in tre forme: una forma cationica rossa con λmax a 470 nm; una forma neutra verde con λmax a 650 nm; e una forma anionica blu con λmax a 590 nm11,12 (Figura 1). La forma cationica predomina in assenza di proteine. Quando le proteine interagiscono con il colorante, stabilizzano la forma anionica blu, causando un notevole cambiamento nel colore della soluzione, da brunastro a blu. Di solito, la variazione della concentrazione della forma blu del colorante viene quantificata spettrofotometricamente, la cui assorbanza a 590-595 nm è proporzionale alla quantità di proteina nel saggio.
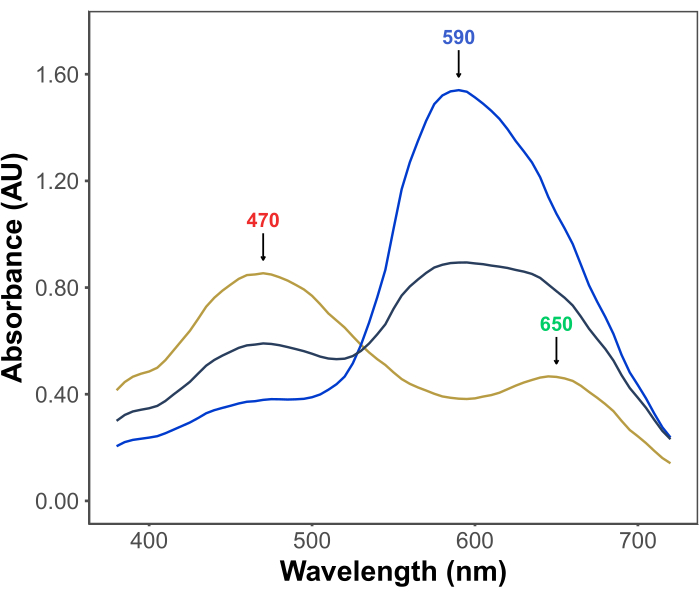
Figura 1: Spettri di assorbimento G blu brillante di Coomassie nelle condizioni del saggio di Bradford. I tre picchi principali sono contrassegnati da frecce che indicano il λmax delle forme rossa (470 nm), verde (650 nm) e blu (590 nm) del colorante. Gli spettri sono stati registrati in assenza di proteine (linea gialla) e in presenza di 3 μg (linea grigia) e 10 μg (linea blu) di albumina sierica bovina. Fare clic qui per visualizzare una versione più grande di questa figura.
L’uso diffuso del saggio di Bradford ha portato all’identificazione di diverse limitazioni (ad esempio, risposte variabili a diverse proteine11 e interferenza da parte di lipidi13 e detergenti7) e allo sviluppo di modifiche per migliorarne le prestazioni (ad esempio, l’aggiunta di detergenti14,15, l’alcalinizzazione14,16 e l’uso del rapporto di assorbanza17). Oltre alle modifiche nel saggio stesso, è stato descritto anche l’uso di dispositivi alternativi, come smartphone o fotocamere, per catturare i segnali analitici 18,19,20. In effetti, lo sviluppo di metodi che utilizzano gli smartphone come analizzatori chimici portatili è stata un’area di ricerca attiva. La motivazione per l’uso degli smartphone deriva dall’accessibilità, dalla portabilità, dalla facilità d’uso e dall’ampia disponibilità di questi dispositivi.
Questo documento fornisce un protocollo per la quantificazione delle proteine utilizzando il saggio RGBradford20, che utilizza uno smartphone come dispositivo analitico. A differenza della pubblicazione originaleRGBradford 20, qui è stata introdotta una procedura che semplifica il processo di estrazione del colore. Comporta l’utilizzo di un’applicazione software disponibile gratuitamente per estrarre automaticamente le informazioni sul colore da ciascun pozzetto di un’immagine per micropiastre, risparmiando tempo e fatica significativi. Si tratta di un’alternativa al metodo precedente di acquisizione manuale dei dati di colore da ciascun pozzetto uno per uno utilizzando un’applicazione software di editor grafico20. In definitiva, i livelli di proteine nei campioni possono essere quantificati utilizzando i dati a colori estratti da un’immagine di una micropiastra scattata con uno smartphone.
Protocol
Representative Results
Discussion
Questo documento descrive RGBradford, un metodo che utilizza la fotocamera di uno smartphone per registrare i dati di un test proteico Bradford, estrarre i dati cromatici e quantificare con precisione i livelli di proteine nei campioni biologici, come originariamente descritto di recente20. Una differenza rispetto al metodo originale RGBradford è che in questo caso è stata utilizzata una procedura per ottenere automaticamente i dati di colore con un plug-in ImageJ22 . La …
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato finanziato dal Consiglio Nazionale per lo Sviluppo Scientifico e Tecnologico (CNPq, Brasile) [numeri di sovvenzione 428048/2018-8 e 402556/2022-4] e dall’Università di Brasilia (Brasile). L’autore ringrazia il Dr. Duarte Nuno Carvalho e la Dr.ssa Evelyn Santos (i3s, Porto, Portogallo) per aver fornito l’accesso ai loro smartphone utilizzati in questa ricerca.
Materials
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
Referencias
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).

