4.5:
Concentração e Diluição de Soluções
4.5:
Concentração e Diluição de Soluções
A quantidade relativa de um determinado componente da solução é conhecida como a sua concentração. Muitas vezes, embora nem sempre, uma solução contém um componente com uma concentração significativamente maior do que a de todos os outros componentes. Este componente é chamado de solvente e pode ser visto como o meio no qual os outros componentes estão dispersos ou dissolvidos. As soluções em que a água é o solvente são, naturalmente, muito comuns no nosso planeta. Uma solução na qual a água é o solvente é chamada de solução aquosa.
Um soluto é um componente de uma solução que normalmente está presente com uma concentração muito inferior à do solvente. As concentrações de solutos são frequentemente descritas em termos qualitativos, tais como diluídos (de concentração relativamente baixa) e concentrados (de concentração relativamente elevada).
As concentrações podem ser avaliadas quantitativamente utilizando uma grande variedade de unidades de medição, cada uma conveniente para aplicações específicas. A molaridade (M) é uma unidade de concentração útil para muitas aplicações em química. A molaridade é definida como o número de moles de soluto em exactamente 1 litro (1 L) da solução e tem as unidades de ‘mol/L’.
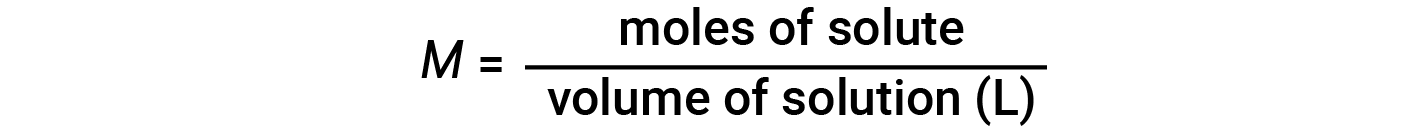
Note-se que na equação da molaridade é utilizado o volume da solução, e não o volume do solvente. Isto porque, dependendo da natureza das interações entre o soluto e o solvente, o soluto pode alterar o volume da solução. Assim, na equação da molaridade, utilizamos o volume total da solução (isto é, volume do solvente e volume do soluto). Como os volumes da solução variam com a temperatura, as concentrações molares também variam. Quando expressa como molaridade, a concentração de uma solução com números idênticos de solutos e espécies de solventes será diferente a diferentes temperaturas, devido à contração/expansão da solução.
Diluição de Soluções
A diluição é o processo pelo qual uma solução é menos concentrada (ou mais diluída) pela adição de solvente. Por exemplo, um copo de café gelado torna-se cada vez mais diluído, e menos doce, à medida que o gelo derrete. Em laboratórios, as soluções são muitas vezes armazenadas nas suas formas concentradas, denominadas soluções de stock. As soluções de concentrações mais baixas são preparadas a partir do stock através da diluição.
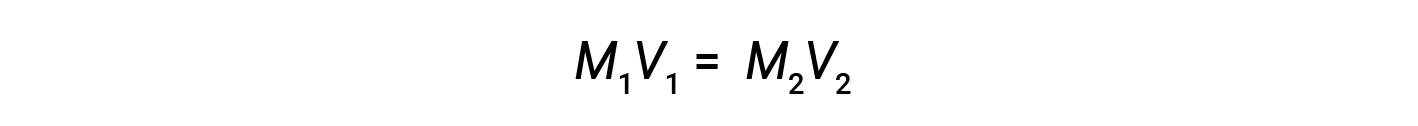
onde M e V são respectivamente a concentração e o volume e os subscritos “1” e “2” referem-se à solução antes e depois da diluição, respectivamente.
Agora, como o produto da molaridade e do volume é igual a moles, o número de moles antes e depois da diluição permanece o mesmo.
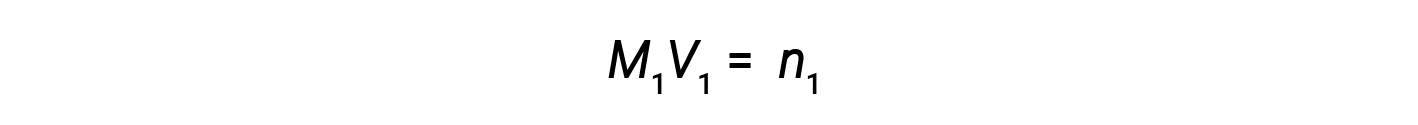
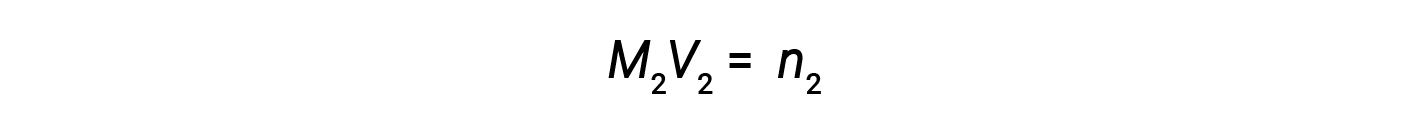
Assim, a diluição não altera a quantidade de soluto na solução.
Este texto é adaptado de OpenStax Chemistry 2e, Section 3.3: Molarity.
