멀티 플루오르 담즙 산 및 사용<em> 생체</em> 자기 공명 영상은 측정하는 담즙 산 전송
Summary
공구 한정 담즙산 흡수 장애를 진단 및 생체 내 담즙산 수송을 측정한다. 살아있는 동물에서 혁신적인 접근 결합 양성자 (1H) – 플러스 불소 (F 19), 자기 공명 영상을 이용하는 것이 기재되어있다; 이 새로운 방법은 임상에서 담즙산 흡수 불량을 선별하는 병진 가능성이있다.
Abstract
지방 흡수를 촉진 세제 등의 전통적인 역할과 함께, 문학 신흥 것은 담즙산이 여러 장기에 영향을 미치는 강력한 신호 분자가 있음을 나타냅니다; 이들은 장 이동성 및 호르몬 생산을 조절하고, 혈관 톤, 포도당 대사, 지질 대사 및 에너지 사용량을 변경. 배설물 담즙산의 변화는 장내 마이크로 바이 옴을 변경하고 cholerrheic 설사와 대장 암을 포함한 대장 병리를 촉진 할 수있다. 배설물 담즙산 조성의 주요 규제는 소장 혀끝 나트륨에 의존하는 담즙 산 수송기 (ASBT)와 섬유 아세포 성장 인자 19 (FGF19)에 있습니다. ASBT의 감소 표현과 기능은 장내의 담즙산가 테이크 감소한다. 또한, 시험 관내 데이터는 일부 FDA 승인 약물 ASBT 기능을 억제하는 것이 좋습니다. 결핍 FGF19 자료는 간에서 담즙산의 합성을 증가시키고 ASBT을 압도 수준으로 장내에 놓습니다. 어느 ASBT 장애 또는 FGF19 결핍은 F 증가ECAL 담즙산과 만성 설사의 원인이 대장 종양을 촉진 할 수있다. 안타깝게도 도구 담즙산 흡수 장애와 생체 내 담즙산 수송에 대한 약물의 작용을 측정하는 것은 제한적이다. 담즙산의 복잡한 작업을 이해하기 위해 기술은 소화관 및 대사 조직에서의 담즙산의 동시 모니터링을 허용하는 것이 요구된다. 이 양자 (1 H) 및 불소 (F 19), 자기 공명 영상 (MRI)의 조합을 사용하여 살아있는 동물에서 담즙산 수송을 측정하는 혁신적인 방법을 생각할하라고했다. 불소 (F (19))에 대한 신규 한 트레이서 시험 관내 및 생체 내 모두에서 살아있는 동물 MRI 만들고 기반 시험 하였다. 이 방법의 장점은 임상 연구와 실천에 대한 조사 및 번역 가능성을 이온화에 노출의 부족을들 수있다.
Introduction
장내에서 지방 흡수를 촉진 세제 그들의 고전적인 역할과 함께, 담즙산은 장간 순환 1, 2와 관련된 것 외에도 여러 장기에 영향을 미치는 강력한 신호 분자로 등장했다. 자신의 대사를 조절하는 것 외에도, 담즙산 위장 생리학 (예, 장 이동성 및 인크 레틴 호르몬 생산 대장 생리학 암 감수성)의 여러 부분을 조절하고, 혈관 톤, 글루코스 및 지질 대사 및 에너지 활용에 전신 효과를 갖는다. 이들 효과의 일부는 장내 매개 동안 비만 환자 또는 위암 바이 패스 수술 후 바와 같이, 다른 전신 담즙산 식후 수준의 변화에 기인한다. 위장관 메타 다른 해부학 구획 담즙산 농도의 동시 모니터링을 허용하는 새로운 기술이 요구되는 담즙산의 복잡한 대사 활동을 해명쌍곡선 조직 (간, 췌장, 골격근 및 지방). 이러한 시간과 공간 정보를 얻기 혁신적인 기술을 필요 – 생체 내 이미징에 여기에 설명 된 이러한 새로운 접근 방식으로 새로운 담즙산 추적기를 사용.
해부학 구획에서 담즙산 조성과 분포는 자신의 간 합성 및식이 요법, 수술, 항생제 사용 및 장내 식물의 변화를 포함 회장 흡수를 조절 인자에 의해 조절된다. 그 장간 순환 3 (도 1)에 대한 창자 담즙산 흡수 키 레귤레이터는 회장 혀끝 나트륨 – 의존성 담즙산 수송기 (; SLC10A2 ASBT)이다. 수동 흡수 장내 걸쳐 발생하지만, ASBT가되도록 일반적으로 대변 담즙산 제한된 유출가 창자 담즙산의 95 % 흡수를 매개한다. Asbt 결핍 (SLC10A2 – / -) 쥐 배설물 담즙산과 감소 된 담즙 ACI를 증가D 풀 4.
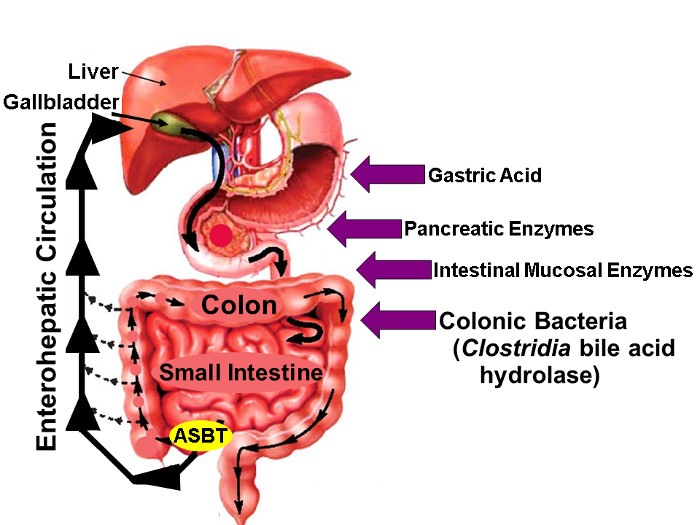
그림 1 : 담즙 산의 장간 순환.
담낭에 저장된 담즙 나무로 배뇨 담즙 산은 간에서 합성되어있다 장간 순환의 그림, 식사와 함께 근위 소장에 출시, 적극적으로 원위부 회장에 ASBT를 통해 흡수. 담즙산 소량이 소화관 전체에 수동적으로 흡수되는 반면, 창자 담즙산의 약 95 %는 새로운 담즙산 합성 유사한 양에 의해 보상된다 대변 최소한 (약 5 %)의 손실을 초래 ASBT 의해 적극적으로 반송되고 간장하여 정상 상태 담즙산 풀을 유지. 우측의 화살표는 위산, 췌장 및 소장 점막 효소, 그리고 가장 importantl 포함한 천연 불소 표지 된 담즙산의 안정성에 영향을 미칠 수있는 요인을 파악원위부 소장과 대장에 정착 클로스 트리 디움 종 발표 한 Y, 가수 분해 효소. (허가 16 수정) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
담즙산 흡수 장애함으로써 간헐적 또는 만성 설사를 일으키는 분변 히드 담즙산 증가 각각의 세 가지 유형으로 분류 될 수있다. 총 회장 병리학 (예를 들면, 절제, 크론 병) 5 1 결과를 입력합니다. 담낭 절제술, vagotomy, 체강 질병, 세균 증식 및 췌장 부전에서 3 개의 결과를 입력합니다. 그들은 같은 선행 조건이 부족하고 회장에서 병리학의 증거가 없기 때문에 대조적으로, '주'(유형 2) 담즙산 흡수 장애를 가진 사람들은 강력한 진단 도전을 제기. 따라서, 차 담즙산 흡수 장애는 일반적으로 설사-P으로 오진된다redominant 과민성 대장 증후군 (IBS-D), 소화기 관련 외래 환자 방문을 아마도 가장 일반적인 이유. IBS-D 환자의 3 차 담즙산 흡수 장애를 가질 것으로 예상되었다; 미국에서,이 수백만 명 5를 나타낼 수있다. 최근 통찰력 차 BAM하지 감소 식 또는 ASBT의 함수에서, 장 섬유 아세포 성장 인자-19 (FGF19)에 의한 간 담즙산 합성의 장애 피드백 억제에서 파생 나타냅니다.
ASBT 포함 창자 담즙산의 생성 증가 포화 담즙산 수송을하고, 배설물에 담즙산 증강 유출 설사 6 발생 – 기본 담즙산 흡수 장애에서, FGF19 낮은 혈장 농도는 간 담즙산 합성을 차단하지 (그림 2). Fgf15 (쥐 FGF19) 결핍 마우스는이 담즙산 풀을 확장하고 대변 담즙산 (7) 증가했다.
<p class= "jove_content">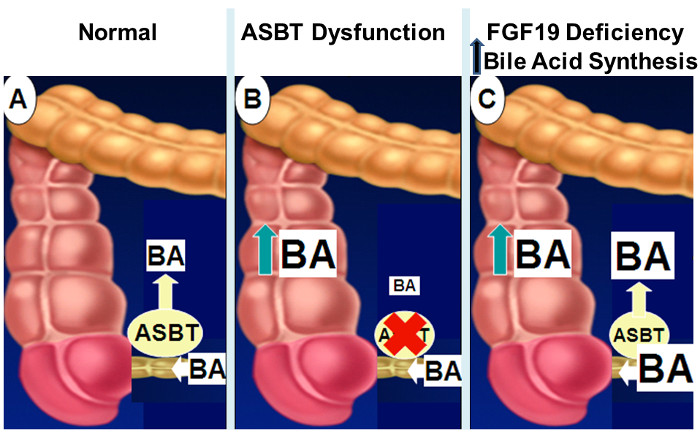
그림 2 : 장내 담즙산 흡수 불량의 메커니즘.
패널 (A)에 도시 된 바와 같이, 일반적으로, 창자 담즙산의 약 95 %가 ASBT 통해 원위 회장에 능동 수송에 의해 흡수된다. ASBT 발현 또는 활성 (패널 B), 대장으로 담즙산의 유출에 장애가 창자 담즙산 흡수 결과 감소되는 경우. 장애인 FGF19 신호 (패널 C)으로, 콜론으로 담즙산의 유출과 ASBT 전송 용량을 압도 장내 담즙산의 농도 증가에 간 담즙산 합성 결과의 피드백 억제의 부족. 의 더 큰 버전을 보려면 여기를 클릭하십시오 이 그림.
장기, 배설물 담즙 ACI 만성 상승DS는 대장 종양을 촉진 할 수있다. 결장 종양 유전자의 체세포 돌연변이 있지만 가속이 프로세스를 보강 할 수있다 분변 담즙산 증가 환경 요소와 연관된 프로그레시브 점막 이형성증에서 발생한다. 설치류에서 하나 외인성 관리 또는 Asbt 결핍의 결과로 대장 이형성증과 종양 형성 8-10을 촉진 대변 담즙산 증가했다.
특히 도발적인 결과는 식품 의약품 안전청 (FDA)의 승인을 일반적으로 사용되는 약물은 강력하게 체외 11 ASBT하여 담즙산 수송을 억제하는 것을 나타낸다. 이들 약물은 생체 내에서 작은 창자 담즙산 수송을 감소시키고 배설물 담즙산 농도를 증가하면 대장 병리에 미치는 잠재적 영향에 관한 것이다. 결장 병변 심지어 작은 증가는 중요한 건강 영향을 줄 수있는 이러한 약물의 사용에 기인. 체외 결과와 역학 산부인과에서 이들의 타당성을 평가할 수있는 툴킷servations는 시판 후 안전성 시험 등의 추가 연구를 박차를 가할 것입니다.
필요성에도 불구하고, 실제적인 분석은 담즙산 흡수 장애를 가진 사람들이 부족 식별합니다. 배설물 담즙산의 직접 측정은 복잡 비현실적, 5 신뢰할 수없는로 년 전에 거부되었습니다. 대안 적 방법은 방사성 셀레늄 표지 콜산 유도체 (75 SeHCAT) 및 7α 하이드 록시 -4- cholesten -3- 온 (C4) 또는 담즙산 결합제의 치료 시험의 혈장 수준의 유지를 측정하는 것을 포함한다. 75 SeHCAT 테스트를 갖는다 진단 테스트에서 또한 미국에서 사용하기에 제한적인 유럽의 가용성 및 FDA 승인되지 않았거나 사용할 수 있습니다, 심지어 겸손 방사선 노출 (0.26 mSv를 / 75 SeHCAT 시험) 문제를 제기하고, 세균 증식 및 고급 간 질환은 75 SeHCAT 결과를 혼동 할 수 있습니다. C4 테스트는 플라즈마가 요구되기 때문에 잠재적 매력적이지만 낮은 포지티브 예측 브로있다UE 및 테스트 널리 사용할 수 없습니다. FGF19의 혈중 농도를 측정하는 것은 유사한 제한 사항이 있습니다. 자주 임상 담즙산의 치료 시험에 의존하지만,이 방법은 담즙산 흡수 장애 (5)의 확실한 진단을 제공 할 수 없다.
이러한 이유로, 신규 MRI 방식 혁신적인 다중 불소화 담즙산 (MFBA-MRI)를 사용하여 생체 내 담즙산 수송 및 분포를 측정하도록 고안되었다. 불소 (19 F) 100 % 자연 존재비의 안정된 동위 원소의 세 개의 원자를 함유 MFBA는 네이티브 담즙산 (12)와 마찬가지로 반송되고, 양자 (1 H) 및 불소 (의 조합 담즙산 수송을 시각화하는데 사용될 수있다 19 F) MRI, 방사선 노출 (13, 14)를 이온화없이 민감한, 안전한 방법.
Protocol
Representative Results
Discussion
CA-LYS-TFA 및 CA-SAR-TFMA 및 나트륨 / 타우로 콜산 공동 수송 폴리펩티드를 발현 ASBT 인간 배아 신장 세포를 발현하는 안정하게 형질 Madin-다비 개과의 신장 세포를 사용하여 수송 관내 분석의 합성 (NTCP) 다른 곳 (13, 14)에 자세히 설명되어 있습니다. 여기서 초점은 살아있는 동물 MRI에 의해 담낭에 MFBA 이미징, 특히, MFBA 내용의 분석을위한 쓸개, 간, 혈액 수확 한 다음 동물을 살고 위관에 ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 작품은 건강의 국립 연구소, 당뇨병과 소화기의 국립 연구소 및 신장 질환 (허가 번호 JP.R.에 R21 DK093406 및 T32 DK067872) 및 (JP.R.에 허가 번호 1BX002129)는 VA 훈장 수상에 의해 지원되었다.
Materials
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 X 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg / ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
References
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).

