En utilisant des acides biliaires multi-fluorés et<em> In Vivo</em> Imagerie par résonance magnétique pour mesurer Bile Transport Acid
Summary
Outils pour diagnostiquer la bile malabsorption d'acide et de mesurer le transport des acides biliaires in vivo sont limitées. Une approche innovante d'animaux vivants est décrit qui utilise des protons combiné (1 H) plus de fluor (19 F) d'imagerie par résonance magnétique; cette nouvelle méthodologie a un potentiel de translation à l'écran pour malabsorption des acides biliaires dans la pratique clinique.
Abstract
En plus de leur rôle traditionnel de détergents qui facilitent l'absorption des graisses, de la littérature émergente indique que les acides biliaires sont des molécules de signalisation puissants qui affectent plusieurs organes; ils modulent la motilité intestinale et la production d'hormones, et de modifier le tonus vasculaire, le métabolisme du glucose, le métabolisme des lipides, et l'utilisation de l'énergie. Les changements dans les acides biliaires fécaux peuvent modifier le microbiome intestinal et de promouvoir le côlon pathologie y compris la diarrhée cholerrheic et le cancer du côlon. des régulateurs clés de la composition des acides biliaires fécaux sont le petit intestin apicale acides biliaires Transporteur de sodium-dépendant (ASBT) et fibroblast growth factor-19 (FGF19). expression réduite et la fonction de ASBT diminue intestinale acide biliaire up-prendre. De plus, les données in vitro suggèrent que certains médicaments approuvés par la FDA inhibent la fonction ASBT. FGF19 libération Déficient augmente la synthèse de l'acide biliaire hépatique et de libérer dans les intestins à des niveaux qui dépassent ASBT. Soit un dysfonctionnement ou d'une carence en ASBT FGF19 augmente fles acides biliaires ECAL et peuvent causer la diarrhée chronique et promouvoir la néoplasie du côlon. Malheureusement, les outils pour mesurer la bile malabsorption acide et les actions de la drogue sur le transport des acides biliaires in vivo sont limitées. Afin de comprendre les actions complexes d'acides biliaires, les techniques sont nécessaires qui permettent la surveillance simultanée des acides biliaires dans l'intestin et dans les tissus métaboliques. Ceci nous a amené à concevoir une méthode innovante pour mesurer le transport des acides biliaires chez les animaux vivants en utilisant une combinaison de proton (1 H) et de fluor (19 F) l' imagerie par résonance magnétique (IRM). Traceurs nouveaux pour le fluor (19 F) à base de l' IRM des animaux vivants ont été créés et testés, à la fois in vitro et in vivo. Les points forts de cette approche comprennent le manque d'exposition aux rayonnements et le potentiel translationnelle ionisants pour la recherche et la pratique clinique.
Introduction
En plus de leur rôle en tant que détergents classiques qui facilitent l' absorption des graisses dans l'intestin, les acides biliaires sont apparus comme des molécules de signalisation puissants affectant de multiples organes , en plus de ceux associés à leur circulation entérohépatique 1,2. En plus de contrôler leur propre métabolisme, les acides biliaires moduler plusieurs aspects de la physiologie gastro – intestinale (par exemple, la motilité intestinale et la production de l' hormone incrétine, le côlon physiologie et la susceptibilité au cancer) et ont des effets systémiques sur le tonus vasculaire, le glucose et le métabolisme des lipides, et l' utilisation de l' énergie. Certains de ces effets sont médiés dans l'intestin, d'autres sont dus à des changements dans les niveaux post-prandiaux d'acides biliaires systémiques, comme il est indiqué chez les patients obèses ou après une chirurgie gastrique by-pass. Pour élucider les actions métaboliques complexes des acides biliaires nouvelle technologie est nécessaire que permet la surveillance simultanée des niveaux d'acides biliaires dans les différents compartiments anatomiques, dans le tractus gastro-intestinal et métaboliques tissus (foie, le pancréas, les muscles squelettiques et tissu adipeux). L' obtention d'une telle information temporelle et spatiale nécessite une technologie innovante – imagerie in vivo en utilisant de nouveaux traceurs d'acides biliaires , comme décrit ici est une telle nouvelle approche.
Composition d'acide biliaire et de la distribution dans les compartiments anatomiques sont régulés par des facteurs qui modulent la synthèse hépatique et l'absorption de l'iléon, y compris le régime alimentaire, la chirurgie, l'utilisation d'antibiotiques et de modification de la flore intestinale. Un régulateur clé de l' absorption des acides biliaires intestinaux pour leur circulation entéro 3 (figure 1) est l'iléon apicale Sodium dépendant Bile Acid Transporter (ASBT; SLC10A2). Bien que l'absorption passive se produit tout au long de l'intestin, ASBT médie l'absorption de 95% des acides biliaires intestinaux de sorte que normalement il y a un déversement limité d'acides biliaires dans les selles. ASBT déficient (Slc10a2 – / -) Les souris ont augmenté les acides biliaires fécaux et une diminution de la bile acid piscine 4.
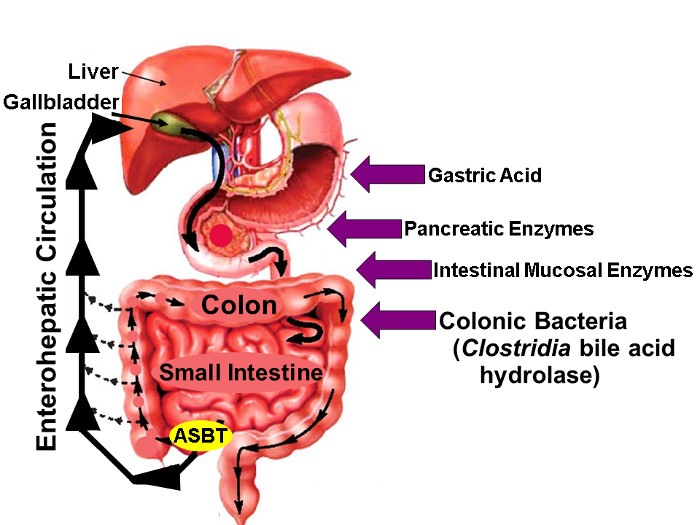
Figure 1: Circulation entérohépatique des acides biliaires.
Illustration de entéro Circulation dans lequel les acides biliaires sont synthétisées dans le foie, Excrétée dans l'arbre biliaire, stockée dans la vésicule biliaire, Sortie dans le proximal Petit Intestin avec les repas, et activement repris via ASBT dans le Distal iléon. Tandis que de faibles quantités d'acides biliaires sont absorbés passivement à travers le tube digestif, environ 95% des acides biliaires intestinaux sont transportés activement par ASBT entraînant un minimum (environ 5%) de la perte dans les selles, qui est compensée par une quantité similaire de nouvelle synthèse des acides biliaires dans le foie, ce qui maintient un pool d'acides biliaires à l'état stable. Les flèches à droite identifient les facteurs qui peuvent influer sur la stabilité de l'acide biliaire natif et le fluor marqué, y compris l'acide gastrique, du pancréas et des enzymes de la muqueuse intestinale, et, le plus importantly, enzymes hydrolytiques libérés par des espèces clostridiennes qui colonisent l'intestin grêle et le côlon distal. (Modifié avec la permission 16) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
malabsorption des acides biliaires peuvent être classés en trois types, dont chacune augmente les acides biliaires dihydroxylés fécales, ce qui provoque une diarrhée intermittente ou chronique. Type 1 résultats de pathologie iléale brut (par exemple, la résection, la maladie de Crohn) 5. Tapez 3 résultats de cholécystectomie, vagotomie, la maladie coeliaque, la prolifération bactérienne, et l'insuffisance pancréatique. En revanche, les personnes (type 2) malabsorption des acides biliaires «primaire» posent un défi diagnostique formidable parce qu'ils manquent de telles conditions antécédentes et ne disposent pas des preuves de la pathologie dans l'iléon. Par conséquent, la malabsorption des acides biliaires primaires est souvent diagnostiquée à tort comme la diarrhée-psyndrome redominant du côlon irritable (IBS-D), peut-être la raison la plus courante pour liés gastro-entérologie-out-patients visites. Il a été estimé qu'un tiers des patients atteints d'IBS-D ont malabsorption des acides biliaires primaires; aux États – Unis, ce qui peut représenter plusieurs millions de personnes 5. connaissances récentes indiquent que BAM primaire dérive de troubles de la rétro-inhibition de la synthèse des acides biliaires du foie par l'intestin fibroblast growth factor-19 (FGF19), et non à partir de l'expression ou la fonction de ASBT réduite.
Malabsorption de l' acide biliaire primaire, de faibles taux plasmatiques de FGF19 ne parviennent pas à arrêter la synthèse de l' acide biliaire hépatique – l'augmentation résultante des acides biliaires intestinaux sature des transporteurs d'acides biliaires, y compris ASBT et le déversement augmentée des acides biliaires dans les selles provoque une diarrhée 6 (Figure 2). Les souris déficientes en FGF15 (FGF19 murin) ont une piscine d'acide biliaire élargi et une augmentation des acides biliaires fécaux 7.
<p class= "Jove_content">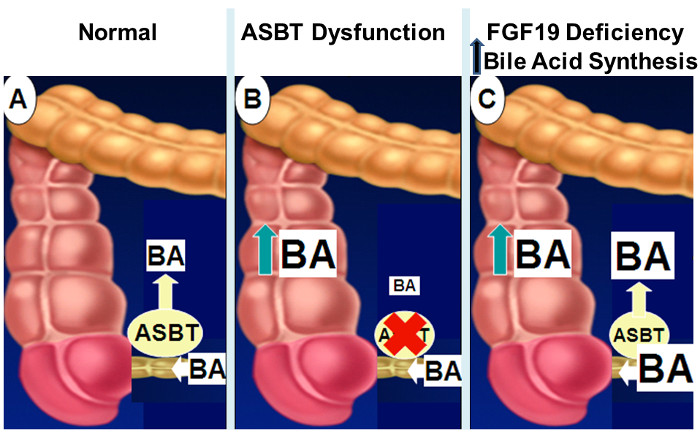
Figure 2: Mécanismes de Intestinal Bile Acid malabsorption.
Normalement, comme indiqué dans le panneau A, environ 95% des acides biliaires intestinaux sont absorbés par transport actif dans l'iléon distal par l' intermédiaire ASBT. Lorsque l' expression ou l' activité ASBT est diminuée (panneau B), douteux des résultats d'absorption des acides biliaires intestinaux dans le déversement des acides biliaires dans le côlon. Avec la signalisation FGF19 altérée (panneau C), l'absence de rétro – inhibition de la bile hépatique résultats de la synthèse de l' acide dans l' augmentation des concentrations d'acides biliaires intestinaux qui accablent la capacité de transport de ASBT du déversement des acides biliaires dans le côlon. S'il vous plaît cliquer ici pour voir une version plus grande cette figure.
À long terme, l'élévation chronique fécale bile acids peut favoriser la néoplasie du côlon. Colon néoplasie provient de la dysplasie de la muqueuse progressive associée à des mutations de gènes somatiques, mais les facteurs environnementaux qui augmentent les acides biliaires fécaux peuvent accélérer et augmenter ce processus. Chez les rongeurs, une augmentation des acides biliaires fécaux , soit en conséquence de l' administration exogène ou d'une déficience ASBT du côlon promouvoir la dysplasie et la formation de tumeurs 8-10.
Notamment, les résultats de provocation indiquent que les médicaments couramment utilisés approuvés par la Food and Drug Administration (FDA) inhibent puissamment le transport des acides biliaires par ASBT in vitro 11. Si ces médicaments réduisent petit le transport des acides biliaires intestinale in vivo et d' augmenter les niveaux d'acides biliaires fécaux, l'impact potentiel sur la pathologie du côlon serait concernant. Même une petite augmentation dans le côlon pathologie attribuable à l'utilisation d'un tel médicament pourrait avoir un impact majeur sur la santé. Une boîte à outils qui peut évaluer la plausibilité de ces derniers dans les résultats in vitro et ob épidémiologiquevations stimulerait des recherches supplémentaires, y compris des études de sécurité post-commercialisation.
Malgré la nécessité, des essais pratiques pour identifier les personnes atteintes de malabsorption des acides biliaires font défaut. La mesure directe des acides biliaires fécaux a été rejetée il y a des années comme encombrants, peu pratiques et peu fiables 5. D' autres approches comprennent la rétention d'un dérivé radioactif de sélénium marqué par l' acide cholique (75 SeHCAT) et les taux plasmatiques de 7α-hydroxy-4-cholestén-3-one (C4), ou un essai thérapeutique de liant d'acides biliaires de mesure. Des tests de 75 SeHCAT a disponibilité limitée en Europe et ne sont pas approuvés par la FDA ou disponibles pour une utilisation aux États – Unis en outre, même l' exposition aux rayonnements modeste (0,26 mSv / 75 test SeHCAT) à partir de tests de diagnostic soulève des préoccupations, et la prolifération bactérienne et les maladies du foie avancé peuvent confondre 75 résultats de SeHCAT. test C4 est potentiellement intéressante puisque seul le plasma est nécessaire, mais il a une faible val positive prédictiveue et les tests ne sont pas largement disponibles. La mesure des taux sériques de FGF19 a des limites similaires. Cliniciens fréquemment recours à un essai thérapeutique de chélateurs des acides biliaires, mais cette approche ne peut pas fournir un diagnostic définitif de malabsorption des acides biliaires 5.
Pour ces raisons, une nouvelle approche IRM a été conçu pour mesurer le transport des acides biliaires et la distribution in vivo en utilisant des acides biliaires multi-fluorés innovants (MFBA-IRM). MFBA contenant trois atomes de fluor (19 F), un isotope stable de 100% d' abondance naturelle, sont transportés de manière similaire aux acides biliaires natifs 12 et peut être utilisé pour visualiser le transport des acides biliaires avec une combinaison de protons (1 H) et du fluor ( 19 F) IRM, une méthode sûre sensible sans exposition aux rayonnements ionisants 13,14.
Protocol
Representative Results
Discussion
La synthèse de l' AC-Lys- TFA et CA-Sar-TFMA et l'analyse in vitro de leur transport à l' aide transfectées de façon stable Madin-Darby cellules de rein canin exprimant ASBT et les cellules rénales embryonnaires humaines exprimant le polypeptide de sodium / taurocholate co-transport (PNT) sont détaillées ailleurs 13,14. Ici, l'accent est mis sur l'administration orale de MFBA par gavage à des animaux, suivie par la récolte de la vésicule biliaire, le foie et le sang pour…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par les Instituts nationaux de la santé, l'Institut national du diabète et des maladies digestives et rénales (numéros de subvention R21 DK093406 et T32 DK067872 à JP.R.) et le prix du mérite VA (numéro de subvention 1BX002129 à JP.R.).
Materials
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 X 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg / ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
References
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).

