Un sensor basado en aptámero para no quelado de gadolinio (III)
Summary
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Abstract
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 – 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introduction
La creciente importancia de la formación de imágenes por resonancia magnética (MRI) en el diagnóstico clínico, que está limitado por la sensibilidad inherente de la técnica, ha dado como resultado el rápido crecimiento de la investigación en el desarrollo de nuevos agentes de contraste a base de gadolinio (GBCAs) 1. GBCAs son moléculas que se administran para mejorar la calidad de la imagen, y por lo general tienen la estructura química de un ion trivalente de gadolinio (Gd 3+) coordinado a un ligando polidentado. Esta formación de complejos es de importancia crítica que no quelado Gd 3+ es tóxico; se ha implicado en el desarrollo de fibrosis sistémica nefrogénica en algunos pacientes con enfermedad renal o insuficiencia 2. En consecuencia, la detección del ion libre acuosa es fundamental para garantizar la seguridad de GBCAs. La presencia de no quelado Gd 3+ en soluciones GBCA a menudo es el resultado de una reacción incompleta entre el ligando y el de iones, la disociación del complejo, o displacement por otros cationes metálicos biológicos 3.
Entre las diversas técnicas que actualmente se utilizan para determinar la presencia de Di-s 3+, aquellos que dependen de cromatografía y / o rango más alto espectrometría en términos de versatilidad y aplicabilidad 4. Entre sus puntos fuertes son de alta sensibilidad y precisión, la capacidad de analizar diversas matrices de muestra (incluyendo suero humano 5, la orina y el pelo 6, aguas residuales 7, y formulaciones de agentes de contraste 8), y la cuantificación simultánea de múltiples complejos de Gd + 3 (un listado de los estudios anteriores a 2013 se describe en una revisión exhaustiva por Telgmann et al.) 4. El único inconveniente es que varios de estos métodos requieren instrumentaciones (como la espectrometría de masas con plasma acoplado inductivamente) 4 que algunos laboratorios no pueden tener acceso a. En el contexto de descubrimiento novedoso GBCA en la investigación y los niveles de prueba de concepto, arbasado en el método espectroscópico elatively más conveniente, rápida y rentable (tales como absorción UV-Vis o fluorescencia) puede servir como una alternativa valiosa. Con estas aplicaciones en mente, un sensor basado en aptámero fluorescente para acuosa Gd 3 + 9 fue desarrollado.
El aptámero (Gd-aptámero) es una larga molécula de ADN de una sola hebra 44-base con una secuencia específica de bases que se aisló a través del proceso de evolución sistemática de ligandos por enriquecimiento exponencial (SELEX) 9. Para adaptar el aptámero en un sensor fluorescente, un fluoróforo está unido al terminal 5 'de la hebra, que después se hibridó con una hebra de temple (QS) a través de 13 bases complementarias (Figura 1). El QS está marcado con una molécula extintor oscuro en el extremo 3 '. En ausencia de Gd 3 +, el sensor (Gd-sensor), compuesto por una relación molar 1: 2 de Gd-aptámero y QS, respectivamente, tendrán mínima emisión de fluorescencia debido to transferencia de energía desde el fluoróforo al extintor. La adición de acuoso Gd 3+ desplazará al QS del Gd-aptámero, resultando en un aumento de la emisión de fluorescencia.
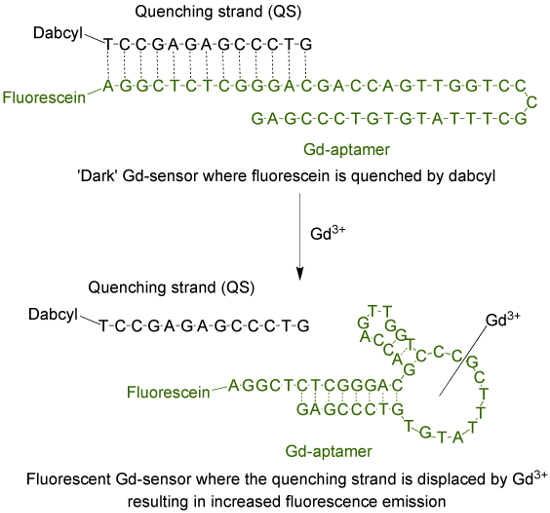
La Figura 1. El sensor (Gd-sensor) que consiste en el largo aptámero 44-base (Gd-aptámero) etiquetadas con fluoresceína (un fluoróforo) y el filamento 13-base largo de temple (QS) etiquetadas con DABCYL (un extintor oscuro) . En ausencia de no quelado Gd 3+, la fluorescencia del sensor es mínimo. Con la adición de Gd 3+, el desplazamiento de la QS se produce y se observa un aumento en la emisión de fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
Hay en la actualidad, un método basado en la espectroscopia de uso general para detectaring 3+ acuosa Di-s. Este ensayo utiliza el anaranjado de xilenol molécula, que se somete a un cambio en la longitud de onda de absorción máxima 433 a 573 nm sobre la quelación con el ion 10. La relación de estos máximos dos absorbancia se puede utilizar para cuantificar la cantidad de no quelado Gd 3+. El sensor de aptámero es una alternativa (también puede ser complementaria) con el ensayo de naranja de xilenol, como los dos métodos tienen diferentes condiciones de reacción (tales como el pH y la composición de las soluciones tampón se utiliza), selectividades de destino, los rangos lineales de cuantificación, y las modalidades de detección 9.
Protocol
Representative Results
Discussion
Usando el Gd-sensor basado en aptámero, un aumento en la emisión de fluorescencia que es proporcional a la concentración de Gd no quelado 3+ se observa. Para minimizar la cantidad de muestra utilizada, el ensayo se puede ejecutar en una microplaca de 384 pocillos con un volumen total de la muestra de 45 l por pocillo. En este diseño, la elección de fluoresceína (FAM) y DABCYL (Dab) se basa principalmente en el coste de los reactivos; para modificar la longitud de onda de emisión, una pareja diferente d…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materials
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 – 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Name of Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
References
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).

