设计磁响应稀土离子螯合磷脂组件的制备方法及双折射测量
Summary
介绍了高磁响应稀土离子螯合多组件的制备方法。磁响应由装配尺寸决定, 它是通过纳米膜的挤压而定制的。采用双折射测量、核磁共振和小角度中子散射技术对组件的磁 alignability 和温度诱发的结构变化进行监测。
Abstract
Bicelles 是可调谐的圆盘状多组件, 由大量的脂质混合物组成。应用范围从膜蛋白结构研究的核磁共振 (NMR), 以纳米的发展, 包括形成光学活性和磁性可转换凝胶。这些技术需要对装配尺寸、磁响应和热阻进行高度控制。混合物 12-二-sn-glycero-3-phosphocholine (DMPC) 及其镧系离子 (Ln3 +) 螯合磷脂共轭, 12-二-snglycero-3-phospho-ethanolamine-diethylene triaminepentaacetate (甲醚-DTPA), 组装成高磁响应的组件, 如 DMPC/甲醚-DTPA/Ln3 + (摩尔比率 4:1: 1) bicelles。在双层中引入胆固醇 (-OH) 和类固醇衍生物会导致另一组提供独特物理化学性质的组件。对于某一特定的脂质成分, 磁性 alignability 与 bicelle 大小成正比。在3 +中的络合结果在大小和对准方向方面都产生了前所未有的磁响应。热可逆崩溃的圆盘状结构成泡后, 加热允许裁剪装配的尺寸, 通过挤出膜过滤器的定义孔径大小。磁性 alignable bicelles 通过冷却到5° c 再生, 导致装配尺寸由囊泡前体定义。在此, 解释了这个制造过程, 并通过在 5.5 T 磁场下的双折射测量来量化组件的磁性 alignability。双折射信号, 源自磷脂双层, 进一步使监测的多变化发生在双层。这种简单的技术是互补的核磁共振实验, 通常用于表征 bicelles。
Introduction
Bicelles 是从许多脂质混合物中获得的圆盘状多组件。1,2,3,4,5广泛应用于膜生物分子的核磁共振波谱结构表征。6,7然而, 最近的努力旨在扩大可能的应用领域。5,8,9最受研究的 bicelle 系统由 12-二-sn-glycero-3-phosphocholine (DMPC) 组成, 构成组件的平面部分, 12-己-snglycero-3-phosphocholine (DHPC)磷脂覆盖边缘。1,2,3组成双层磷脂的分子几何决定了自组装多结构的结构。4,5用甲醚-DTPA 替换 DHPC, 生成高磁响应和可调谐的 bicelle 系统。10,11 DMPC/甲醚-DTPA/Ln3 + (摩尔比 4:1: 1) bicelles 与更多的顺磁性镧系离子 (Ln3 +) 在双层表面上相关联, 从而增强了磁响应。10此外, 用甲醚-DTPA/Ln3 +取代水溶性 DHPC 分子, 可以形成耐稀释的 bicelles。11
平面多组件的磁性 alignability 是由它们的整体磁场能量决定的,
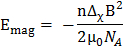 (1)
(1)
其中 B 是磁场强度, 磁常数, n 的聚合数和分子磁性的易感性各向异性组成双层的脂质. 
 因此, DMPC/甲醚-DTPA/Ln3 + bicelles 对磁场的响应是根据它们的大小 (集合数 n) 和分子磁性磁化率各向异性Δχ来调整的。后者很容易通过改变螯合物的性质在3 +中实现。12,13,14,15在双层中引入胆固醇 (铁-OH) 或其他甾体衍生物, 可以调节聚合数 n 和Δχ的磁化率。11,16,17,18,19对于给定的脂质组合, 较大的组件含有更多的脂类, 能够对 Emag (更大的聚合数 n) 做出贡献, 从而导致更多的 alignable 物种。DMPC/DHPC bicelles 的大小, 例如, 是常规控制通过优化的组成脂质比或总浓度。20,21,22虽然这在 DMPC/甲醚-DTPA/Ln3 + bicelles 中是可能的, 但在加热时, 它们从 bicelle 到泡的热可逆转换提供了更多的剪裁选项。机械手段, 如挤压通过膜过滤器, 可以形成的囊泡。磁性 alignable bicelles 在冷却到5° c 时再生, 并且他们的维度从泡前体被口授。11在这里, 我们专注于机械制造过程的潜力, DMPC/甲醚-DTPA/tm3 + (摩尔比率 4:1: 1) 或 DMPC/, OH/甲醚-DTPA/tm3 + (摩尔比 16:4: 5:5) 作为参考系统。在使用其他 Ln3 +而不是 Tm3 +时, 该进程工作类似。这些技术提供的各种可能性在图 1中得到了突出显示, 并在其他地方进行了广泛的讨论。23
因此, DMPC/甲醚-DTPA/Ln3 + bicelles 对磁场的响应是根据它们的大小 (集合数 n) 和分子磁性磁化率各向异性Δχ来调整的。后者很容易通过改变螯合物的性质在3 +中实现。12,13,14,15在双层中引入胆固醇 (铁-OH) 或其他甾体衍生物, 可以调节聚合数 n 和Δχ的磁化率。11,16,17,18,19对于给定的脂质组合, 较大的组件含有更多的脂类, 能够对 Emag (更大的聚合数 n) 做出贡献, 从而导致更多的 alignable 物种。DMPC/DHPC bicelles 的大小, 例如, 是常规控制通过优化的组成脂质比或总浓度。20,21,22虽然这在 DMPC/甲醚-DTPA/Ln3 + bicelles 中是可能的, 但在加热时, 它们从 bicelle 到泡的热可逆转换提供了更多的剪裁选项。机械手段, 如挤压通过膜过滤器, 可以形成的囊泡。磁性 alignable bicelles 在冷却到5° c 时再生, 并且他们的维度从泡前体被口授。11在这里, 我们专注于机械制造过程的潜力, DMPC/甲醚-DTPA/tm3 + (摩尔比率 4:1: 1) 或 DMPC/, OH/甲醚-DTPA/tm3 + (摩尔比 16:4: 5:5) 作为参考系统。在使用其他 Ln3 +而不是 Tm3 +时, 该进程工作类似。这些技术提供的各种可能性在图 1中得到了突出显示, 并在其他地方进行了广泛的讨论。23
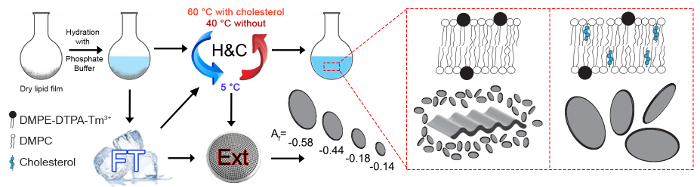
图 1: 可能的制造过程的示意图概述.所研究的磁性 alignable 在3 +螯合多组件是由 DMPC/甲醚-DTPA/Tm3 + (摩尔比 4:1: 1) 或 DMPC/, OH/甲醚-DTPA/Tm3 + (摩尔比 16:4: 5:5) 组成。干脂膜是水合的50毫米磷酸缓冲液 pH 值为 7.4, 总脂质浓度为15毫米。有效的脂质膜水化需要的是冻融循环 (FT) 或加热和冷却循环 (H & #38; C)。H 和 #38; C 周期是必要的, 以再生样品后, 最后冻结解冻步骤, 或再生样品保持长期冻结超过一段时间, 如果他们要使用不进一步挤压。Isabettini et al广泛讨论了这些步骤。23最大的 alignable 多组件实现, 根据脂质组成提供不同的组件体系结构。通过纳米膜过滤器, 挤出 (Ext) 可调节 bicelle 尺寸和磁性 alignability。所呈现的对齐系数f是从2D 小角中子散射 (san) 模式 (DMPC/甲醚/DTPA/Tm3 + (摩尔比率 16:4: 5:5) 中计算的, 通过800、400、200或 100 nm 孔隙进行拉伸。san 度量是量化 bicelle 对齐的补充方法, 此处不会详细介绍。11,16一个f范围从-1 (平行中子散射或垂直对准的 bicelles 与磁场方向) 到0的各向同性散射。请点击这里查看更大版本的这个数字。
bicelles 的结构在广泛的表征技术中得到了广泛的研究。13使用核磁共振波谱法或小角度中子散射 (san) 实验对暴露在磁场中的 bicelles 的对准进行了量化。5,10,11,12,13,16,17,18,19,24,25但是, 在 Ln3 +的情况下发生的核磁共振峰值的移位和展宽是对该方法的严重限制。15,26,27,28尽管 san 实验不受此限制的影响, 但在解决方案中对组件的磁致对准的常规定量化方面, 还是可取的替代方法。双折射测量是一个可行的和比较简单的选择。类似核磁共振实验, 双折射测量揭示了有价值的信息, 脂质重和脂质相发生在双层。此外, 多组件中发生的几何变换, 如温度等变化的环境条件进行了监测。11,12,13,16磁致双折射Δn′用于研究各种类型的磷脂系统。13,29,30基于磁场相位调制技术的双折射测量是检测 bicelles 方位的可行方法。12,16,18,29,31,32在高磁场中 bicelles 的双折射率高达 35 T 的可能性也由 m. Liebi et al.显示13
当偏振光进入一个各向异性物质时, 它会在一个普通的和特殊的波中折射。11两个波具有不同的速度, 并在相位上由一个迟滞δ转移。延迟δ的程度被测量并且转换成双折射信号来量化材料中各向异性的程度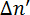
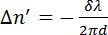 (2)
(2)
其中λ是激光的波长, d 是样品的厚度。磷脂是光学的各向异性, 它们的光轴与它们的长分子轴重合, 与烃尾平行。11,12如果磷脂在溶液中是随机定向的, 则不测量延迟。当磷脂相互平行时, 就会测量迟钝。磁致双折射可根据磁场中分子的取向, 产生正负符号; 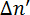 请参见图 2。与 x 轴平行的磷脂将导致一个负的, 而那些沿 z-axis 对齐结果为正值的.
请参见图 2。与 x 轴平行的磷脂将导致一个负的, 而那些沿 z-axis 对齐结果为正值的. 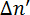
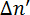 当与 y-axis 平行时, 当光学轴与光传播的方向重合时, 不观察到双折射。
当与 y-axis 平行时, 当光学轴与光传播的方向重合时, 不观察到双折射。
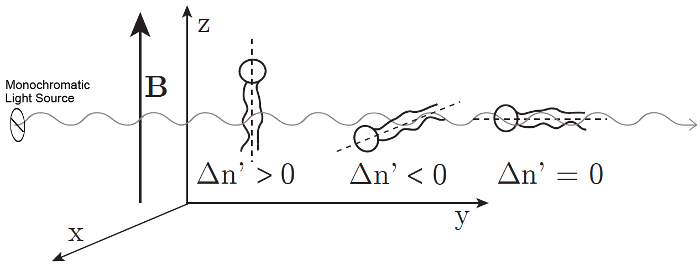
图 2: 磷脂的对准和磁致双折射的对应符号 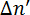 .测量的的符号取决于在磁场中磷脂的方向.
.测量的的符号取决于在磁场中磷脂的方向. 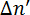 虚线表示分子的光轴。光在45°上极化, 并在 y 方向传播。磁场 B 在 z 方向。这一数字已从 m Liebi 中修改。11 请单击此处查看此图的较大版本.
虚线表示分子的光轴。光在45°上极化, 并在 y 方向传播。磁场 B 在 z 方向。这一数字已从 m Liebi 中修改。11 请单击此处查看此图的较大版本.
在 bicelles 的各向同性胶体悬浮的情况下, 磷脂在双层中的排列所诱导的取向将会丢失, 使迟滞δ零化。bicelles 还必须对准, 以便在它们的双层中定位光学活性磷脂, 导致偏振光δ。因此, 双折射是一个敏感的工具, 量化的磁性 alignability 的多组件。垂直于磁场的 Bicelles 将产生一个正的, 而那些对齐的平行将产生一个负的. 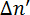
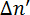 该符号取决于设置的对齐方式, 并且可以使用引用示例进行检查。
该符号取决于设置的对齐方式, 并且可以使用引用示例进行检查。
Protocol
Representative Results
Discussion
详细介绍了双折射测量如何与 san 结合使用, 以评估产生高磁响应的方法在3 +螯合磷脂组件中的 Isabettini et al.23所建议的制造协议也适用于由较长的联邦和 DPPE-DTPA 磷脂组成的组件, 或用于含有其双层内化学工程类固醇衍生物的部件。11,12,17,18,19…
Divulgations
The authors have nothing to disclose.
Acknowledgements
作者承认瑞士国家科学基金会资助 SMhardBi (项目编号 200021_150088/1)。在瑞士 Villigen 谢瑞 Instute 的瑞士散裂中子源 SINQ 进行了无 san 实验。作者热烈感谢 Dr. Kohlbrecher 的指导和无实验。在高磁场下的双折射测量装置是从荷兰奈梅亨型磁性实验室 HFML 的现有设置中得到启发的。我们感谢布鲁诺菲斯特的帮助, 开发的电子双折射设置, 1月 Corsano 和丹尼尔 Kiechl 为构建框架允许精细和轻便的激光对准, 和 Dr. 伯纳德科勒为持续的技术支持。
Materials
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345P | >99% |
| 1,2-dimyristoyl-sn-glycero-3-phospho-ethanolamine-diethylene triaminepentaacetate acid hexammonium salt (DMPE-DTPA) | Avanti Polar Lipids | 790535P | >99% |
| Thulium(III) chloride | Sigma-Aldrich | 439649 | anhydrous, powder, 99.9% trace metals basis |
| Dysprosium(III) chloride | Sigma-Aldrich | 325546 | anhydrous, powder, 99.9% trace metals basis |
| Ytterbium(III) chloride | Sigma-Aldrich | 439614 | anhydrous, powder, 99.9% trace metals basis |
| Chloroform | Sigma-Aldrich | 319988 | contains ethanol as stabilizer, ACS reagent, ≥99.8% |
| Methanol | Sigma-Aldrich | 34860 | ≥99.9% |
| Cholesterol | Amresco | 433 | Ultra pure grade |
| D2O | ARMAR chemicals | 1410 | 99.8 atom % D |
| Ultrapure water | Millipore | Synergy pak2 (SYPK0SIX2), Millipack GP (MPGP02001) | |
| electronic pH meter | Metrohm | 17440010 | |
| Whatmann Nuclepore 25 mm 100nm membrane filter | VWR | 515-2028 | |
| Whatmann Nuclepore 25 mm 200nm membrane filter | VWR | 515-2029 | |
| Whatmann Nuclepore 25 mm 400nm membrane filter | VWR | 515-2030 | |
| Whatmann Nuclepore 25 mm 800nm membrane filter | VWR | 515-2032 | |
| Whatmann Filter paper | VWR | 230600 | |
| 25 ml round bottom flask | VWR | 201-1352 | 14/23 NS |
| 3 ml glass snap-cup | VWR | 548-0554 | ND18, 18x30mm |
| 2.5 ml glass syringe | Hamilton | ||
| Sodium dihydrogen phosphate dihydrate | Merk | 1.06342 | Salt used to make phosphate buffer |
| di-Sodium hydrogen phosphate | Merk | 1.06586 | Salt used to make phosphate buffer |
| Liquid Nitrogen | Carbagas | – | |
| Pressurized Nitrogen gas | Carbagas | – | 200 bar bottle |
| Lipid Extruder 10 ml | Lipex | – | Fully equipped with thermobarrel |
| High-pressure PVC tube | GR NETUM | – | must resist more than 4 MPa |
| Serto adaptors | Sertot | – | |
| Nitrile gloves | VWR | – | |
| 2 ml glass pipettes | VWR | 612-1702 | 230 mm long |
| Diode Laser | Newport | LPM635-25C | |
| DSP Dual Phase Lock-in Amplifier | SRS | SR830 | |
| Photodiode Detector | Silonex Inc. | SLSD-71N5 | 5mm2, Silicon, photo-conductive |
| 5.5 T Cryogenic Magnetic | Cryogenic/Oerlikon AG | – | 12 bar He-cooled. RW4000/6000 compressor, RGD 5/100 TA cryo-head |
| Second order low pass filter | home-built | – | Linear power supply 24V DC, second order, Sallen Key, cut-off frequency 360 Hz, +/- 12V, max 10 mA |
| Photoelastic modulator | Hinds instruments | PEM-90 | |
| Glan-Thompson Calcite Polarizer | Newport | 10GT04 | 25.4mm diameter |
| Quartz sample cuvette | Hellma | 165-10-40 | temperature controlled cell, 0.8 ml, 10mm path length |
| Temperature probe | Thermocontrol | – | Type K, 0.5mm diameter, Thermocoax |
| Non-polarizing mirrors | Newport | 50326-1002 | 25.4mm |
| RS 232 cables | National Instruments | 189284-02 | For Connecting to the RS-232 Port on the front of Compact FieldPoint Controllers |
| BNC 50 Ω cable and connectors | National Instruments | 763389-01 | |
| cFP-AI-110 | National Instruments | 777318-110 | 8-Channel Analog Voltage and Current Input Module for Compact FieldPoint |
| cFP-CB-1 | National Instruments | 778618-01 | Integrated Connector Block for Wiring to Compact FieldPoint I/O |
| cFP-CB-3 | National Instruments | 778618-03 | Integrated Isothermal Connector Block for Wiring Thermocouples to the cFP-TC-120 Module |
| cFP-TC-120 | National Instruments | 777318-120 | 8-Channel Thermocouple Input Module for Compact FieldPoint |
| cFP-1804 | National Instruments | 779490-01 | Ethernet/Serial Interface for NI Compact FieldPoint |
| LabView 2010 | National Instruments | – | |
| Industrial power supply | Traco Power | TCL 060-124 | 100-240V AC |
| Waterbath | Julabo | FP40-HE | refrigerated/Heating Circulator |
References
- Sanders, C. R., Hare, B. J., Howard, K. P., Prestegard, J. H. Magnetically-oriented phospholipid micelles as a tool for the study of membrane-associated molecules. Prog. Nucl. Magn. Reson. Spectrosc. 26, 421-444 (1994).
- Glover, K. J., et al. Structural evaluation of phospholipid bicelles for solution-state studies of membrane-associated biomolecules. Biophys. J. 81 (4), 2163-2171 (2001).
- Katsaras, J. H. T. A., Pencer, J., Nieh, M. -. P. “Bicellar” lipid mixtures as used in biochemical and biophysical studies. Naturwissenschaften. 92 (8), 355-366 (2005).
- Sanders, C. R., Prosser, R. S. Bicelles: a model membrane system for all seasons?. Structure. 6 (10), 1227-1234 (1998).
- Dürr, U. H. N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: birth and coming of age of lipid bicelles. Prog. Nucl. Magn. Reson. Spectrosc. 69, 1-22 (2013).
- Dürr, U. H. N., Gildenberg, M., Ramamoorthy, A. The magic of bicelles lights up membrane protein structure. Chem. Rev. 112, 6054-6074 (2012).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lepidic bicelle method. J. Vis. Exp. (59), (2012).
- Barbosa-Barros, L., et al. Bicelles: lipid nanostructured platforms with potential dermal applications. Small. 6, 807-818 (2012).
- Lin, L., et al. Hybrid bicelles as a pH-sensitive nanocarrier for hydrophobic drug delivery. RSC Adv. 6, 79811-79821 (2016).
- Beck, P., et al. Novel type of bicellar disks from a mixture of DMPC and DMPE-DTPA with complexed lanthanides. Langmuir. 26 (8), 5382-5387 (2010).
- Liebi, M. . Tailored phospholipid bicelles to generate magnetically switchable material. , (2013).
- Liebi, M., et al. Magnetically enhanced bicelles delivering switchable anisotropy in optical gels. ACS. Appl. Mater. Interfaces. 6 (2), 1100-1105 (2014).
- Liebi, M., et al. Alignment of bicelles studied with high-field magnetic birefringence and small-angle neutron scattering measurements. Langmuir. 29, 3467-3473 (2013).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys J. 74, 2405-2418 (1998).
- Prosser, R. S., Bryant, H., Bryant, R. G., Vold, R. R. Lanthanide chelates as bilayer alignment tools in NMR studies of membrane-associated peptides. J. Magn. Reson. 141, 256-260 (1999).
- Liebi, M., Kohlbrecher, J., Ishikawa, T., Fischer, P., Walde, P., Windhab, E. J. Cholesterol increases the magnetic aligning of bicellar disks from an aqueous mixture of DMPC and DMPE-DTPA with complexed thulium ions. Langmuir. 28 (29), 10905-10915 (2012).
- Liebi, M., et al. Cholesterol-diethylenetriaminepentaacetate complexed with thulium ions integrated into bicelles to increase their magnetic alignability. J. Phys. Chem. B. 117 (47), 14743-14748 (2013).
- Isabettini, S., et al. Tailoring bicelle morphology and thermal stability with lanthanide-chelating cholesterol conjugates. Langmuir. 32, 9005-9014 (2016).
- Isabettini, S., et al. Mastering the magnetic susceptibility of magnetically responsive bicelles with 3β-Amino-5-Cholestene and complexed lanthanide ions. Phys. Chem. Chem. Phys. 19, 10820-10824 (2017).
- De Angelis, A. A., Opella, S. J. Bicelle samples for solid-state NMR of membrane proteins. Nat. Protoc. 2 (10), 2332-2338 (2007).
- Son, W. S., et al. “Q-Titration” of long-chain and short-chain lipids differentiates between structured and mobile residues of membrane proteins studied in bicelles by solution NMR spectroscopy. J. Magn. Reson. 214, 111-118 (2012).
- . Bicelle Preparation Available from: https://avantilipids.com/tech-support/liposome-preparation/bicelle-preparation (2017)
- Isabettini, S., et al. Methods for Generating Highly Magnetically Responsive Lanthanide-Chelating Phospholipid Polymolecular Assemblies. Langmuir. 33, 6363-6371 (2017).
- Nieh, M. -. P., Glinka, C. J., Krueger, S., Prosser, R. S., Katsaras, J. SANS study on the effect of lanthanide ions and charged lipids on the morphology of phospholipid mixtures. Biophysical Journal. 82 (5), 2487-2498 (2002).
- Watts, A., Spooner, P. J. R. Phospholipid phase transitions as revealed by NMR. Chem. Phys. Lip. 57, 195-211 (1991).
- Bleaney, B. Nuclear magnetic-resonance shifts in solution due to lanthanide ions. J. Magn. Reson. 8, 91-100 (1972).
- Prosser, R. S., Volkov, V. B., Shiyanovskaya, I. V. Solid-state NMR studies of magnetically aligned phospholipid membranes: taming lanthanides for membrane protein studies. Biochem. Cell Biol. 76, 443-451 (1998).
- Prosser, R. S., Volkov, V. B., Shiyanovskaya, I. V. Novel chelate-induced magnetic alignment of biological membranes. Biophys. J. 75, 2163-2169 (1998).
- Shklyarevskiy, I. O., et al. Magnetic alignment of self-assembled anthracene organogel fibers. Langmuir. 21, 2108-2112 (2005).
- Christianen, P. C. M., Shklyarevskiy, I. O., Boamfa, M. I., Maan, J. C. Alignment of molecular materials in high magnetic fields. Physica B: Condens. Matter. 346, 255-261 (2004).
- Maret, G., Dransfeld, K. Biomolecules and polymers in high steady magnetic fields. Top. App. Phys. 57, 143-204 (1985).
- Gielen, J. C., Shklyarevskiy, I. O., Schenning, A. P. H. J., Christianen, P. C. M., Maan, J. C. Using magnetic birefringence to determine the molecular arrangement of supramolecular nanostructures. Sci. Tech. Adv. Mater. 10 (1), 014601 (2009).
- Shklyarevskiy, I. O. . Deformation and ordering of molecular assemblies in high magnetic fields. , (2005).
- Fuller, G. G. . Optical rheometry of complex fluids. , (1995).
- Walde, P., Cosentino, K., Engel, H., Stano, P. Giant vesicles: preparations and applications. ChemBioChem. 11, 848-865 (2010).
- . Liposome Preparation Available from: https://avantilipids.com/tech-support/liposome-preparation (2017)
- . Preparing Large, Unilamellar Vesicles by Extrusion (LUVET) Available from: https://avantilipids.com/tech-support/liposome-preparation/luvet (2017)
- Isabettini, S., et al. Molecular engineering of lanthanide ion chelating phospholipids generating assemblies with a switched magnetic susceptibility. Phys. Chem. Chem. Phys. 19, 20991-21002 (2017).
- Battaglia, M. R., Ritchie, G. L. D. Molecular magnetic anisotropies from the Cotton-Mouton effect. J. Chem. Soc., Faraday Trans. 2. 73 (2), 209-221 (1977).
- Sprunt, S., Nounesis, G., Litster, J. D., Ratna, B., Shashidhar, R. High-field magnetic birefringence study of the phase behavior of concentrated solutions of phospholipid tubules. Phys. Rev. E. 48 (1), 328-339 (1993).
- Zhao, J., et al. Continuous paranematic ordering of rigid and semiflexible amyloid-Fe3O4 hybrid fibrils in an external magnetic field. Biomacromolecules. 17 (8), 2555-2561 (2016).

