Fertigung-Verfahren und Doppelbrechung Messungen für die Gestaltung von magnetisch reagieren Lanthanoid-Ionen chelatisierenden Phospholipid-Baugruppen
Summary
Fertigung-Verfahren für stark magnetisch reagieren Lanthanoid-Ionen chelatisierenden Polymolecular Baugruppen werden vorgestellt. Die magnetische Antwort richtet sich nach der Montage Größe, die durch Extrusion durch Nanopore Membranen zugeschnitten ist. Die Assemblys magnetische Alignability und temperaturbedingte strukturelle Veränderungen werden durch Doppelbrechung Messungen, eine kostenlose Technik, NMR- und kleinen Winkel Neutronenstreuung überwacht.
Abstract
Bicelles sind abstimmbaren scheibenartigen Polymolecular Baugruppen gebildet aus einer Vielzahl von Lipid-Mischungen. Anwendungen reichen von Membran-Protein strukturelle Studien durch Kernspinresonanz (NMR), nanotechnologischen Entwicklungen einschließlich der Bildung von optisch aktiven und magnetisch umschaltbar Gele. Solche Technologien erfordern hohe Kontrolle der Montage Größe, magnetische Resonanz und thermischen Widerstand. Mischungen von 1,2-Dimyristoyl –sn– Glycero-3-Phosphocholin (DMPC) und seine Lanthanoid-Ionen (Ln3 +) chelatisierenden Phospholipid-Konjugat, 1,2-Dimyristoyl –sn– Glycero-3-Phospho-Ethanolamin-Diethylenglykol Triaminepentaacetate () DMPE-DTPA), in stark magnetisch reagieren Baugruppen wie DMPC/DMPE-DTPA/Ln3 + montieren (molares Verhältnis 4:1:1) Bicelles. Einführung von Cholesterin (Chol-OH) und Steroid-Derivate in der Bilayer führt zu einem anderen Satz von Assemblys bietet einzigartige physikalisch-chemischen Eigenschaften. Für eine gegebene Lipidzusammensetzung ist die magnetische Alignability proportional zur Bicelle Größe. Die Komplexierung von Ln3 + führt zu noch nie da gewesenen magnetische Antworten in Bezug auf Größe und Ausrichtung Richtung. Die Thermo-Reversible reduzieren der scheibenartigen Strukturen in Vesikeln beim Erhitzen können Anpassung die Assemblys Dimensionen durch Extrusion durch Membranfilter mit definierten Porengrößen. Die magnetisch anreihbar Bicelles werden regeneriert, durch kühlen auf 5 ° C, wodurch Einbaumaße durch die Vesikel Vorläufer definiert. Hierin, dieses Fertigung-Verfahren erläutert und die magnetische Alignability der Baugruppen wird durch Doppelbrechung Messungen unter 5,5 T Magnetfeld quantifiziert. Die Doppelbrechung Signal, aus dem Phospholipid Bilayer ermöglicht weitere Überwachung der Polymolecular Veränderungen in der Bilayer. Diese einfache Technik ist komplementär zur NMR-Experimente, die häufig eingesetzt werden, um Bicelles zu charakterisieren.
Introduction
Bicelles sind scheibenartige Polymolecular Baugruppen aus zahlreiche Lipid-Mischungen gewonnen. 1 , 2 , 3 , 4 , 5 sie sind für die strukturelle Charakterisierung von Membran Biomoleküle durch NMR-Spektroskopie verbreitet. 6 , 7 jüngste Bemühungen sollen jedoch das Feld der Anwendungsmöglichkeiten zu erweitern. 5 , 8 , 9 das am meisten untersuchte Bicelle System besteht aus einer Mischung von 1,2-Dimyristoyl –sn– Glycero-3-Phosphocholin (DMPC), die planar Bestandteil der Versammlung und 1,2-Dihexanoyl –sn– Glycero-3-Phosphocholin (DHCP) Phospholipid über den Rand. 1 , 2 , 3 die molekulare Geometrie der Phospholipide, die Komposition der Bilayer bestimmen die Architektur der selbstgebaute Polymolecular Struktur. 4 , 5 Ersatz DHCP mit DMPE-DTPA erzeugt sehr magnetisch reagieren und einstellbaren Bicelle Systeme. 10 , 11 DMPC/DMPE-DTPA/Ln3 + (molares Verhältnis 4:1:1) Bicelles assoziieren mit vielen mehr paramagnetischen Lanthanoid-Ionen (Ln3 +) auf der Bilayer Oberfläche, wodurch eine verbesserte magnetische Antwort. 10 im übrigen ersetzt die wasserlösliche DHCP-Moleküle mit DMPE-DTPA/Ln3 + ermöglicht die Bildung von Verdünnung-resistente Bicelles. 11
Die magnetische Alignability planare Polymolecular Baugruppen wird durch ihre insgesamt magnetische Energie diktiert,
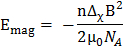 (1)
(1)
wo B die magnetische Feldstärke ist, 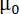 die magnetische Konstante, n die Aggregation Anzahl und
die magnetische Konstante, n die Aggregation Anzahl und 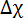 der molekularen diamagnetische Suszeptibilität Anisotropie der Lipide der Bilayer zu komponieren. Daher ist die Reaktion der DMPC/DMPE-DTPA/Ln3 + Bicelles auf magnetische Felder durch ihre Größe (aggregierte Zahl n) und der molekularen diamagnetische Suszeptibilität Anisotropie Δχ zugeschnitten. Letzteres wird leicht durch Änderung der Art der Chelat Ln3 +erreicht. 12 , 13 , 14 , 15 Introducing Cholesterin (Chol-OH) oder anderen Steroid Derivate in der Bilayer bietet die Möglichkeit des Tunings die aggregierte Anzahl n und der magnetischen Suszeptibilität Δχ der Baugruppen. 11 , 16 , 17 , 18 , 19 für einen gegebenen Lipidzusammensetzung enthalten größere Baugruppen mehr Lipide in der Lage, einen Beitrag zur E-Mag (größer aggregierte Zahl n), was zu mehr Einlaufkästen Arten. Die Größe der DMPC/DHCP Bicelles ist z. B. konventionell durch Optimierung der kompositorischen Lipidkonzentration Verhältnis oder insgesamt gesteuert. 20 , 21 , 22 auch wenn dies in DMPC/DMPE-DTPA/Ln3 + Bicelles möglich ist, ihre Thermo-Reversible Umwandlung von Bicelle zu Bläschen auf Heizung Angebote Schneiderei Optionen hinzugefügt. Mechanische bedeutet wie Extrusion durch Membranfilter ermöglicht die Gestaltung der Vesikel. Die magnetisch anreihbar Bicelles werden beim Abkühlen auf 5 ° C regeneriert und ihre Dimensionen sind aus der Vesikel-Vorstufen diktiert. 11 Herein, wir konzentrieren uns auf das Potenzial der mechanischen Fertigung Verfahren mit DMPC/DMPE-DTPA/Tm3 + (molares Verhältnis 4:1:1) oder DMPC/Chol-OH/DMPE-DTPA/Tm3 + (Molverhältnis 16:4:5:5) als Bezugssysteme. Der Prozess funktioniert analog bei der Arbeit mit anderen Ln3 + als Tm3 +. Die breite Palette von Möglichkeiten, die diese Techniken sind in Abbildung 1 hervorgehoben und an anderer Stelle ausführlich erläutert. 23
der molekularen diamagnetische Suszeptibilität Anisotropie der Lipide der Bilayer zu komponieren. Daher ist die Reaktion der DMPC/DMPE-DTPA/Ln3 + Bicelles auf magnetische Felder durch ihre Größe (aggregierte Zahl n) und der molekularen diamagnetische Suszeptibilität Anisotropie Δχ zugeschnitten. Letzteres wird leicht durch Änderung der Art der Chelat Ln3 +erreicht. 12 , 13 , 14 , 15 Introducing Cholesterin (Chol-OH) oder anderen Steroid Derivate in der Bilayer bietet die Möglichkeit des Tunings die aggregierte Anzahl n und der magnetischen Suszeptibilität Δχ der Baugruppen. 11 , 16 , 17 , 18 , 19 für einen gegebenen Lipidzusammensetzung enthalten größere Baugruppen mehr Lipide in der Lage, einen Beitrag zur E-Mag (größer aggregierte Zahl n), was zu mehr Einlaufkästen Arten. Die Größe der DMPC/DHCP Bicelles ist z. B. konventionell durch Optimierung der kompositorischen Lipidkonzentration Verhältnis oder insgesamt gesteuert. 20 , 21 , 22 auch wenn dies in DMPC/DMPE-DTPA/Ln3 + Bicelles möglich ist, ihre Thermo-Reversible Umwandlung von Bicelle zu Bläschen auf Heizung Angebote Schneiderei Optionen hinzugefügt. Mechanische bedeutet wie Extrusion durch Membranfilter ermöglicht die Gestaltung der Vesikel. Die magnetisch anreihbar Bicelles werden beim Abkühlen auf 5 ° C regeneriert und ihre Dimensionen sind aus der Vesikel-Vorstufen diktiert. 11 Herein, wir konzentrieren uns auf das Potenzial der mechanischen Fertigung Verfahren mit DMPC/DMPE-DTPA/Tm3 + (molares Verhältnis 4:1:1) oder DMPC/Chol-OH/DMPE-DTPA/Tm3 + (Molverhältnis 16:4:5:5) als Bezugssysteme. Der Prozess funktioniert analog bei der Arbeit mit anderen Ln3 + als Tm3 +. Die breite Palette von Möglichkeiten, die diese Techniken sind in Abbildung 1 hervorgehoben und an anderer Stelle ausführlich erläutert. 23
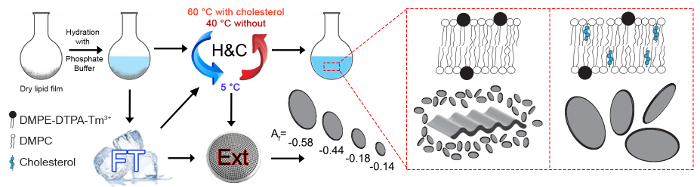
Abbildung 1: Schematische Übersicht über die möglichen Herstellung Verfahren. Die studierten magnetisch Einlaufkästen Ln3 + Komplexbildner Polymolecular Baugruppen bestehen aus entweder DMPC/DMPE-DTPA/Tm3 + (molares Verhältnis 4:1:1) oder DMPC/Chol-OH/DMPE-DTPA/Tm3 + (Molverhältnis 16:4:5:5). Die trockenen Lipid-Film wird mit einem 50 mM-Phosphat-Puffer auf einen pH-Wert von 7,4 hydratisiert und die gesamten Lipidkonzentration beträgt 15 mM. Eine effektive Hydratation der Lipid-Film erfordert entweder Einfrieren Auftauen Zyklen (FT) oder Heizen und kühlen Zyklen (H & C). H & C Zyklen sind notwendig, Proben nach dem letzten Einfrieren Auftauen Schritt regenerieren oder regenerieren Proben über einen längeren Zeitraum hinweg eingefroren aufbewahrt, wenn sie ohne weitere Extrusion verwendet werden sollen. Diese Schritte werden von Isabettini Et al.ausgiebig diskutiert. 23 maximal anreihbar Polymolecular Baugruppen werden erreicht, liefern verschiedene Montage-Architekturen basierend auf der Lipidzusammensetzung. Die Bicelle Größe und magnetische Alignability ist abstimmbaren durch Extrusion (Ext) durch Nanopore Membranfilter. Dargestellten Ausrichtung Faktoren Af wurden berechnet aus 2D kleiner Winkel Neutron (SANS) Streubildern einer DMPC/Chol-OH/DMPE-DTPA/Tm3 + (Molverhältnis 16:4:5:5) Probe extrudiert über 800, 400, 200 oder 100 nm Poren. SANS Messungen sind ergänzende Mittel zur Quantifizierung der Bicelle Ausrichtung, die im Detail hier nicht abgedeckt werden. 11 , 16 die A-f reicht von-1 (parallele Neutronenstreuung oder senkrechte Ausrichtung des Bicelles in Bezug auf die Richtung des Magnetfeldes) bis 0 für isotrope Lichtstreuung.Bitte klicken Sie hier, um eine größere Version dieser Figur.
Die Struktur des Bicelles wurde durch eine Vielzahl von Charakterisierung Techniken ausgiebig untersucht. 13 die Ausrichtung des Bicelles, einem Magnetfeld ausgesetzt wurde quantifiziert, entweder mithilfe NMR-Spektroskopie oder kleinen Winkel Neutron Streuexperimente (SANS). 5 , 10 , 11 , 12 , 13 , 16 , 17 , 18 , 19 , 24 , 25 sind jedoch die Verschiebung und Verbreiterung der NMR Spitzen Auftritt im Beisein von Ln3 + gravierende Einschränkungen der Methode. 15 , 26 , 27 , 28 obwohl SANS Experimente nicht leiden diese Einschränkung, alternative und mehr zugängliche Techniken sind wünschenswert für routinemäßige Quantifizierung von magnetisch induzierte Ausrichtung von Baugruppen in Lösung. Doppelbrechung Messungen sind eine vergleichsweise einfache und praktikable Alternative. Analog zeigen NMR-Experimente, Doppelbrechung Messungen wertvolle Informationen über Lipid Umgestaltungen und Lipid-Phasen in der Bilayer auftreten. Darüber hinaus sind geometrische Transformationen, die in der Polymolecular-Versammlung mit wechselnden Umweltbedingungen wie Temperatur überwacht. 11 , 12 , 13 , 16 magnetisch induzierte Doppelbrechung Δn′ wurde verwendet, um verschiedene Arten von Phospholipid-Systeme zu studieren. 13 , 29 , 30 Doppelbrechung Messungen auf der Grundlage der Phasenmodulation Technik in einem Magnetfeld ist eine praktikable Methode, um Ausrichtung des Bicelles zu erkennen. 12 , 16 , 18 , 29 , 31 , 32 die Möglichkeit der Untersuchung von Bicelles mit Doppelbrechung in hohen Magnetfeldern bis zu 35 T zeigte auch von M. Liebi Et al. 13
Wenn polarisiertes Licht ein anisotropen Materials tritt, wird es in einer ordentlichen und außerordentlichen Welle gebrochen. 11 die zwei Wellen haben unterschiedliche Geschwindigkeiten und werden durch eine Verzögerung δ in Phase verschoben. Der Grad der Behinderung δ gemessen und in eine Doppelbrechung Signal umgewandelt 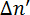 , den Grad der Anisotropie in der materiellen mit zu quantifizieren
, den Grad der Anisotropie in der materiellen mit zu quantifizieren
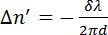 (2)
(2)
wo λ ist die Wellenlänge des Lasers und d ist die Dicke der Probe. Phospholipide sind optisch anisotropen und ihre optische Achse deckt sich mit ihren langen molekularen Achsen parallel zu den Kohlenwasserstoff-Schwänzen. 11 , 12 keine Retardierung wird gemessen, wenn die Phospholipide in Lösung nach dem Zufallsprinzip orientiert sind. Retardierung wird gemessen, wenn Phospholipide parallel zueinander ausgerichtet sind. Der magnetisch induzierte Doppelbrechung 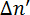 haben einen positiven oder negativen Vorzeichen abhängig von der Orientierung der Moleküle in das magnetische Feld; siehe Abbildung 2. Phospholipide, die parallel zur x-Achse ausgerichtet führt zu einer negativen
haben einen positiven oder negativen Vorzeichen abhängig von der Orientierung der Moleküle in das magnetische Feld; siehe Abbildung 2. Phospholipide, die parallel zur x-Achse ausgerichtet führt zu einer negativen 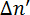 , während die ausgerichteten entlang der z-Achse zur Folge haben einer positives
, während die ausgerichteten entlang der z-Achse zur Folge haben einer positives 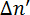 . Keine Doppelbrechung wird beobachtet, wenn die optische Achse mit der Richtung der Lichtausbreitung fällt, wie die Phospholipid Parallel zur y-Achse ausgerichtet.
. Keine Doppelbrechung wird beobachtet, wenn die optische Achse mit der Richtung der Lichtausbreitung fällt, wie die Phospholipid Parallel zur y-Achse ausgerichtet.
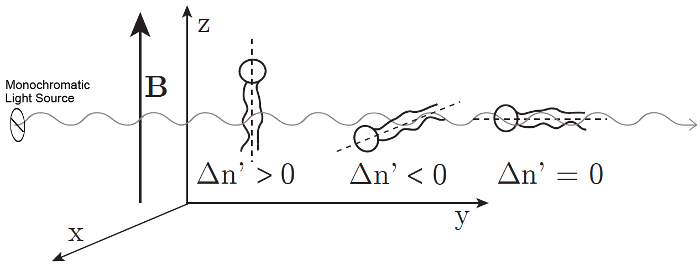
Abbildung 2: Ausrichtung der Phospholipide und der entsprechenden Zeichen der magnetisch induzierte Doppelbrechung 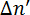 . Das Zeichen des gemessenen
. Das Zeichen des gemessenen 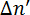 richtet sich nach der Ausrichtung des Phospholipid im Magnetfeld. Gestrichelte Linien zeigen die optische Achse des Moleküls. Das Licht ist um 45° polarisiert und breitet sich in y-Richtung. Das Magnetfeld B befindet sich in Z-Richtung. Diese Zahl wurde von M. Liebi geändert. 11 Klicken Sie bitte hier, um eine größere Version dieser Figur.
richtet sich nach der Ausrichtung des Phospholipid im Magnetfeld. Gestrichelte Linien zeigen die optische Achse des Moleküls. Das Licht ist um 45° polarisiert und breitet sich in y-Richtung. Das Magnetfeld B befindet sich in Z-Richtung. Diese Zahl wurde von M. Liebi geändert. 11 Klicken Sie bitte hier, um eine größere Version dieser Figur.
Im Falle einer isotropen kolloidale Suspension von Bicelles wird die Ausrichtung durch die Anordnung der Phospholipide in der Bilayer induzierte Nullung Retardierung δ verloren gehen. Die Bicelles müssen auch ausrichten, um die optisch aktive Phospholipide in ihre Bilayer, verursacht eine Verzögerung δ von polarisiertem Licht orientieren. Infolgedessen ist die Doppelbrechung sensible Werkzeug, das magnetische Alignability Polymolecular Baugruppen zu quantifizieren. Bicelles ausgerichtet senkrecht zum Magnetfeld ergibt eine Positive 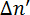 , während die parallel ausgerichtet eine Negative erbringt
, während die parallel ausgerichtet eine Negative erbringt 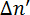 . Das Schild hängt von der Ausrichtung des Setups und kann mit einer Referenzprobe überprüft werden.
. Das Schild hängt von der Ausrichtung des Setups und kann mit einer Referenzprobe überprüft werden.
Protocol
Representative Results
Discussion
Eine detaillierte Darstellung der wie Doppelbrechung Messungen in Kombination mit SANS verwendet wurden Experimente um zu bewerten Methoden zur Erzeugung von sehr magnetisch reagieren Ln3 + chelatisierenden Phospholipide Baugruppen ist in Isabettini Et al. 23 die vorgeschlagene Herstellung Protokolle gelten auch für Baugruppen bestehend aus der längeren DPPC und BPUK-DTPA Phospholipide oder für solche, die chemisch veränderter Steroid Derivate in ihren Bilayer. <sup class="…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Die Autoren erkennen des Schweizer Nationalfonds zur Finanzierung der SMhardBi (Projekt Nr. 200021_150088/1). Die SANS-Experimente wurden an der Schweizer Spallation Neutronenquelle SINQ, Paul Scherrer Instute, Villigen, Schweiz durchgeführt. Die Autoren danken Dr. Joachim Kohlbrecher für seine Führung mit den SANS-Experimenten. Die Doppelbrechung Messaufbau unter hohen Magnetfeldern inspiriert aus der bestehenden Einrichtung im Hochfeld-magnetische Labor HFML, Nijmegen, Niederlande. Wir danken Jan Corsano, Bruno Pfister für seine Hilfe bei der Entwicklung der Elektronik der Doppelbrechung Setup und Daniel Kiechl für den Bau der Frameworks erlaubt feine und einfache Ausrichtung des Lasers und Dr. Bernhard Koller für laufende technische Unterstützung.
Materials
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) | Avanti Polar Lipids | 850345P | >99% |
| 1,2-dimyristoyl-sn-glycero-3-phospho-ethanolamine-diethylene triaminepentaacetate acid hexammonium salt (DMPE-DTPA) | Avanti Polar Lipids | 790535P | >99% |
| Thulium(III) chloride | Sigma-Aldrich | 439649 | anhydrous, powder, 99.9% trace metals basis |
| Dysprosium(III) chloride | Sigma-Aldrich | 325546 | anhydrous, powder, 99.9% trace metals basis |
| Ytterbium(III) chloride | Sigma-Aldrich | 439614 | anhydrous, powder, 99.9% trace metals basis |
| Chloroform | Sigma-Aldrich | 319988 | contains ethanol as stabilizer, ACS reagent, ≥99.8% |
| Methanol | Sigma-Aldrich | 34860 | ≥99.9% |
| Cholesterol | Amresco | 433 | Ultra pure grade |
| D2O | ARMAR chemicals | 1410 | 99.8 atom % D |
| Ultrapure water | Millipore | Synergy pak2 (SYPK0SIX2), Millipack GP (MPGP02001) | |
| electronic pH meter | Metrohm | 17440010 | |
| Whatmann Nuclepore 25 mm 100nm membrane filter | VWR | 515-2028 | |
| Whatmann Nuclepore 25 mm 200nm membrane filter | VWR | 515-2029 | |
| Whatmann Nuclepore 25 mm 400nm membrane filter | VWR | 515-2030 | |
| Whatmann Nuclepore 25 mm 800nm membrane filter | VWR | 515-2032 | |
| Whatmann Filter paper | VWR | 230600 | |
| 25 ml round bottom flask | VWR | 201-1352 | 14/23 NS |
| 3 ml glass snap-cup | VWR | 548-0554 | ND18, 18x30mm |
| 2.5 ml glass syringe | Hamilton | ||
| Sodium dihydrogen phosphate dihydrate | Merk | 1.06342 | Salt used to make phosphate buffer |
| di-Sodium hydrogen phosphate | Merk | 1.06586 | Salt used to make phosphate buffer |
| Liquid Nitrogen | Carbagas | – | |
| Pressurized Nitrogen gas | Carbagas | – | 200 bar bottle |
| Lipid Extruder 10 ml | Lipex | – | Fully equipped with thermobarrel |
| High-pressure PVC tube | GR NETUM | – | must resist more than 4 MPa |
| Serto adaptors | Sertot | – | |
| Nitrile gloves | VWR | – | |
| 2 ml glass pipettes | VWR | 612-1702 | 230 mm long |
| Diode Laser | Newport | LPM635-25C | |
| DSP Dual Phase Lock-in Amplifier | SRS | SR830 | |
| Photodiode Detector | Silonex Inc. | SLSD-71N5 | 5mm2, Silicon, photo-conductive |
| 5.5 T Cryogenic Magnetic | Cryogenic/Oerlikon AG | – | 12 bar He-cooled. RW4000/6000 compressor, RGD 5/100 TA cryo-head |
| Second order low pass filter | home-built | – | Linear power supply 24V DC, second order, Sallen Key, cut-off frequency 360 Hz, +/- 12V, max 10 mA |
| Photoelastic modulator | Hinds instruments | PEM-90 | |
| Glan-Thompson Calcite Polarizer | Newport | 10GT04 | 25.4mm diameter |
| Quartz sample cuvette | Hellma | 165-10-40 | temperature controlled cell, 0.8 ml, 10mm path length |
| Temperature probe | Thermocontrol | – | Type K, 0.5mm diameter, Thermocoax |
| Non-polarizing mirrors | Newport | 50326-1002 | 25.4mm |
| RS 232 cables | National Instruments | 189284-02 | For Connecting to the RS-232 Port on the front of Compact FieldPoint Controllers |
| BNC 50 Ω cable and connectors | National Instruments | 763389-01 | |
| cFP-AI-110 | National Instruments | 777318-110 | 8-Channel Analog Voltage and Current Input Module for Compact FieldPoint |
| cFP-CB-1 | National Instruments | 778618-01 | Integrated Connector Block for Wiring to Compact FieldPoint I/O |
| cFP-CB-3 | National Instruments | 778618-03 | Integrated Isothermal Connector Block for Wiring Thermocouples to the cFP-TC-120 Module |
| cFP-TC-120 | National Instruments | 777318-120 | 8-Channel Thermocouple Input Module for Compact FieldPoint |
| cFP-1804 | National Instruments | 779490-01 | Ethernet/Serial Interface for NI Compact FieldPoint |
| LabView 2010 | National Instruments | – | |
| Industrial power supply | Traco Power | TCL 060-124 | 100-240V AC |
| Waterbath | Julabo | FP40-HE | refrigerated/Heating Circulator |
References
- Sanders, C. R., Hare, B. J., Howard, K. P., Prestegard, J. H. Magnetically-oriented phospholipid micelles as a tool for the study of membrane-associated molecules. Prog. Nucl. Magn. Reson. Spectrosc. 26, 421-444 (1994).
- Glover, K. J., et al. Structural evaluation of phospholipid bicelles for solution-state studies of membrane-associated biomolecules. Biophys. J. 81 (4), 2163-2171 (2001).
- Katsaras, J. H. T. A., Pencer, J., Nieh, M. -. P. “Bicellar” lipid mixtures as used in biochemical and biophysical studies. Naturwissenschaften. 92 (8), 355-366 (2005).
- Sanders, C. R., Prosser, R. S. Bicelles: a model membrane system for all seasons?. Structure. 6 (10), 1227-1234 (1998).
- Dürr, U. H. N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: birth and coming of age of lipid bicelles. Prog. Nucl. Magn. Reson. Spectrosc. 69, 1-22 (2013).
- Dürr, U. H. N., Gildenberg, M., Ramamoorthy, A. The magic of bicelles lights up membrane protein structure. Chem. Rev. 112, 6054-6074 (2012).
- Ujwal, R., Abramson, J. High-throughput crystallization of membrane proteins using the lepidic bicelle method. J. Vis. Exp. (59), (2012).
- Barbosa-Barros, L., et al. Bicelles: lipid nanostructured platforms with potential dermal applications. Small. 6, 807-818 (2012).
- Lin, L., et al. Hybrid bicelles as a pH-sensitive nanocarrier for hydrophobic drug delivery. RSC Adv. 6, 79811-79821 (2016).
- Beck, P., et al. Novel type of bicellar disks from a mixture of DMPC and DMPE-DTPA with complexed lanthanides. Langmuir. 26 (8), 5382-5387 (2010).
- Liebi, M. . Tailored phospholipid bicelles to generate magnetically switchable material. , (2013).
- Liebi, M., et al. Magnetically enhanced bicelles delivering switchable anisotropy in optical gels. ACS. Appl. Mater. Interfaces. 6 (2), 1100-1105 (2014).
- Liebi, M., et al. Alignment of bicelles studied with high-field magnetic birefringence and small-angle neutron scattering measurements. Langmuir. 29, 3467-3473 (2013).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys J. 74, 2405-2418 (1998).
- Prosser, R. S., Bryant, H., Bryant, R. G., Vold, R. R. Lanthanide chelates as bilayer alignment tools in NMR studies of membrane-associated peptides. J. Magn. Reson. 141, 256-260 (1999).
- Liebi, M., Kohlbrecher, J., Ishikawa, T., Fischer, P., Walde, P., Windhab, E. J. Cholesterol increases the magnetic aligning of bicellar disks from an aqueous mixture of DMPC and DMPE-DTPA with complexed thulium ions. Langmuir. 28 (29), 10905-10915 (2012).
- Liebi, M., et al. Cholesterol-diethylenetriaminepentaacetate complexed with thulium ions integrated into bicelles to increase their magnetic alignability. J. Phys. Chem. B. 117 (47), 14743-14748 (2013).
- Isabettini, S., et al. Tailoring bicelle morphology and thermal stability with lanthanide-chelating cholesterol conjugates. Langmuir. 32, 9005-9014 (2016).
- Isabettini, S., et al. Mastering the magnetic susceptibility of magnetically responsive bicelles with 3β-Amino-5-Cholestene and complexed lanthanide ions. Phys. Chem. Chem. Phys. 19, 10820-10824 (2017).
- De Angelis, A. A., Opella, S. J. Bicelle samples for solid-state NMR of membrane proteins. Nat. Protoc. 2 (10), 2332-2338 (2007).
- Son, W. S., et al. “Q-Titration” of long-chain and short-chain lipids differentiates between structured and mobile residues of membrane proteins studied in bicelles by solution NMR spectroscopy. J. Magn. Reson. 214, 111-118 (2012).
- . Bicelle Preparation Available from: https://avantilipids.com/tech-support/liposome-preparation/bicelle-preparation (2017)
- Isabettini, S., et al. Methods for Generating Highly Magnetically Responsive Lanthanide-Chelating Phospholipid Polymolecular Assemblies. Langmuir. 33, 6363-6371 (2017).
- Nieh, M. -. P., Glinka, C. J., Krueger, S., Prosser, R. S., Katsaras, J. SANS study on the effect of lanthanide ions and charged lipids on the morphology of phospholipid mixtures. Biophysical Journal. 82 (5), 2487-2498 (2002).
- Watts, A., Spooner, P. J. R. Phospholipid phase transitions as revealed by NMR. Chem. Phys. Lip. 57, 195-211 (1991).
- Bleaney, B. Nuclear magnetic-resonance shifts in solution due to lanthanide ions. J. Magn. Reson. 8, 91-100 (1972).
- Prosser, R. S., Volkov, V. B., Shiyanovskaya, I. V. Solid-state NMR studies of magnetically aligned phospholipid membranes: taming lanthanides for membrane protein studies. Biochem. Cell Biol. 76, 443-451 (1998).
- Prosser, R. S., Volkov, V. B., Shiyanovskaya, I. V. Novel chelate-induced magnetic alignment of biological membranes. Biophys. J. 75, 2163-2169 (1998).
- Shklyarevskiy, I. O., et al. Magnetic alignment of self-assembled anthracene organogel fibers. Langmuir. 21, 2108-2112 (2005).
- Christianen, P. C. M., Shklyarevskiy, I. O., Boamfa, M. I., Maan, J. C. Alignment of molecular materials in high magnetic fields. Physica B: Condens. Matter. 346, 255-261 (2004).
- Maret, G., Dransfeld, K. Biomolecules and polymers in high steady magnetic fields. Top. App. Phys. 57, 143-204 (1985).
- Gielen, J. C., Shklyarevskiy, I. O., Schenning, A. P. H. J., Christianen, P. C. M., Maan, J. C. Using magnetic birefringence to determine the molecular arrangement of supramolecular nanostructures. Sci. Tech. Adv. Mater. 10 (1), 014601 (2009).
- Shklyarevskiy, I. O. . Deformation and ordering of molecular assemblies in high magnetic fields. , (2005).
- Fuller, G. G. . Optical rheometry of complex fluids. , (1995).
- Walde, P., Cosentino, K., Engel, H., Stano, P. Giant vesicles: preparations and applications. ChemBioChem. 11, 848-865 (2010).
- . Liposome Preparation Available from: https://avantilipids.com/tech-support/liposome-preparation (2017)
- . Preparing Large, Unilamellar Vesicles by Extrusion (LUVET) Available from: https://avantilipids.com/tech-support/liposome-preparation/luvet (2017)
- Isabettini, S., et al. Molecular engineering of lanthanide ion chelating phospholipids generating assemblies with a switched magnetic susceptibility. Phys. Chem. Chem. Phys. 19, 20991-21002 (2017).
- Battaglia, M. R., Ritchie, G. L. D. Molecular magnetic anisotropies from the Cotton-Mouton effect. J. Chem. Soc., Faraday Trans. 2. 73 (2), 209-221 (1977).
- Sprunt, S., Nounesis, G., Litster, J. D., Ratna, B., Shashidhar, R. High-field magnetic birefringence study of the phase behavior of concentrated solutions of phospholipid tubules. Phys. Rev. E. 48 (1), 328-339 (1993).
- Zhao, J., et al. Continuous paranematic ordering of rigid and semiflexible amyloid-Fe3O4 hybrid fibrils in an external magnetic field. Biomacromolecules. 17 (8), 2555-2561 (2016).

