Analisi di minerali prodotto da hFOB 1.19 e Saos-2 cellule mediante microscopia elettronica a trasmissione con microanalisi a raggi x dispersiva di energia
Summary
Vi presentiamo un protocollo per confrontare lo stato di minerali in vescicole rilasciate da due linee di cellule di osso umano: hFOB 1,19 e Saos-2. I profili di mineralizzazione sono stati analizzati da Alizarin Red-S (AR-S) colorazione, ultravioletto (UV) luce visualizzazione, formazione immagine di microscopia elettronica (TEM) di trasmissione e microanalisi a raggi x dispersiva di energia (EDX).
Abstract
Questo video presenta l’uso di microscopia elettronica di trasmissione con microanalisi a raggi x dispersiva di energia (TEM-EDX) di confrontare lo stato di minerali in vescicole rilasciate da due linee di cellule di osso umano: hFOB 1,19 e Saos-2. Queste linee cellulari, dopo il trattamento con acido ascorbico (AA) e β-glicerofosfato (β-GP), subiscono transdifferenziazione osteogenica completa dalla proliferazione di mineralizzazione e produrre vescicole di matrice (MVs) che attivano la nucleazione apatite nella matrice extracellulare (ECM).
Basato su Alizarin Red-S (AR-S) colorazione e analisi della composizione dei minerali in lisati cellulari utilizzando la luce ultravioletta (UV) o in vescicole usando la formazione immagine TEM seguita da EDX quantificazione e mappatura dello ione, possiamo dedurre che osteosarcoma Saos-2 e osteoblastica le cellule hFOB 1.19 rivelano profili distinti di mineralizzazione. Cellule Saos-2 mineralizzano in modo più efficiente rispetto alle cellule hFOB 1.19 e producono più grandi depositi di minerali che non sono visibili ai raggi UV, ma sono simili a idrossiapatite (HA) in quanto hanno le sostituzioni più Ca e F.
I risultati ottenuti con queste tecniche ci permettono di concludere che il processo di mineralizzazione è diverso a seconda del tipo di cella. Proponiamo che, a livello cellulare, l’origine e la proprietà delle vescicole predeterminare il tipo di minerali.
Introduction
L’osso è un tipo di tessuto connettivo composto da due parti: organici (cellule e fibre collagene) e minerali (composti di calcio e fosfato). I componenti principali di minerali nelle ossa sono apatiti1. Diversi tipi di cellule competenti di mineralizzazione in osso (osteoblasti), nei denti (odontoblasti) e nella cartilagine (condrociti) regolano i passi iniziali di mineralizzazione di produrre proteine della matrice extracellulare (ECM) e rilasciare la matrice vescicole (MVs) (Figura 1). MVs sono 100-300 nm diametro vescicole che si accumulano di calcio e fosfato facilitando la nucleazione apatite e successivamente associare al collagene2,3. Quindi, MVs disintegrarsi per rilasciare apatiti al medium extracellulare. Le apatiti continuano a crescere a contatto con le fibre di collagene e formano la matrice dell’osso. La mineralizzazione è sostenuta dal costante rifornimento di Pio e Ca2 + nel mezzo extracellulare. Alcuni dati recentemente pubblicati supportano il nostro modello4,5. Tessuti molli non mineralizzare in condizioni fisiologiche. Tuttavia, la calcificazione ectopica può verificarsi in condizioni patologiche come calcificazione vascolare3. Le cellule vascolari che acquisiscono il fenotipo degli osteoblasti in grado di produrre MVs che inducono la nucleazione di apatiti e avviare mineralizzazione negli strati della parete mediale e intimale dei vasi sanguigni. Dal calcificazione ectopica assomigliano endochondral normale mineralizzazione3, comprendere i meccanismi molecolari della mineralizzazione delle cellule ossee e condrociti dovrebbero fornire alcuni indizi sulla calcificazione ectopica dei tessuti molli che sono formato.
Lo sviluppo di tessuti scheletrici è regolato da vari enzimi, fattori di crescita e promotori o inibitori della mineralizzazione. L’azione antagonistica di tessuto-non specifico fosfatasi alcalina (TNAP) (Figura 1) ed ectonucleotide pirofosfatasi/fosfodiesterasi ho (NPP1), insieme a ankyrin (ANK), controlla concentrazione pirofosfato inorganico (PPho) 6. PPho, un potente inibitore della formazione HA, è idrolizzato di TNAP; NPP1 idrolizza i trifosfati del nucleotide per formare PPho mentre ANK PPho Esporta dalla cella alla ECM. Il rapporto di Pi/PPi può disciplinare l’apatite formazione7,8 con possibili conseguenze patologiche9.
La membrana di MV è arricchita in proteine di trasporto dello ione che facilitano la precipitazione iniziale di calcio e fosfato all’interno la MVs durante il processo di nucleazione (Figura 1). Il trasportatore del fosfato 1 (PiT) consente di incorporare Pho generato nello spazio perivesicular nel MVs10,11. Annexins possono essere coinvolti nell’associazione e nel trasporto di Ca2 + e nel processo biofisico che avvia la mineralizzazione del MV lumen12,13. Favoriamo l’ipotesi, suggerito in precedenza, per mineralizzazione all’interno di vescicole intracitoplasmatiche di nucleazione interno di apatite dentro la MV prima della sua propagazione nell’ECM14,15. Modellazione in vitro hanno confermato l’induzione di Ca2 +/ pho complessi formazione nei proteoliposomi effettuata in PS e AnxA516. Ciò potrebbe indicare che accumulo di Ca2 +, Pho, complessi AnxA5 e PS in “lipid rafts” di membranesrepresent i microvilli-come il nucleo di nucleazione (NC) di apatite all’interno Mvs Annexins e TNAP possiedono anche collagene-associazione capacità che possono essere utili nel mettere MVs lungo le fibre di collagene e, nello stimolare la propagazione di mineralizzazione in ECM. Fetuina A e osteopontina (OPN)17, sono noti come inibitori della formazione di apatite che possono rallentare la propagazione della mineralizzazione sul patibolo collageno. Nucleazione e propagazione sono eventi distinti, il primo precede quest’ultimo, ed entrambi possono essere rilevanti per il processo di mineralizzazione patologico.
Per scoprire come la chimica dei complessi di fosfato di calcio può cambiare fisiologico mineralizzazione e calcificazione ectopica, è necessario identificare i minerali prodotti dalle cellule. Apatiti sono un gruppo di calcio e fosfato contenente minerali con cristallo generale unità cella formula Ca10(PO4) di6X2, dove X = Cl, F, OH. Essi sono classificati come segue18: fluorapatite (FA) Ca10(PO4)6F2, chlorapatite (CA) Ca10(PO4)6Cl2 e idrossiapatite (HA) Ca10(PO4 )6(OH)2.
La scelta di linee cellulari di osteoblasti per indurre la formazione di minerali è fondamentale, poiché ogni linea cellulare esibisce un profilo distinto di mineralizzazione. In questo rapporto, abbiamo confrontato la nucleazione dei minerali da due modelli di cella selezionata umana di mineralizzazione: cellule osteoblastic hFOB 1.19 e cellule di osteosarcoma Saos-2. Cellule derivate da osteosarcoma sono comunemente usate come modelli osteoblastiche e cellule Saos-2 hanno conservato il carattere osteoblastic più maturo19 mentre le cellule indifferenziate hFOB fetale umano sono ampiamente usate come un modello per il normale osteoblastic differenziazione20. I profili di mineralizzazione sono stati analizzati con metodi diversi: Alizarin Red-S (AR-S) colorazione, ultravioletta visualizzazione luce (UV), formazione immagine di microscopia elettronica (TEM) di trasmissione, quantificazione di energia dispersiva x-ray microanalisi (EDX) e dello ione mappatura. Il vantaggio di TEM-EDX su tecniche alternative utilizzate negli studi precedenti è che dà risultati quantitativi e qualitativi della sostituzione dello ione in cristalli di apatite4,5,21. L’obiettivo generale dell’utilizzo di TEM-EDX era di trovare un metodo semplice per l’imaging e quantificazione della distribuzione degli ioni Ca, F e Cl in vari minerali da diversi tipi di cellule durante fasi distinte del processo di mineralizzazione. Questo metodo è stato utilizzato con successo, ad esempio, per monitorare l’interazione delle nanoparticelle di zinco con i prodotti chimici coesistenti e loro effetti combinati su organismi acquatici22. In un altro studio, un photocatalyst rame su materiali di titanio in soluzione acquosa è stato ampiamente caratterizzato mediante spettrometria ad emissione ottica al plasma accoppiato induttivamente (ICP-OES), N2 physisorption (BET), XRD, DRS UV-vis, FT-IR, Raman spettroscopia, TEM-EDX e photoelectrochemical misure23. Il nostro obiettivo era di confrontare l’origine e la proprietà di vescicole e minerali in due linee cellulari per comprendere il meccanismo che controlla la mineralizzazione durante la differenziazione ossea.
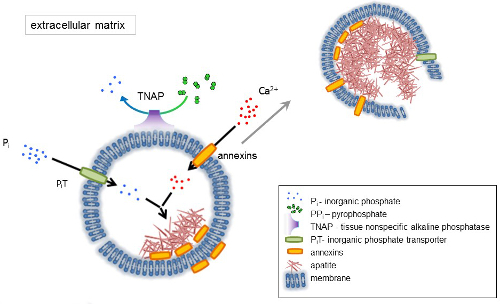
Figura 1 . Schema delle fasi iniziali di mineralizzazione in cellule ossee che coinvolge la sintesi di proteine della matrice extracellulare (ECM) ed il rilascio delle vescicole della matrice (MVs) dalla membrana. MVs accumulare calcio attraverso l’azione di proteine leganti il calcio, annexins e fosfato, attraverso l’azione di un trasportatore di fosfato inorganico (PiT) seguita dall’attività del tessuto non specifico della fosfatasi alcalina (TNAP), che defosforila PPio Pho, quindi facilitante la nucleazione apatite. Quindi, MVs si disintegrano e rilasciare apatiti al medium extracellulare. La mineralizzazione è sostenuta dal costante rifornimento di Pio e Ca2 + in extracellulare media4,5. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Nella carta attuale, abbiamo descritto i protocolli per la macchiatura, identificazione di luce UV di fluoroapatite AR-S e TEM-EDX in vitro la formazione immagine di MVs rilasciato da mineralizzante di cellule e di minerali prodotto da MVs. È possibile indirizzare tutti i metodi sopra indicati di seguito alcuni passaggi di risoluzione dei problemi comuni. Per ottenere risultati ottimali, diversi passaggi critici devono essere eseguite con attenzione. In primo luogo, è meglio aggiungere AA (che è acid…
Divulgations
The authors have nothing to disclose.
Acknowledgements
MK e ASK eseguite operazioni manuali e LB preparato disegni e ha realizzato il film. ASK ha scritto il manoscritto, LB ha scritto la sceneggiatura e MK preparato il tavolo. SM, RB e SP leggere criticamente la tabella, la sceneggiatura e il manoscritto. Gli autori vorrei ringraziare Hanna Chomontowska per la sua eccellente assistenza con ultramicrotomia nonché Szymon Suski e Henryk Bilski per la loro eccellente assistenza con analisi TEM-EDX. Gli autori vorrei ringraziare dr Patrick Boschetti per correzione di lingua inglese professionale e Barbara Sobiak per le istruzioni di registrazione.
Questo lavoro è stato supportato da grant N N401 140639 del ministero polacco della scienza e dell’istruzione superiore per ASK, da sovvenzioni dal National Science Centre, Polonia 2016/23/N/NZ4/03313 LB e 2016/23/N/NZ1/02449 MK, EU FP7 progetto BIOIMAGINE : BIO-IMAGing in ricerca innovazione e formazione, GA n. 264173 e dai fondi statutari dell’Istituto Nencki di biologia sperimentale, Accademia polacca delle scienze.
Materials
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D |
for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
References
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -. L., Chien, C. -. C., Chiu, I. -. M., Huang, H. -. I., Chen, Y. -. C., Hu, H. -. I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O’Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O’Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).

