Изображение руководствуясь резекции глиобластома и внутричерепных имплантации терапевтического стволовых клеток посеян подмостей
Summary
Как для лечения глиобластома инвазивных обещают опухоли ищу терапевтических мезенхимальных стволовых клеток (Майкрософт) (MSCs). Оптимальное трансплантации включает поставку MSCs в полость резекции опухоли на леса. Здесь, доклинических методы для изучения MSC лечения глиобластома предоставляются включая: резекции опухоли изображение гидом; Имплантация MSC-посеян лесов; и послеоперационной терапии отслеживания.
Abstract
Глиобластома (GBM), наиболее распространенных и агрессивной первичного мозга рак, носит продолжительность жизни составляет 12-15 месяцев. Короткой продолжительности жизни отчасти объясняется неспособностью текущего лечения, состоящий из хирургической резекции после лучевой и химиотерапии, для ликвидации очагов инвазивные опухоли. Лечение этих очагов может быть улучшена с tumoricidal человека мезенхимальных стволовых клеток (МСК). MSCs экспонат мощным опухоли тропизма и может быть сконструированы так, чтобы выразить терапевтических белков, которые убивают опухолевых клеток. Достижений в доклинических моделях показывают, что хирургическая резекция индуцирует преждевременной потери MSC и уменьшает терапевтической эффективности. Эффективность лечения MSC может быть улучшено путем посева MSCs на леске биологически poly(lactic acid) (НОАК). MSC доставки в полость хирургической резекции на леске PLA восстанавливает клетки удержания, настойчивость и опухоли убийства. Изучить последствия имплантации MSC-посеян PLA на GBM, необходима точная модель доклинических. Здесь мы предоставляем доклинических хирургический протокол для изображений руководствуясь опухоли резекция GBM иммунный дефицит мышей, следуют MSC-посеян эшафот имплантации. MSCs спроектированы с лентивирусные конструкции конститутивно выразить и выделяют терапевтических TNFα-связанных индуцировать апоптоз лиганда (TRAIL), а также Зеленый флуоресцентный белок (ГПУП) чтобы разрешить Флуоресцентные отслеживание. Аналогичным образом опухолевые клетки U87 разработаны для Экспресс mCherry и Светлячок Люцифераза, обеспечивая двойной флуоресцентный/светящиеся отслеживания. Хотя в настоящее время используется для исследования стволовых клеток при посредничестве доставки терапевтических средств, этот протокол может быть изменен исследовать влияние хирургической резекции на других GBM вмешательств.
Introduction
Глиобластома (GBM) является наиболее распространенной формой рака первичного мозга у взрослых, с мрачной медиана выживаемости всего 12-15 месяцев1,2,3,4,5. Выживание существенно не улучшилась после 2005 года, когда текущие клинические стандарт максимальной хирургической резекции, следуют излучения и сопутствующих и адъювантной химиотерапии Темозоламид был принят6,7. Хотя эта процедура обеспечивает пациентов с временное облегчение симптомов, стандарт уход неизменно приводит к повторения инвазивного рака очагов уклониться от резекции и защищены от системной терапии гематоэнцефалический барьер (ГЭБ). Стратегии в интересах инвазивные опухоли очагов в обход BBB срочно необходимы для получения тяги против этой агрессивной и изнурительной болезни.
Средства доставки GBM вследствие их родной опухоли тропизм8,9как препарат обещают человека мезенхимальных стволовых клеток (МСК). MSCs обладают рецепторов для и мигрировать растворимых факторов, которые выделяют опухоли, включая стромальных клеток, полученных фактор 1α (SDF-1α), матрицы металлопротеиназы-1 (MMP-1) и Моноцит хемотаксического белка-1 (МКП-1) среди прочих10, 11 , 12 , 13. инженерные MSCs выразить и выделяют цитотоксические препараты позволяет им быть использованы в качестве средств доставки наркотиков опухоли самонаведения. Инженерии MSCs двигаться к инвазивной опухоли очагов и доставить терапевтических белков. Этот подход продемонстрировал осуществимость в различных доклинических GBM модели9,14. Однако подавляющее большинство из этих моделей не включают хирургическая резекция несмотря на клиническое значение этого компонента. Новые исследования с использованием новых моделей резекции показали, что опухоли хирургическое удаление уменьшает сохранение стволовых клеток, которые вводят непосредственно в хирургической полости15. Утрата жизнеспособности привело к сокращению эффективности, вероятно из-за снижением дозы и длительности наркотиков доставлены инвазивных опухолевых очагов.
Чтобы повысить жизнеспособность стволовых клеток и доставки лекарств, MSCs может быть заполнена на леса до имплантации. В этом протоколе, биосовместимых и рассасывания electrospun nanofibrous poly(lactic acid) (НОАК) используется как леса для НОАК MSCs. шнуры и соответствует форме резекции полости после имплантации, которая максимизирует терапевтического охвата и минимизирует Расстояние MSCs должна путешествие достичь опухолевых клеток. MSCs остаются на эшафот во время имплантации и затем мигрируют от леса к опухолевых клеток после имплантации16,17. MSCs и цитостатических препаратов, которую они несут затем накапливаются в опухолевых очагов. Доставка цитотоксических препарата к опухоли требует MSC жизнеспособность и упорство, оба из которых являются способствует имплантации на леса.
В этой процедуре, лентивирусные векторы используются для стимулирования стабильных выражение флуоресцентные (в пробирке отслеживания) и биолюминесцентных (в естественных условиях отслеживания) маркеры рака и стволовых клеток линии. Линии человека GBM U87 заражен с mCherry и firefly Люцифераза (U87 mCh-Fl) и нетерапевтических MSCs с GFP и renilla Люцифераза (MSC GFP-Rluc). Терапевтические вариант MSCs Экспресс TNFα-связанные апоптоза, вызывая лиганда (MSC-TRAIL). ТРОПА, конститутивно выделяется белка, связывается с рядом смерти рецепторов на рак клеток и инициирует caspase опосредованной апоптоз18.
Здесь мы предоставляем протокол для доклинических изображения руководствуясь GBM хирургической резекции и имплантации MSC-посеян подмостей. В краткой Обнаженная мышей даны краниотомии позже следуют три дня Стереотаксическая ортотопическая инъекции U87 mCh-FL учредить первичной опухоли. Прижившимися опухоль растет в течение примерно одной недели. PLA подмостей являются семенами с MSCs 48 ч до операции резекции. Опухоль затем резецируется под руководством флуоресцентные, и леска загружается MSC имплантируется в полость резекции. Бремя и мыши выживания опухоли, затем постоперационно отслеживаются с биолюминесценции изображений (BLI). Хронология этих процедур приводится ниже (рис. 1).
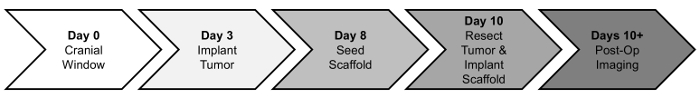
Рисунок 1: временная шкала процедур. Мышей первоначально получают черепной окна (день 0). После трех дней периода восстановления, являются опухоли имплантируются (день 3) и расти в течение примерно одной недели. Леса являются семенами с MSCs (8 день) два дня до начала процедуры резекции и имплантации опухоли (10 дней). Прогрессии опухоли и терапевтической эффективности оцениваются через изображений затем послеоперационный (день 10 +). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
Операция обычно может быть завершена в течение 30 мин на мышь, учитывая, что максимально повысить точность и избежать ловушки времени учитываются следующие моменты. Во-первых убедитесь, что мышь правильно позиционируется в стереотаксического инструмента до начала процедуры. Нежелател?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы признают редакционный вклад от д-р Кэтрин Pietrosimone. Подмости PLA были изготовлены д-р Элизабет Loboa лаборатории в университете штата Северная Каролина. Эта работа была поддержана Lineberger КООН всеобъемлющем онкологический центр университета онкологический научный фонд и поступательные КООН и клинических наук Институт (KL2TR001109, UL1TR001111).
Materials
| Just for mouse stereotaxic instrument | Stoelting | 51730 | Maintains steady head positioning during surgery |
| Fluorescence dissecting stereomicroscope | Leica | M165 FC | Allows real-time imaging of tumor during resection |
| Motorized integrated stereotaxic injector (ISI) system | Stoelting | 53315 | Allows precise tumor cell injection volume and rate |
| Vetbond tissue adhesive | 3M | 1469 | Sugical glue to close skin wound |
| Artificial tears | Akorn | 664268 | Prevents eyes from drying during surgery |
| Webcol alcohol preps | Covidien | 6818 | Sterilize incision site |
| Betadine surgical scrub | Purdue Fredick Company | 6761815117 | Sterilize incision site |
| Cotton-tipped applicators | Fisherbrand | 23-400-115 | Surgery tool |
| E-vac aspirating system | Argos | EV310 | Vacuum pump used to resect tumor |
| Fibrinogen and thrombin extracted from as-received TISSEEL | Baxter | To temporarily secure the scaffold in the resection cavity | |
| IVIS Kinetic in vivo optical imaging system | Caliper Life Science | Bioluminescent Imager | |
| D-Luciferin potassium salt | PerkinElmer | 122799 | In vivo imaging agent |
References
- Adamson, C., et al. Glioblastoma multiforme: a review of where we have been and where we are going. Expert opinion on investigational drugs. 18 (8), 1061-1083 (2009).
- Asthagiri, A. R., Pouratian, N., Sherman, J., Ahmed, G., Shaffrey, M. E. Advances in Brain Tumor Surgery. Neurologic Clinics. 25 (4), 975-1003 (2007).
- Affronti, M., et al. Overall survival of newly diagnosed glioblastoma patients receiving carmustine wafers followed by radiation and concurrent temozolomide plus rotational multiagent chemotherapy. Cancer. 115 (15), 3501-3511 (2009).
- Erpolat, O., Akmansu, M., Goksel, F., Bora, H., Yaman, E., Büyükberber, S. Outcome of newly diagnosed glioblastoma patients treated by radiotherapy plus concomitant and adjuvant temozolomide: a long-term analysis. Tumori. 95 (2), 191-197 (2009).
- Minniti, G., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma in elderly patients. Journal of Neuro-Oncology. 88 (1), 97-103 (2008).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Delgado-López, P., Corrales-García, E. Survival in glioblastoma: a review on the impact of treatment modalities. Clinical and Translational Oncology. 18 (11), 1062-1071 (2016).
- Wu, X., et al. In vivo tracking of superparamagnetic iron oxide nanoparticle-labeled mesenchymal stem cell tropism to malignant gliomas using magnetic resonance imaging. Laboratory investigation. Journal of Neurosurgery. 108 (2), 320-329 (2008).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Research. 65 (8), 3307-3318 (2005).
- Xu, F., Shi, J., Yu, B., Ni, W., Wu, X., Gu, Z. Chemokines mediate mesenchymal stem cell migration toward gliomas in vitro. Oncology Reports. 23 (6), 1561-1567 (2010).
- Park, S., et al. CXCR4-transfected human umbilical cord blood-derived mesenchymal stem cells exhibit enhanced migratory capacity toward gliomas. International Journal of Oncology. 38 (1), 97-103 (2011).
- Ho, I., et al. Matrix Metalloproteinase 1 Is Necessary for the Migration of Human Bone Marrow-Derived Mesenchymal Stem Cells Toward Human Glioma. STEM CELLS. 27 (6), 1366-1375 (2009).
- Bexell, D., Svensson, A., Bengzon, J. Stem cell-based therapy for malignant glioma. Cancer Treatment Reviews. 39 (4), (2012).
- Nouri, F., Wang, X., Hatefi, A. Genetically engineered theranostic mesenchymal stem cells for the evaluation of the anticancer efficacy of enzyme/prodrug systems. Journal of Controlled Release. 200, 179-187 (2015).
- Kauer, T., Figueiredo, J. -. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Bagó, J., Pegna, G., Okolie, O., Hingtgen, S. Fibrin matrices enhance the transplant and efficacy of cytotoxic stem cell therapy for post-surgical cancer. Biomaterials. 84, 42-53 (2016).
- Bagó, J., Pegna, G., Okolie, O., Mohiti-Asli, M., Loboa, E., Hingtgen, S. Electrospun nanofibrous scaffolds increase the efficacy of stem cell-mediated therapy of surgically resected glioblastoma. Biomaterials. 90, 116-125 (2016).
- Loebinger, M., Eddaoudi, A., Davies, D., Janes, S. Mesenchymal Stem Cell Delivery of TRAIL Can Eliminate Metastatic Cancer. Cancer Research. 69 (10), 4134-4142 (2009).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. J. Vis. Exp. (12), e680 (2008).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), e1986 (2010).

