Registrazioni di potenziale di azione ottica sottotipo-specifici in essere umano indotto Cardiomyocytes ventricolari derivati da cellule staminali di Pluripotent
Summary
Qui presentiamo un metodo per immagine otticamente i potenziali di azione, in particolare in cardiomiociti derivati da cellule staminali pluripotenti indotte ventricolare-come. Il metodo si basa sull’espressione di una proteina fluorescente tensione sensibile promotore-driven.
Abstract
Cardiomiociti generati dalle cellule staminali umane pluripotenti indotte (iPSC-CMs) sono uno strumento emergente nella ricerca cardiovascolare. Piuttosto che essere una popolazione omogenea delle cellule, l’iPSC-CMs generati da protocolli correnti di differenziazione rappresentano una miscela delle cellule con ventricolare-, atriale-e fenotipi nodale-like, che complica l’analisi fenotipiche. Qui, un metodo per registrare otticamente i potenziali di azione in particolare da ventricolare-come iPSC-CMs è presentato. Questo si ottiene attraverso la trasduzione lentivirale con un costrutto in cui un indicatore di tensione geneticamente codificato è sotto il controllo di un elemento promotore ventricolare-specifico. Quando iPSC-CMs vengono trasdotti con questo costrutto, il sensore di tensione è espresso esclusivamente in ventricolare-come le cellule, che permette registrazioni potenziali di membrana ottico sottotipo-specifici utilizzando la microscopia a fluorescenza time-lapse.
Introduction
Cardiomiociti (CMs) derivati da cellule staminali pluripotenti indotte (iPSCs) sono uno strumento emergente di sezionare i meccanismi molecolari di malattia cardiaca, per studiare nuove terapie e allo schermo per avverse cardiache effetti1,2 ,3. Fin dall’inizio, malattie aritmogene quali canalopatie sono stati un fuoco importante di questa ricerca zona4. Di conseguenza, metodi per studiare elettrici fenotipi di CMs, quali aritmie o cambiamenti di morfologie di potenziale di azione (AP), sono il cuore di questa tecnologia.
Una considerazione importante nell’applicazione della iPSC-CMs è che non provochino l’attuale protocolli di differenziamento cardiaco in una popolazione omogenea delle cellule. Invece, sono piuttosto una miscela di cellule che assomigliano al nodo seno atriale e ventricolare CMs a diversi livelli di maturazione5,6,7,8. Questa eterogeneità può essere un’importante fonte di variabilità sperimentale, soprattutto se i parametri come la durata di AP (APD) sono studiati, che intrinsecamente differiscono tra sottotipi di CM (ad es., l’APD è più breve in atriale rispetto a CMs ventricolare). L’approccio convenzionale per affrontare questo problema è indagare singolo iPSC-CMs utilizzando il metodo di patch clamp e classificare ogni cella come nodale-, atriale-, o ventricolare-come, in base alle sue AP morfologia9. Qualsiasi analisi successiva possono essere quindi limitato alle cellule che rappresenta il sottotipo di CM di interesse. Il principale svantaggio di questa strategia è la limitata velocità effettiva e la mancanza di scalabilità. Inoltre, la natura invasiva della patch ed elettrofisiologia morsetto non consente l’imaging delle stesse cellule in sequenza a periodi di tempo estesi.
Qui, forniamo dettagli sperimentali su un metodo10 sviluppato per otticamente immagine APs in sottotipi specifici di iPSC-CMs. Questo supera il problema dell’eterogeneità di sottotipo e aumenta notevolmente la velocità di trasmissione rispetto ai metodi convenzionali, permettendo la rapida fenotipizzazione di iPSC-CMs che trasportano varianti genetiche o essere esposti a farmacologico agenti.
Panoramica dell’approccio imaging ottico sottotipo-specifici
Un indicatore di tensione geneticamente codificato (GEVI), cui proprietà di fluorescenza cambi su depolarizzazione e ripolarizzazione della membrana cellulare, viene utilizzato per immagine otticamente cambiamenti del potenziale di membrana di CMs. La GEVI applicato qui è la proteina fluorescente-rilevamento della tensione VSFP-CR11, che consiste di un dominio transmembrana di rilevamento tensione fuso ad un paio di un verde (trifoglio) e una proteina fluorescente rosso (mRuby2) (Figura 1A). A causa della vicinanza di due fluorophores, l’eccitazione della proteina fluorescente verde risultati in una frazione dell’energia di eccitazione viene trasferito alla proteina fluorescente rossa tramite trasferimento di energia per risonanza (FRET). Di conseguenza, l’eccitazione della proteina fluorescente verde si traduce in un’emissione da sia il verde e il rosse proteine fluorescenti (Figura 1A, pannello superiore). Quando la cella depolarizza, si verifica una riorganizzazione strutturale nel sensore di tensione che si traduce in un riorientamento delle due proteine fluorescenti, aumentando l’efficienza FRET. Così, ancora di più l’energia di eccitazione viene trasferito dal verde alla proteina fluorescente rossa (Figura 1A, pannello inferiore). Di conseguenza, in una cella depolarizzata, l’emissione di fluorescenza verde è dimmer, e l’emissione di fluorescenza rossa è più luminoso in una cella a riposo il potenziale di membrana (Figura 1B).
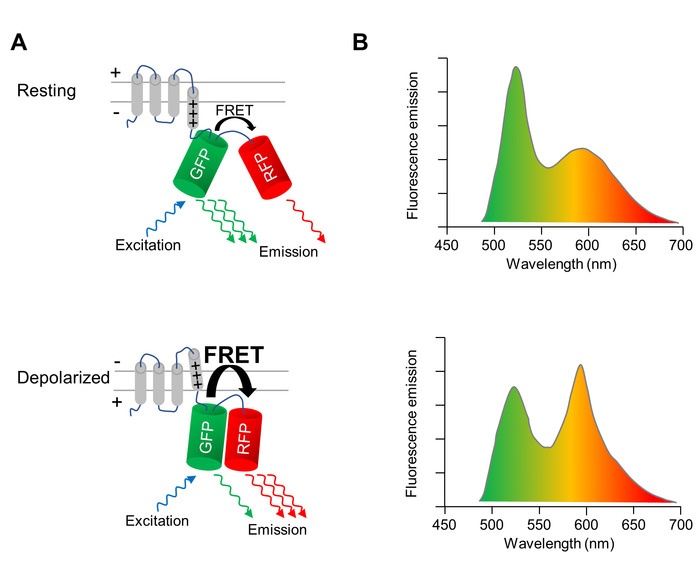
Figura 1: imaging ottico della membrana potenziale con VSFP-CR. (A), A schema raffigurante l’azione della proteina fluorescente tensione sensibile CHE VSFP-CR è indicato. Al momento la depolarizzazione della membrana cellulare, una riorganizzazione strutturale nel dominio del transmembrane-rilevamento della tensione si traduce in un riorientamento del verde (GFP) e rossa proteina fluorescente (RFP), aumentando l’efficienza del Förster intramolecolare trasferimento di energia per risonanza (FRET). Sono raffigurati gli spettri (B) l’emissione di un VSFP all’eccitazione della GFP in cellule presso il potenziale di membrana di riposo (pannello superiore) e in cellule depolarizzate (pannello inferiore). Il cambiamento spettrale su depolarizzazione è esagerato per chiarezza. Clicca qui per visualizzare una versione più grande di questa figura.
Le modifiche dell’efficienza della FRET mirroring le fluttuazioni del potenziale di membrana sono Imaging utilizzando un microscopio a fluorescenza equipaggiato con un’immagine splitter, che separa le emissioni di fluorescenza rossa e verde e li proietta su due zone adiacenti di il chip di una fotocamera sCMOS (Figura 2). Con questo set-up, l’emissione di fluorescenza a due bande di lunghezza d’onda differente possa essere registrato simultaneamente, che permette il calcolo di un rapporto di fluorescenza rosso-verde in modo da riflettere il potenziale in ogni immagine di una serie di time-lapse di membrana.
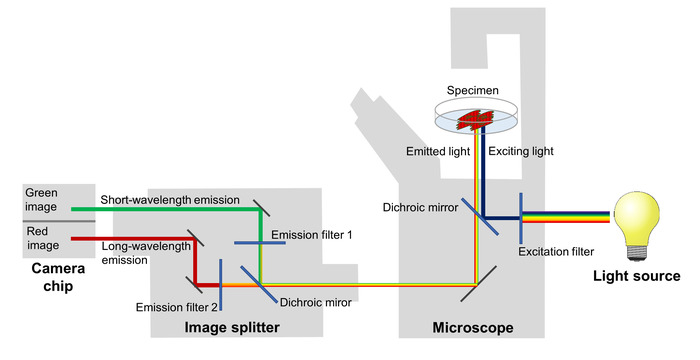
Figura 2: configurazione del sistema di imaging. I componenti principali del sistema di imaging utilizzata per immagine sono raffigurati i cambiamenti spettrali della proteina fluorescente tensione-sensibili del mirroring i cambiamenti di potenziale di membrana ad alta risoluzione temporale. Clicca qui per visualizzare una versione più grande di questa figura.
L’espressione di VSFP-CR in CMs è raggiunto attraverso la trasduzione lentivirale. Per indirizzare l’espressione per il sottotipo di CM di interesse, il lentivirus contiene un elemento di promotore (il rinforzatore di MLC2v ) che spinge in particolare trascrizione in ventricolare-come iPSC-CMs10. Quando l’iPSC-CMs che rappresentano una miscela di cellule simil-atriale, nodale-come e ventricolare-come vengono trasdotti con questo lentivirus, VSFP-CR è espressa solo nelle cellule simil-ventricolare. Poiché l’imaging ottico potenziale d’azione dipende da questo sensore fluorescente, i potenziali di azione registrati rappresentano esclusivamente il sottotipo di CM di interesse (Figura 3).
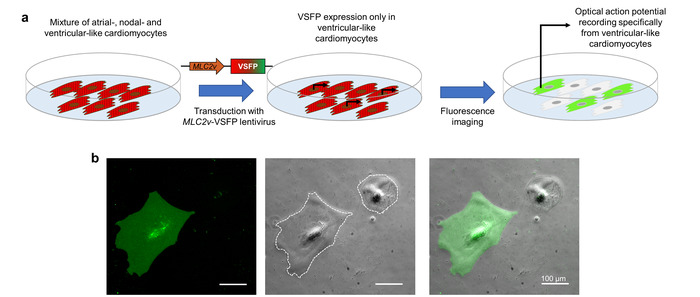
Figura 3: espressione del promotore-driven VSFP per l’imaging di potenziali di membrana sottotipo-specifici. (un) questo schema Mostra come sono realizzate le registrazioni di potenziale di azione ottica sottotipo-specifici del cardiomyocyte. (b) iPSC-CMs infettato da un VSFP sotto il controllo della ventricolare specifiche MLC2v-enhancer sono mostrati. L’espressione nel sensore di tensione è osservata solo in ventricolare-come CMs nel canale GFP (pannello di sinistra). A vostra disposizione anche il contrasto di fase (pannello centrale) e l’immagine di sovrapposizione (pannello di destra). Le linee bianche tratteggiate segnano confini delle cellule. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il metodo qui descritto consente una registrazione ottica di APs da un sottotipo specifico (cioè, ventricolare-come le cellule) di CMs generato da iPSCs umane. Umano iPSC-CMs sono uno strumento emergente per affrontare una grande varietà di problemi biologici e medici, e la differenziazione di diversi sottotipi di CM è un’importante fonte di variabilità sperimentale. Utilizzando elementi specifici promotore, l’espressione di un GEVI è specificamente realizzato in CMs che rappresenta il sottotipo di interess…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto da sovvenzioni da German Research Foundation (Si 1747/1-1), l’altro Kröner-Fresenius-Stiftung e la Deutsche Stiftung für Herzforschung.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
References
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

