Inducción y caracterización de la hipertensión pulmonar en ratones utilizando el modelo Hypoxia/SU5416
Summary
Este protocolo describe la inducción de hipertensión pulmonar (PH) en ratones en función de la exposición a la hipoxia y la inyección de un antagonista del receptor VEGF. Los animales desarrollan PH e hipertrofia ventricular derecha (RV) 3 semanas después del inicio del protocolo. También se presenta la caracterización funcional y morfométrica del modelo.
Abstract
La hipertensión pulmonar (PH) es una afección fisiopatológica, definida por una presión arterial pulmonar media superior a 25 mm Hg en reposo, según lo evaluado por el cateterismo cardíaco derecho. Un amplio espectro de enfermedades puede conducir a PH, diferenciándose en su etiología, histopatología, presentación clínica, pronóstico y respuesta al tratamiento. A pesar de los avances significativos en los últimos años, la PH sigue siendo una enfermedad no curada. Comprender los mecanismos subyacentes puede allanar el camino para el desarrollo de nuevas terapias. Los modelos animales son importantes herramientas de investigación para lograr este objetivo. Actualmente, hay varios modelos disponibles para recapitular PH. Este protocolo describe un modelo PH de ratón de dos golpes. Los estímulos para el desarrollo de PH son la hipoxia y la inyección de SU5416, un antagonista del receptor del factor de crecimiento endotelial vascular (VEGF). Tres semanas después del inicio de la hipoxia/SU5416, los animales desarrollan remodelación vascular pulmonar imitando los cambios histopatológicos observados en el PH humano (predominantemente el Grupo 1). La remodelación vascular en la circulación pulmonar da como resultado la remodelación del ventrículo derecho (RV). Se describen en detalle los procedimientos para medir las presiones RV (utilizando el método torácico abierto), los análisis morfométricos de la RV (mediante la disección y el pesaje de ambos ventrículos cardíacos) y las evaluaciones histológicas de la remodelación (tanto pulmonar mediante la evaluación de la remodelación vascular como el cardíaco mediante la evaluación de la hipertrofia y la fibrosis de cardiomiocito RV). Las ventajas de este protocolo son la posibilidad de la aplicación tanto en ratones de tipo salvaje como en ratones genéticamente modificados, la implementación relativamente fácil y de bajo costo, y el rápido desarrollo de la enfermedad de interés (3 semanas). Las limitaciones de este método son que los ratones no desarrollan un fenotipo grave y el PH es reversible al regresar a la normoxia. La prevención, así como los estudios de terapia, se pueden implementar fácilmente en este modelo, sin la necesidad de habilidades avanzadas (a diferencia de los modelos de roedores quirúrgicos).
Introduction
La hipertensión pulmonar (PH) es una afección fisiopatológica, definida por una presión arterial pulmonar media (PA) superior a 25 mm Hg en reposo, según lo evaluado por el cateterismo cardíaco derecho1,2. Hay una variedad de enfermedades que pueden conducir a PH. En un intento de organizar las condiciones asociadas al PH, se han desarrollado varios sistemas de clasificación. La clasificación clínica actual clasifica las múltiples enfermedades asociadas al PH en 5 grupos diferentes1. Esta distinción es de importancia ya que varios grupos de pacientes tienen enfermedades que difieren en su presentación clínica, patología, pronóstico y respuesta al tratamiento2. La Tabla 1 resume la clasificación actual, complementada con las características histopatológicas básicas de cada enfermedad.
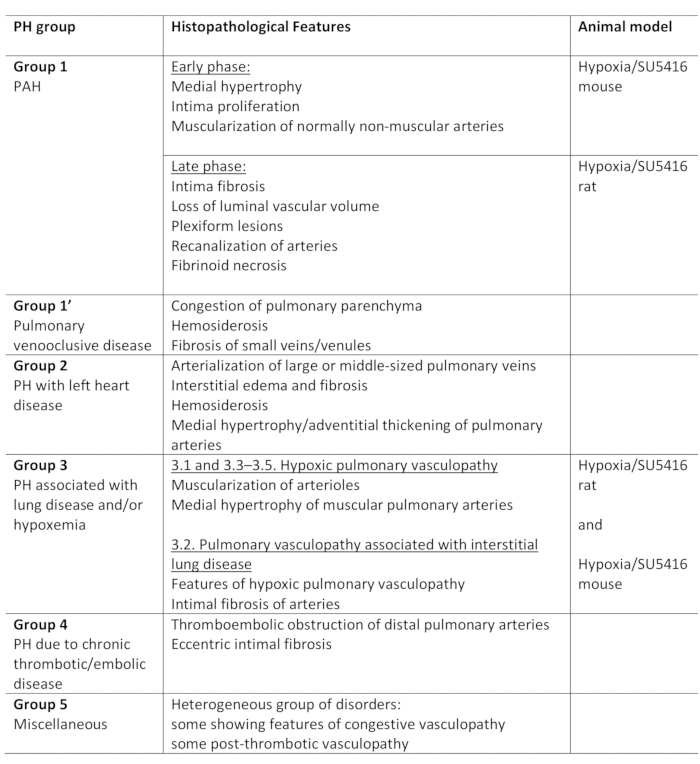
Tabla 1: Resumen de la clasificación clínica de PH, junto con las principales características histopatológicas dentro de los grupos. Adecuación del protocolo Hypoxia/SU5416 para el modelado PH. Esta tabla se ha modificado a partir de19. PH: Hipertensión pulmonar, HAP: Hipertensión arterial pulmonar
A pesar de los avances significativos en el tratamiento de las enfermedades asociadas al PH, el PH sigue sin cura, con una tasa de mortalidad de 3 años que oscila entre el 20% y el 80%3. Esto indica la necesidad imperiosa de comprender los mecanismos subyacentes de PH y, a partir de entonces, el desarrollo de nuevas terapias para prevenir, ralentizar la progresión y curar la enfermedad. Los modelos animales son de crucial importancia para este ámbito. Actualmente, existen varios modelos para estudiar PH. El lector interesado se refiere a las excelentes críticas sobre este tema2,3,4. Teniendo en cuenta la variedad de enfermedades que conducen a PH, es obvio que las diversas condiciones del PH humano no se pueden recapitular perfectamente en un modelo animal. Los modelos animales disponibles se pueden clasificar en i) single-hit, ii) two-hit, iii) knockout, y iv) overexpression modelos3. En los modelos de un solo golpe, ph es inducido por un solo estímulo patológico, mientras que los modelos de dos golpes combinan dos estímulos patológicos con el objetivo de inducir a PH más grave y por lo tanto imitar más estrechamente la compleja enfermedad humana. Además de las diferencias etiológicas, los diversos estímulos dan lugar a diferencias de modelado de PH que dependen también de la especie y el fondo genético de los animales4.
Uno de los modelos clásicos de roedores PH más utilizados es la hipoxia crónica modelo2. La hipoxia es conocida por inducir PH en humanos, así como en varias especies animales. La hipoxia tiene la ventaja de ser un estímulo fisiológico para PH (Tabla 1). Sin embargo, mientras que el grado de hipoxia utilizado para inducir PH en roedores es mucho más grave que en los seres humanos, el único insulto (hipoxia) conduce sólo a una forma leve de remodelación vascular. Esto no imita la gravedad de la enfermedad humana. La adición de un segundo golpe, un estímulo adicional para inducir PH, mostró resultados prometedores: la inyección del compuesto SU5416 a los roedores combinados con el estímulo hipoxico induce un fenotipo PH más grave2,5,6. SU5416 es un inhibidor del receptor-2 del factor de crecimiento endotelial vascular (VEGF). Bloquea los receptores VEGF y conduce a la apoptosis celular endotelial. En condiciones hipoxicas, esto estimula la proliferación de un subconjunto de células endoteliales resistentes a la apoptosis. Además, SU5416 conduce a la proliferación de células musculares lisas. La combinación de estos efectos da como resultado una remodelación vascular patológica de la circulación pulmonar y conduce a una presión patológica elevada y una remodelación ventricular derecha2,,5,,7. El modelo fue descrito por primera vez en ratas6 y más tarde aplicado a ratones4,,5,,7. El modelo de ratón presenta una remodelación vascular menos grave en comparación con las ratas. Además, cuando se vuelve a la normoxia, PH continúa progresando en ratas, mientras que en ratones es parcialmente reversible.
El protocolo siguiente describe todos los pasos para modelar PH en ratones mediante el método Hypoxia/SU5416 (planificación, cronología, ejecución). Además, la caracterización del modelo se describe en este protocolo: funcionalmente (midiendo invasivamente la presión ventricular derecha (RV) utilizando la técnica del pecho abierto), morfométricamente (diseccionando y pesando tanto los ventrículos derecho e izquierdo), como histológicamente (mediante la evaluación de la remodelación vascular pulmonar, la hipertrofia cardiomiomiocítica ventricular derecha y la fibrosis).
Todos los pasos y métodos descritos en este protocolo pueden ser fácilmente implementados por los investigadores en cualquier nivel de experiencia. Si bien las mediciones funcionales de la RV utilizando la técnica de pecho abierto (descrita aquí) no es el método estándar de oro en el campo, tiene la ventaja de que se puede aprender rápidamente y reproducir con precisión incluso por un experimentador menos experimentado.
Protocol
Representative Results
Discussion
Este protocolo describe cómo modelar PH en ratones combinando dos estímulos patológicos: hipoxia crónica e inyección SU5416 (Hypoxia/SU5416)18. En un intento de correlacionar este modelo de ratón con la condición PH humana, inevitablemente se debe mirar la clasificación PH actual, que se muestra en el Cuadro 1. PH en casi todas las formas se caracteriza por vasoconstricción pulmonar y proliferación aberrante de células musculares endoteliales y lisas. Esto conduce a una…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por subvenciones de la Asociación Americana del Corazón (AHA- 17SDG33370112 y 18IPA34170258) y de los Institutos Nacionales de Salud NIH K01 HL135474 a Y.S. O.B fue apoyado por la Deutsche Herzstiftung.
Materials
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
References
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).

