Gaschromatographie-Massenspektrometrie gepaart mit Totalverdampfung Festphasen-Mikroextraktion als forensisches Werkzeug
Summary
Total Vaporization Solid Phase Microextraction (TV-SPME) verdampft eine flüssige Probe vollständig, während Analyten an eine SPME-Faser sorbiert werden. Dies ermöglicht die Aufteilung des Analyten zwischen nur dem Lösungsmitteldampf und der SPME-Faserbeschichtung.
Abstract
Gaschromatographie – Massenspektrometrie (GC-MS) ist eine häufig verwendete Technik zur Analyse zahlreicher Analyten von forensischem Interesse, einschließlich kontrollierter Substanzen, entzündbarer Flüssigkeiten und Sprengstoffe. GC-MS kann mit der Festphasen-Mikroextraktion (SPME) gekoppelt werden, bei der eine Faser mit einer sorptiven Beschichtung in den Kopfraum über einer Probe gelegt oder in eine flüssige Probe eingetaucht wird. Analyten werden an die Faser sorbiert, die dann zur Desorption in den beheizten GC-Einlass gelegt wird. Total Vaporization Solid-Phase Microextraction (TV-SPME) verwendet die gleiche Technik wie Immersion SPME, taucht die Faser jedoch in einen vollständig verdampften Probenextrakt ein. Diese vollständige Verdampfung führt zu einer Trennung zwischen nur der Dampfphase und der SPME-Faser ohne Interferenz durch eine flüssige Phase oder unlösliche Materialien. Je nach Siedepunkt des verwendeten Lösungsmittels ermöglicht TV-SPME große Probenvolumina (z.B. bis zu Hunderte von Mikrolitern). Die On-Fiber-Derivatisierung kann auch mit TV-SPME durchgeführt werden. TV-SPME wurde verwendet, um Medikamente und ihre Metaboliten in Haaren, Urin und Speichel zu analysieren. Diese einfache Technik wurde auch auf Straßendrogen, Lipide, Kraftstoffproben, explosive Rückstände nach der Explosion und Schadstoffe im Wasser angewendet. Dieses Papier hebt die Verwendung von TV-SPME zur Identifizierung illegaler Verfälschungsmittel in sehr kleinen Proben (Mikrolitermengen) alkoholischer Getränke hervor. Sowohl Gamma-Hydroxybutyrat (GHB) als auch Gamma-Butyrolacton (GBL) wurden in Konzentrationen identifiziert, die in Spitzengetränken gefunden werden würden. Die Derivatisierung durch ein Trimethylsilylmittel ermöglichte die Umwandlung der wässrigen Matrix und GHB in ihre TMS-Derivate. Insgesamt ist TV-SPME schnell, einfach und erfordert keine Probenvorbereitung, abgesehen davon, dass die Probe in eine Headspace-Durchstechflasche gelegt wird.
Introduction
Festphasen-Mikroextraktion (SPME) ist eine Probenahmetechnik, bei der eine flüssige oder feste Probe in eine Headspace-Durchstechflasche gelegt wird und eine SPME-Faser, die mit einem polymeren Material beschichtet ist, dann in den Probenkopfraum eingeführt (oder in eine flüssige Probe eingetaucht) wird. Der Analyt wird an der Faser sorbiert und dann wird die Faser zur Desorption1,2in den GC-Einlass gelegt. Total Vaporization Solid-Phase Microextraction (TV-SPME) ist eine ähnliche Technik wie Immersion SPME, verdampft jedoch vollständig eine flüssige Probe, bevor Analyten an die Faser adsorbiert werden. Dies ermöglicht die Aufteilung des Analyten zwischen nur dem Lösungsmitteldampf und der Beschichtung der Faser, so dass mehr analyt an die Faser adsorbiert werden kann und eine guteEmpfindlichkeit entsteht 3. Es stehen verschiedene SPME-Fasern zur Verfügung und die Faser sollte basierend auf dem interessierenden Analyten, Lösungsmittel / Matrix und Derivatisierungsmittel ausgewählt werden. Siehe Tabelle 1 für etablierte TV-SPME-Analyten.
| Probe | Analyt(en) | Empfohlene SPME-Faser | Referenz(en) |
| Menschliches Haar | Nikotin, Cotinin | Polydimethylsiloxan/Divinylbenzol (PDMS/DVB), Polyacrylat (PA) | 3 |
| Rauchfreies Pulver | Nitroglycerin, Diphenylamin | Polydimethylsiloxan (PDMS), Polyethylenglykol (PEG) | 7, 8 |
| Rennkraftstoff | Methanol, Nitromethan | Pflock | 9 |
| Wasser | Polyzyklische aromatische Kohlenwasserstoffe | PDMS | 10 |
| Getränke | ɣ-Hydroxybuttersäure, ɣ-Butyrolacton | PDMS | Dieses Werk |
| Festes Pulver | Methamphetamin, Amphetamin | PDMS/DVB | unveröffentlicht |
Tabelle 1. Empfohlene SPME-Fasern mit etablierten TV-SPME-Analyten.
Um TV-SPME durchzuführen, werden Analyten in einem Lösungsmittel gelöst und ein Aliquot dieser Mischung in eine Kopfraumfläschchen gegeben. Proben müssen nicht gefiltert werden, da nur das Lösungsmittel und flüchtige Analyten verdampfen. Bestimmte Mengen flüssiger Proben müssen verwendet werden, um eine vollständige Verdampfung der Probe zu gewährleisten. Diese Volumina werden mit Dem Idealen Gasgesetz bestimmt, um die Anzahl der Mole eines Lösungsmittels multipliziert mit dem molaren Volumen der Flüssigkeit zu berechnen (Gleichung 1).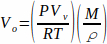 Gleichung 1
Gleichung 1
wobei Vo das Volumen der Probe (ml), P der Dampfdruck des Lösungsmittels (bar), Vv das Volumen der Durchstechflasche (L), R die ideale Gaskonstante (0,083145), 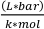 M die molare Masse des Lösungsmittels (g/mol), T die Temperatur (K) und die Dichte des
M die molare Masse des Lösungsmittels (g/mol), T die Temperatur (K) und die Dichte des 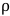 Lösungsmittels (g/ml) ist. 3
Lösungsmittels (g/ml) ist. 3
Um den richtigen Dampfdruck zu verwenden, wird die Antoine-Gleichung (Gleichung 2) verwendet, um den Einfluss der Temperatur zu berücksichtigen:4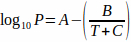 Gleichung 2
Gleichung 2
wobei T die Temperatur ist und A, B und C die Antoine-Konstanten für das Lösungsmittel sind. Gleichung 2 kann durch Gleichung 1 ersetzt werden, was ergibt: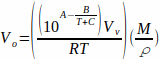 Gleichung 3
Gleichung 3
Gleichung 3 gibt das Volumen der Probe (Vo) an, das in Abhängigkeit von der Temperatur und dem verwendeten Lösungsmittel vollständig verdampft werden kann.
Um die Derivatisierung mit TV-SPME durchzuführen, wird die SPME-Faser zunächst einer Durchstechflasche ausgesetzt, die das Derivatisierungsmittel für eine bestimmte Zeit, abhängig vom Analyten, enthält. Die SPME-Faser wird dann einer neuen Durchstechflasche ausgesetzt, die den interessierenden Analyten enthält. Diese Durchstechflasche wird in einem beheizten Rührwerk erhitzt. Der Analyt wird dann mit dem Derivatisierungsmittel an die Faser adsorbiert. Die Derivatisierung des Analyten und/oder der Matrix erfolgt auf der Faser, bevor sie zur Desorption in den GC-Einlass eingeführt wird. Abbildung 1 zeigt eine Darstellung des TV-SPME-Prozesses mit Derivatisierung.
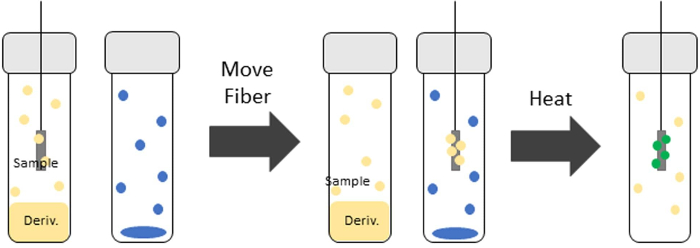
Abbildung 1: Darstellung des TV-SPME-Prozesses mit Derivatisierung. Die SPME-Faser gelangt zuerst in die Derivatisierungsfläschchen, wo das Derivatisierungsmittel (gelbe Kreise) an der Faser sorbiert. Die Faser wird dann in die Probe eingeführt (blaue Kreise) und erhitzt. Die Bildung des Derivats (grüne Kreise) findet während der Extraktionszeit auf der Faser statt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
TV-SPME ist vorteilhaft, da es ermöglicht, den Analyten während des Extraktionsprozesses zu derivatieren, was die Analysezeit verkürzt. Andere Methoden, wie die Flüssigkeitsinjektion, erfordern, dass der Analyt mit dem Derivatisierungsmittel in Lösung reagiert, bevor er in den GC injiziert wird. TV-SPME erfordert auch wenig bis gar keine Probenvorbereitung. Eine Matrix, die einen Analyten enthält, kann direkt in die Kopfraumfläschchen gelegt und analysiert werden. Viele interessante Compounds sind mit TV-SPME kompatibel. Verbindungen müssen in einem Lösungsmittel löslich und ausreichend flüchtig sein, um eine Verdampfung zu ermöglichen. Darüber hinaus müssen Verbindungen thermisch stabil sein, um mit GC-MS analysiert zu werden. TV-SPME wurde verwendet, um Drogen und Arzneimittelmetaboliten, Rennkraftstoffe, polyzyklische aromatische Kohlenwasserstoffe und explosive Materialien3,5,6, 7,8,9,10zu analysieren.
Protocol
Representative Results
Discussion
TV-SPME hat einige Vorteile gegenüber der Flüssigkeitsinjektion GC, da große Probengrößen (z. B. 100 μL) ohne Gerätemodifikationen verwendet werden können. TV-SPME hat auch einige der gleichen Vorteile wie Headspace SPME. Headspace SPME erfordert keine Extraktion oder Filtration, da nichtflüchtige Verbindungen in der Headspace-Durchstechflasche verbleiben und nicht an die Faser adsorbiert werden, was zu einer sauberen Probe führt. Diese Methode hilft auch, Matrixeffekte zu eliminieren, da es sich um ein zweipha…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Diese Forschung wurde vom National Institute of Justice unterstützt (Award No. 2015-DN-BX-K058 & 2018-75-CX-0035). Die hier geäußerten Meinungen, Erkenntnisse und Schlussfolgerungen sind die des Autors und spiegeln nicht unbedingt die der Förderorganisationen wider.
Materials
| 10 µL Syringe | Gerstel | 100111-014-00 | |
| BSTFA + 1% TMCS (10 x 1 GM) | Regis Technologies Inc. | 50442882 | |
| eVol XR Sample Dispensing System Kit | ThermoFisher Scientific | 66002-024 | |
 -Butyrolactone (GBL) -Butyrolactone (GBL) |
Sigma-Aldrich | B103608-26G | |
 -Hydroxy Butyric Acid (GHB) -Hydroxy Butyric Acid (GHB) |
Cayman Chemicals | 9002506 | |
| Headspace Screw-Thread Vials, 18 mm | Restek | 23083 | |
| Magnetic Screw-Thread Caps, 18 mm | Restek | 23091 | |
| Optima water for HPLC | Fisher Chemical | W71 | |
| SPME Fiber Assembly Polydimethylsiloxane (PDMS) | Supelco | 57341-U | |
| SPME Fiber Assembly Polydimethylsiloxane/Divinylbenzene (PDMS/DVB) | Supelco | 57293-U | |
| Topaz 2.0 mm ID Straight Inlet Liner | Restek | 23313 |
References
- Pawliszyn, J. B. Method and Device for Solid Phase Microextraction and Desorption. United States patent. , (2005).
- Pawliszyn, J. . Solid phase microextraction: theory and practice. , (1997).
- Rainey, C. L., Bors, D. E., Goodpaster, J. V. Design and optimization of a total vaporization technique coupled to solid-phase microextraction. Analytical Chemistry. 86 (22), 11319-11325 (2014).
- Sinnott, R. . Chemical Engineering Design: Chemical Engineering. 6, (2005).
- Davis, K. . Detection of Illicit Drugs in Various Matrices Via Total Vaporization Solid-Phase Microextraction (TV-SPME). , (2019).
- Ash, J., Hickey, L., Goodpaster, J. Formation and identification of novel derivatives of primary amine and zwitterionic drugs. Forensic Chemistry. 10, 37-47 (2018).
- Sauzier, G., Bors, D., Ash, J., Goodpaster, J. V., Lewis, S. W. Optimisation of recovery protocols for double-base smokeless powder residues analysed by total vaporisation (TV) SPME/GC-MS. Talanta. 158, 368-374 (2016).
- Bors, D., Goodpaster, J. Mapping smokeless powder residue on PVC pipe bomb fragments using total vaporization solid phase microextraction. Forensic science international. 276, 71-76 (2017).
- Bors, D., Goodpaster, J. Chemical analysis of racing fuels using total vaporization and gas chromatography mass spectrometry (GC/MS). Analytical Methods. 8 (19), 3899-3902 (2016).
- Beiranvand, M., Ghiasvand, A. Design and optimization of the VA-TV-SPME method for ultrasensitive determination of the PAHs in polluted water. Talanta. 212, 120809 (2020).

