Corti Organına Doğru Hücre Göçünü Keşfetmek için Tüp Bebek Zaman Atlamalı Canlı Hücre Görüntüleme
Summary
Bu çalışmada, Corti organını içeren koklear epitel ile eks vivo inkübasyon ile hasarlı dokuya doğru hareket eden hücreleri gözlemlemek için konfokal mikroskopi kullanarak gerçek zamanlı bir görüntüleme yöntemi sunuyoruz.
Abstract
Mezenkimal kök hücrelerin (MSC’ ler) hücre yenilenmesi ve tedavisi üzerindeki etkilerini incelemek için bu yöntem koklear epitel ile birlikte kültürden sonra MSC göç ve morfolojik değişiklikleri izler. Corti’nin organı, reissner’ın diseksiyon sırasında üretilen zarının bir kısmına basılarak plastik bir kapak kapağı üzerinde hareketsiz hale getirildi. Cam silindirle sınırlı olan MSC’ler, silindir çıkarıldığında koklear epitellere doğru göç etti. Baskın lokalizasyonları, Corti organının modiolusunda, sinir liflerine benzer bir yönde hizalanmış olarak gözlendi. Bununla birlikte, bazı MSC’ler limbus bölgesinde lokalize edildi ve yatay olarak uzatılmış bir şekil gösterdi. Ayrıca saç hücresi bölgesine göç arttırıldı ve kanamycin tedavisinden sonra MSC’lerin morfolojisi çeşitli formlara dönüştü. Sonuç olarak, bu çalışmanın sonuçları, KOKLEAR epitel ile MSC’lerin kokültürünün hücre nakli yoluyla terapötiklerin gelişimi ve çeşitli durumları ve faktörleri inceleyebilen hücre yenilenmesi çalışmaları için yararlı olacağını göstermektedir.
Introduction
İşitme kaybı doğuştan ortaya çıkabilir veya yaşlanma, ilaçlar ve gürültü de dahil olmak üzere çeşitli faktörlerden giderek kaynaklanabilir. İşitme kaybı genellikle tedavi etmek zordur, çünkü işitmeden sorumlu saç hücreleri hasar gördükten sonra bozulmuş işlevi geri yüklemek çok zordur1. Dünya Sağlık Örgütü’ne göre, dünya nüfusunun %6,1’ini oluşturan dünya genelinde 461 milyon kişinin işitme kaybı olduğu tahmin edilmektedir. İşitme kaybı olanların %93’ü yetişkin, %7’si çocuk.
İşitme kaybını tedavi etmek için bir dizi yaklaşım denenmiştir; özellikle MSC’leri kullanan bir rejenerasyon yaklaşımı umut verici bir tedavi olarak ortaya çıkmıştır. Doku hasar gördüğünde, MSC’ler doğal olarak dolaşım sistemine salınır ve rejenerasyon2’yidestekleyen bir mikroçevre oluşturmak için çeşitli moleküller salgıladıkları yaralanma bölgesine göç eder. Bu nedenle, hasarlı hücre fonksiyonu 3,4,5’inrestorasyonunu geliştirmek için organları hedeflemek için dışarıdan implante edilmiş MSC’lerin göçü ve daha sonra güçlü bağışıklıkdüzenlemesine, anjiogenez ve anti-apoptoza neden olan moleküllerin salgılanması yoluyla hasarlı dokuları tedavi etmek için bir yöntem geliştirmek önemlidir.
MSC’lerin hasarlı dokulara göç ettiği takip süreci aşılması gereken en önemli engel olabilir. MSC’ler, bağlama/yuvarlama, aktivasyon, tutuklama, transmidigrasyon/diapedez ve geçiş 6,7,8sıralı adımlarına sahip sistemik bir homingmekanizmasınasahiptir. Şu anda, bu adımları iyileştirmenin yollarını belirleme çabaları devam ediyor. Genetik modifikasyon, hücre yüzey mühendisliği, in vitro astarlama ve manyetik rehberlik gibi çeşitli stratejiler test edilmiştir6,7. Buna ek olarak, MSC’leri hasarlı koklea bölgesine yerle bir ederek işitsel saç hücrelerinin korunmasını ve yenilenmesini teşvik etmek için çeşitli girişimlerde bulunulmuştır. Bununla birlikte, VIVO’daki MSC’leri izlemek zaman alıcı ve emek yoğundur ve son derece özel beceriler gerektirir9.
Bu sorunu çözmek için, hücrelerin birkaç saat boyunca geçişini fotoğraflayan zaman atlamalı konfokal mikroskopi yoluyla kokleadaki MSC’lerin homingini gözlemlemek için bir yöntem geliştirilmiştir (Şekil 1). 20. yüzyılın başlarında geliştirilmiştir ve son zamanlarda belirli hücrelerin göçlerini incelemek için güçlü bir araçhaline gelmiştir.
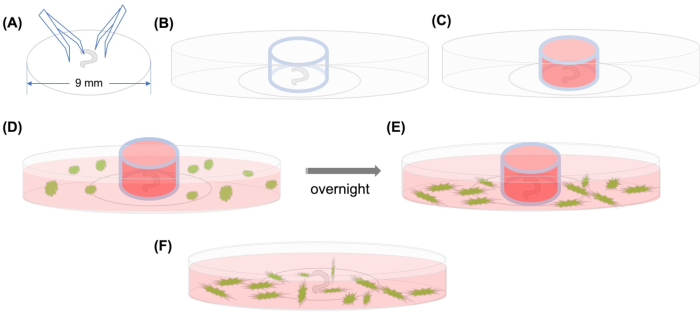
Şekil 1: Grafiksel özet. (A) Corti’nin parçalanmış organı, uzunlayıp kullanılarak plastik bir kapakçık üzerine yapıştıktan sonra, kapak kapağı 35 mm cam tabanlı konfokal mikroskobik bir kabın üzerine yerleştirilir ve (B) cam silindir yerleştirilir. (C) Cam silindirin içini orta ile doldurduktan sonra, (D) orta ile GFP etiketli MSC’ler silindirin dışına dikkatlice eklenir. (E) Bir gecede inkübasyondan sonra, (F) cam silindir çıkarılır ve konfokal mikroskopla görüntüler alınır. Kısaltmalar: GFP = yeşil floresan protein; MSC’ler = mezenkimal kök hücreler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Hasarlı hücrelerin yenilenmesini teşvik etmek için MSC’lerin hasarlı bölgelere nakli kapsamlı bir şekilde incelenmiştir ve terapötik etki açıktır. MSC’lerin transplantasyonu ve daha sonra farklılaşması, 3-nitropropionik asit13tarafından indüklenen işitme kaybı olan sıçanlarda işitmeyi geri getirdiği bildirilmiştir. Lee ve arkadaşları insanlara trans-venöz olarak MSC’ler uygulamış olsalar da, işitmede önemli bir iyileşme sağlayamadılar14. Y…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, Kore Ulusal Araştırma Vakfı (NRF) ve Hallym Üniversitesi Araştırma Fonu’ndan (NRF-2018-R1D1A1B07050175, HURF-2017-66) araştırma hibeleri ile desteklenmiştir.
Materials
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
References
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).

