Verwendung eines perkutanen ventrikulären Unterstützungsgeräts / linker Vorhof zu Femurarterien-Bypass-System für kardiogenen Schock
Summary
Der folgende Artikel beschreibt das schrittweise Verfahren zur Platzierung eines Geräts (z. B. Tandemherz) bei kardiogenem Schock (CS), bei dem es sich um ein perkutanes linksventrikuläres Unterstützungsgerät (pLVAD) und ein LAFAB-System (Left Atrial to Femoral Arterie Bypass) handelt, das den linken Ventrikel (LV) bei CS umgeht und unterstützt.
Abstract
Das LAFAB-System (Left Atrial to Femoral Artery Bypass) ist ein mechanisches Kreislaufunterstützungsgerät (MCS), das bei kardiogenem Schock (CS) verwendet wird und den linken Ventrikel umgeht, indem blut aus dem linken Vorhof (LA) abgelassen und über die Oberschenkelarterie in den systemischen arteriellen Kreislauf zurückgeführt wird. Es kann Ströme von 2,5-5 l / min abhängig von der Größe der Kanüle liefern. Hier diskutieren wir den Wirkmechanismus von LAFAB, verfügbare klinische Daten, Indikationen für seine Verwendung bei kardiogenem Schock, Implantationsschritte, postoperative Versorgung und Komplikationen im Zusammenhang mit der Verwendung dieses Geräts und deren Behandlung.
Wir bieten auch ein kurzes Video der prozeduralen Komponente der Gerätetherapie, einschließlich der Vorbereitung vor der Platzierung, der perkutanen Platzierung des Geräts über die transseptale Punktion unter echokardiographischer Anleitung und der postoperativen Verwaltung der Geräteparameter.
Introduction
Der kardiogene Schock (CS) ist ein Zustand der Gewebehyperfusion mit oder ohne begleitende Hypotonie, bei dem das Herz nicht in der Lage ist, genügend Blut und Sauerstoff zu liefern, um den Bedarf des Körpers zu decken, was zu Organversagen führt. Es wird von der Society of Cardiovascular Angiography and Interventions (SCAI) in die Stadien A bis E eingeteilt: Stadium A – Patienten mit CS-Risiko; Stadium B – Patienten im Anfangsstadium von CS mit Hypotonie oder Tachykardie ohne Hypoperfusion; Stadium C – klassisches CS mit kaltem und nassem Phänotyp, der Inotrope / Vasopressoren oder mechanische Unterstützung zur Aufrechterhaltung der Perfusion erfordert; Stufe D – Verschlechterung der aktuellen medizinischen oder mechanischen Unterstützung, die eine Eskalation auf fortschrittlichere Geräte erfordert; und Stadium E – umfasst Patienten mit Kreislaufkollaps und refraktären Arrhythmien, die aktiv einen Herzstillstand mit laufender Herz-Lungen-Wiederbelebung erleiden1. Die häufigsten Ursachen für CS sind akute MI (AMI), die 81% der Fälle in einer kürzlich berichteten Analyse2 ausmachen, und akute dekompensierte Herzinsuffizienz (ADHF). CS ist klassisch durch Stauung und gestörte Perfusion gekennzeichnet, die sich in erhöhten Fülldrücken (pulmonaler kapillarer Keildruck [PCWP], linksventrikulärer enddiastolischer Druck [LVEDP], zentralvenöser Druck [CVP] und rechtsventrikulärer enddiastolischer Druck [RVEDP]), vermindertem Herzzeitvolumen (CO), Herzindex (CI), Herzleistung (CPO) und Fehlfunktion des Endorgans manifestieren3 . In der Vergangenheit waren die einzigen verfügbaren Behandlungen für AMI, die durch CS kompliziert wurden, die frühe Revaskularisation und die medizinische Behandlung mit Inotropen und / oder Vasopressoren4. In jüngerer Zeit, mit dem Aufkommen von Geräten zur mechanischen Kreislaufunterstützung (MCS) und der Erkenntnis, dass die Eskalation von Vasopressoren mit einer erhöhten Mortalität verbunden ist, gab es einen Paradigmenwechsel in der Behandlung von AMI und ADHF-bezogenem CS5,6.
In der heutigen Ära der perkutanen ventrikulären Unterstützungsgeräte (pVAD) gibt es eine Reihe von MCS-Geräteplattformen/-konfigurationen, die univentrikuläre oder biventrikuläre Kreislauf- und Ventrikelunterstützung mit und ohne Sauerstoffversorgungsfähigkeit bieten7. Trotz stetiger Zunahme der Verwendung von pVADs zur Behandlung von AMI und ADHF CS sind die Sterblichkeitsraten weitgehend unverändert geblieben5. Mit sich abzeichnenden Beweisen für mögliche klinische Vorteile bei der frühzeitigen Entladung des linken Ventrikels (LV) in AMI8 und der frühen Anwendung von MCS in AMI CS9 nimmt die Verwendung von MCS weiter zu.
Das MCS-Gerät (Left Atrial to Femoral Artery Bypass, LAFAB) umgeht die LV, indem es Blut aus dem linken Vorhof (LA) ablässt und über die Oberschenkelarterie in den systemischen arteriellen Kreislauf zurückführt (Abbildung 1). Es wird von einer externen Kreiselpumpe unterstützt, die je nach Größe der Kanülen einen Durchfluss von 2,5-5,0 Litern pro Minute (L / m) bietet (Pumpe der neuen Generation, die als LifeSPARC bezeichnet wird und einen Durchfluss von bis zu 8 l / m erreichen kann). Sobald das Blut über die transseptale Venenkanüle aus der LA extrahiert wurde, durchläuft es die externe Kreiselpumpe, die das Blut über die in der Oberschenkelarterie platzierte arterielle Kanüle in den Körper des Patienten zurückführt.
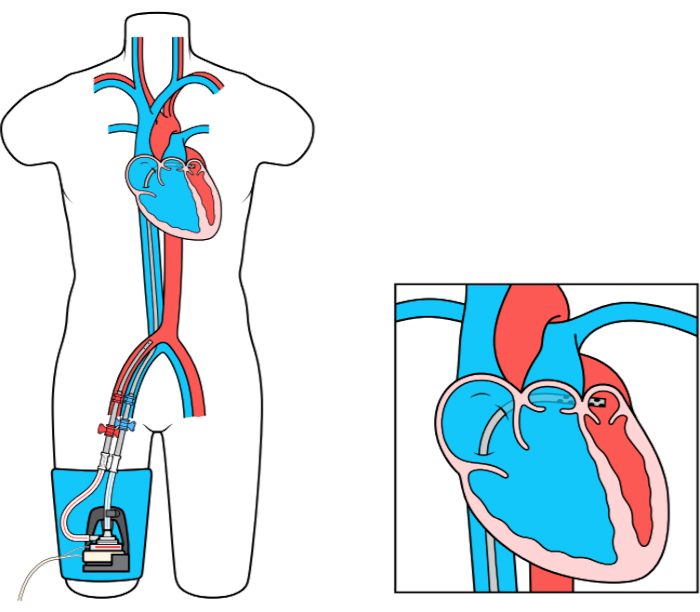
Abbildung 1: LAFAB-Setup. Mit freundlicher Genehmigung von TandemLife, einer hundertprozentigen Tochtergesellschaft von LivaNova US Inc. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Hämodynamik des LAFAB-Geräts:
Das hämodynamische Profil des LAFAB-Geräts unterscheidet sich von anderen pVADs. Indem Blut direkt aus dem LA abgelassen und in die Oberschenkelarterie zurückgeführt wird, umgeht das Gerät die LV vollständig. Auf diese Weise reduziert es das LV-Enddiastolische Volumen und den Druck, was zu einer verbesserten LV-Geometrie beiträgt und dadurch eine Verringerung der LV-Hubarbeit bewirkt. Durch die Rückführung des Blutes in die Arteria iliaca / abs…
Divulgations
The authors have nothing to disclose.
Acknowledgements
An das TandemHeart-Team von LifeSparc.
Materials
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
References
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction–etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O’Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).

