신경 발달 도중 ROS 살아있는 세포 화상 진찰
Summary
이 프로토콜은 신경계 발달 중H2 O2의생리적 신호 역할을 평가하기 위한 배양 된 제브라피시 뉴런 및 애벌레에서 유전으로 인코딩 된 과산화수소 (H2O2)-바이오센서의 사용을 설명합니다. 그것은 다른 세포 유형에 적용 하 고 일반적인 개발에 반응성 산소 종 (ROS)를 공부 하는 실험 치료와 함께 수정 될 수 있습니다.
Abstract
반응성 산소 종 (ROS)은 정상적인 발달, 항상성 및 생리학에서 중요한 잘 확립 된 신호 분자입니다. 상이한 ROS 중, 과산화수소(H2 O2)는세포 신호의 역할에 대하여 가장 잘 특징지었습니다. H2O2는 여러 종의 발달 중에 연루되었습니다. 예를 들어, H 2O2의일시적인 증가는 수정 후 첫 날 동안 제브라피시 배아에서 검출되었다. 더욱이, 중요한 세포H2O2 소스, NADPH 산화효소(NOX)를 고갈시키는 것은 생체내 및 체외 에서 모두 분화, 축축한 성장 및 망막 신경절 세포(RGC)의 지도와 같은 신경계 발달을손상시합니다. 여기서, 우리는 유전자 인코딩 된 H 2O 2-특정 바이오 센서, roGFP2-Orp1을 사용하여 개발 중에 배양 된 제브라피시 뉴런 및 전체 애벌레에서 세포 내 H2O2수준을 이미징하는 방법을 설명합니다. 이 프로브는 제브라피시 애벌레에서 일시적으로 또는 안정적으로 표현될 수 있다. 더욱이, 비율 측정 판독은 차등 유전자 발현 또는 부피 효과로 인해 유물을 검출할 확률을 감소시다. 첫째, 우리는 일시적으로 roGFP2-Orp1을 표현하는 제브라피시 배아에서 파생된 RG를 분리하고 배양하는 방법을 보여줍니다. 그런 다음 전체 애벌레를 사용하여 조직 수준에서 H2O2 수준을 모니터링합니다. 센서는 H 2O2의첨가에 의해 검증되었습니다. 추가적으로, 이 방법론은 조직 특정 biosensor 발현을 가진 형질전환 동물을 생성해서 특정 세포 모형 및 조직에 있는 H2O2 수준을 측정하기 위하여 이용될 수 있었습니다. Zebrafish가 유전 및 발달 조작을 용이하게 하기 때문에, 여기에서 입증된 접근은 척추동물에 있는 신경 및 일반적인 배아 발달 도중 H2O2의 역할을 시험하는 파이프라인 역할을 할 수 있었습니다.
Introduction
반응성 산소 종(ROS) 신호는 신경계1의개발 및 기능을 조절한다. 중요한 세포 ROS 공급원은 NADPH 산화효소(NOX)로, 이는 과산화수소와 과산화수소(H2O2)2를생성하는 막 단백질이다. NOX 효소는 중추 신경계(CNS)를 통해 발견되며, NOX 유래 ROS는 뉴런 개발에기여3,4,5,6. 신경 줄기 세포의 유지 보수 및 분화, 신경 극성 확립, 중성염 아웃성장 및 시냅스 가소성은 ROS7,8,9,10,11의적절한 수준을 요구하는 것으로 나타났다. 한편, NOXes에 의한 ROS의 통제되지 않은 생산은 알츠하이머병, 다발성 경화증 및 외상성 뇌 손상을 포함한 신경 퇴행성 질환에 기여한다12,13,14. 따라서 생리학적으로 관련된 ROS의 생산은 건강한 상태를 유지하는 데 중요합니다.
유전자 인코딩 된 바이오 센서의 개발은 세포 ROS의 검출을 크게 촉진시켰습니다. 유전자 인코딩 된 바이오 센서의 한 가지 중요한 장점은 이러한 센서가 특히 뚜렷한 위치를 대상으로 할 수 있기 때문에 ROS 신호의 증가 된 시간적 및 공간 해상도입니다. 레독스에 민감한 GFP(roGFP)는 이러한 ROS 바이오 센서의 한 유형입니다. roGFP2-Orp1 변이체는 효모15,16에서글루타티온 peroxiredoxin 가족 단백질인 Orp1 도메인을 통해 H2O2를 구체적으로 검출한다. Orp1 단백질의 산화는 그것의 형성을 바꾸기 위하여 roGFP2로 옮겨져(도 1A). 이 프로브는 405nm와 480nm 근처의 두 개의 여기 봉우리와 515 nm에서 단일 방출 피크를 전시합니다. 산화 시, 흥분 피크 주위 형광 강도 변경: 동안 405 nm 흥분 증가, 480 nm 흥분 감소. 따라서, roGFP2-Orp1은 비율인식 생체센서이며,H2O-2-레벨은두 개의 상이한 파장(도1B)에서흥분되는 형광 강도의 비율에 의해 검출된다. 전반적으로 roGFP2-Orp1은 생체 내에서효율적으로 활용할 수 있는 ROS 이미징을 위한 다목적 도구입니다.
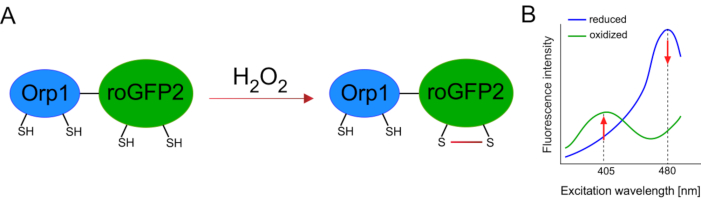
그림 1: roGFP2-Orp1의 회로도 표현 및 여기 스펙트럼. (A)Oxidant 전송은 H 2 O2에대한 응답으로 Orp1과 roGFP2 사이에 발생하여 roGFP2의 형성적 변화를 초래한다. (B)roGFP2-Orp1의 흥분 스펙트럼은 405 nm와 480 nm및 515 nm에서 단일 방출 피크에서 두 개의 여기 피크를 나타낸다. H2O2에의해 산화시, 405 nm 흥분 증가 하는 동안 480 nm 흥분 감소. 이렇게 하면 H2 O2존재에 대한 비율 측정 판독이 발생합니다. 이 수치는 빌란과 벨로소프(2017)16및 모건 외(2011)25에서수정되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Danio rerio (제브라피시) 모델 시스템은 유전자 인코딩 된 바이오 센서를 적용하는 데 몇 가지 장점이 있습니다. 배아와 애벌레의 광학적 투명성은 비침습적 생체 내 이미징을 가능하게 합니다. 새로운 이미징 도구는 더 높은 해상도와 더 깊은 침투를 달성하기 위해 개발되고있다17. 또한, 유전자 조작을 위한 확립된 도구(ectopic mRNA 발현, 톨2 전세대 등) 및 게놈 편집(TALENs, CRISPR/Cas9 등) 및 게놈 편집(TALEN, CRISPR/Cas9 등)이 있어 트랜스제닉 동물의 생성을 촉진하는18. 제브라피쉬 배아가 어머니 밖에서 발전함에 따라 이 시스템은 배아의 접근과 조작을 더욱 쉽게 할 수 있습니다. 예를 들어, 1 세포 단계 주사 및 약물 치료는 쉽게 할 수 있습니다.
여기서, 우리는 체외 전사 mRNA에 주입하여 H2O2-특정바이오 센서 roGFP2-Orp1을 일시적으로 표현하기 위해 제브라피쉬를 사용했습니다. 이러한 배아는 배양된 뉴런의 체외 이미징과 생체 내이미징(도 2)에 모두 사용될 수 있다. 우리는 제브라피시 배아에서 망막 신경절 세포 (RGC)를 해부하고 도금하기위한 프로토콜을 설명하고 배양 뉴런에서 H2O2-수준을 평가합니다. 그런 다음, 우리는 공초점 현미경 검사를 사용하여 roGFP2-Orp1 표현 배아 및 애벌레의 생체 내 이미징을 위한 방법을 제시합니다. 이 접근은 생리적인 H2O2-수준을 결정할 뿐만 아니라 다른 발달 단계 또는 조건에서 생기는 잠재적인 변경을 결정할 수 있습니다. 전반적으로, 이 시스템은 살아있는 세포및 동물에서H2O2를 검출하는 신뢰할 수 있는 방법을 제공하여 개발, 건강 및 질병에서 H 2 O2의역할을 연구한다.
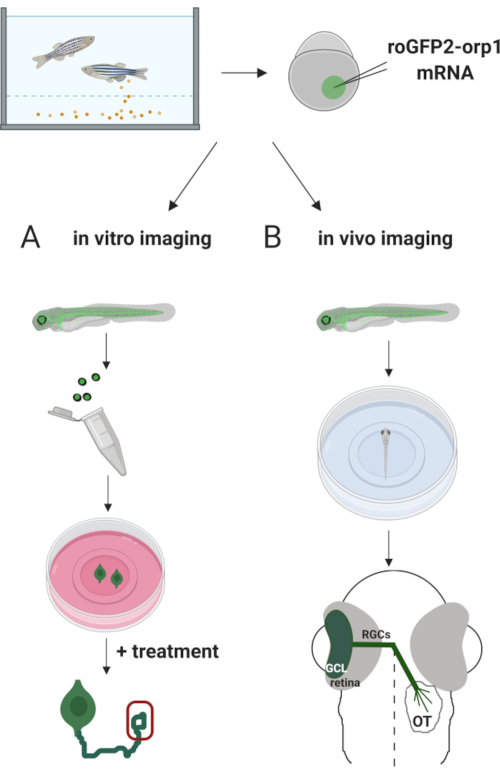
그림 2. 실험적 접근 방식의 개요입니다. 간단히, 배아 수집 후, roGFP2-Orp1 mRNA는 1 세포 단계 제브라피시 배아의 노른자로 주입된다. 개발 배아는 생체 외에서 (A)및(B)생체 내 이미징 모두에 사용할 수 있습니다. (A)GFP 양성 배아는 34hpf에서 RGC 수집을 위한 망막을 해부하는 데 사용된다. 해리된 RG는 ZFCM(+) 미디어의 PDL/라미닌 코팅 커버립에 도금됩니다. RGCs가 도금 6-24 h 후 축축을 확장함에 따라 성장 콘 이미징을 수행할 수 있습니다. 세포는 H2O 2-level의 잠재적인 변화를 측정하기 위해 다른 치료를 받을 수 있습니다. 여기서, 우리는 RGC (빨간색)의 성장 콘에서 H2O2-수준을 측정했습니다. (B)GFP 양성 배아는 생체 내 이미징에 사용된다. 원하는 나이에, 태아는 공초점 화상 진찰을 위한 35 mm 유리 바닥 접시에 마취하고 장착될 수 있습니다. 여기서 배아는 망막 이미징을 위해 통풍구로 장착됩니다. 회로도는 제브라피시의 망막 발달을 보여줍니다. RGC는 망막에서 가장 안쪽 층인 신경절 세포 층(GCL)을 형성합니다. RGC 축축은 시신경으로 발전하여 중선을 넘어 시구를 형성합니다. 그런 다음 RGC 축축은 중뇌의 광학 텍텀에서 시냅스를 만들기 위해 등등으로 자랍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
이 프로토콜 전체에 주의를 기울여야 하는 몇 가지 중요한 단계가 있습니다. 우리는 이러한 점을 고려하면 실험 흐름을 향상시킬 것이라고 믿습니다. 1 차적인 RGC 배양에 대 한, ZFCM의 멸균 (-) 매우 중요 한, 이 배양 매체 항생제를 포함 하지 않기 때문에 오염 이미징 전후 또는 동안 발생할 수 있습니다. 이를 방지하기 위해 생물 안전 캐비닛 내에서만 ZFCM(-)을 준비하고 사용하는 것이 좋습니다. 또?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 작품은 국립 보건원 (그랜트 R01NS117701), 국립 과학 재단 (그랜트 1146944-IOS), 인디애나 외상척수및 뇌 손상 연구 기금 (그랜트 20000289), Purdue 연구 재단 (그랜트 209911), Purdue 대학의 연구 및 파트너십 담당 수석 부사장 (그랜트 210362)에 의해 지원되었다. 우리는 제브라피시 RGC 문화 프로토콜을 수립한 코리 J. 위버 박사와 헤일리 로더 박사에게 감사드립니다. 그림 4의 데이터를 제공해 주신 헤일리 로더에게 감사드립니다. 우리는 RGC 문화에 대한 도움레아 바이어시와 케니 응우옌에게 감사드립니다. 글편집에 감사드립니다. 우리는 roGFP2-Orp1 및 roGFP2-Orp1을 포함하는 pCS2+ 벡터에 대한 박사 칭 덩을 제공 토비아스 딕 박사에게 감사드립니다. 그림 2는 Biorender.com 함께 만들어집니다.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

