ROS تصوير الخلايا الحية أثناء تطوير الخلايا العصبية
Summary
يصف هذا البروتوكول استخدام بيروكسيد الهيدروجين المشفر وراثيا (H2O2)– الاستشعار الحيوي في الخلايا العصبية ويرقات سمك الحمار الوحشي المستزرعة لتقييم أدوار الإشارات الفسيولوجية ل H2O2 أثناء تطور الجهاز العصبي. ويمكن تطبيقه على أنواع مختلفة من الخلايا وتعديلها مع العلاجات التجريبية لدراسة أنواع الأكسجين التفاعلية (ROS) في التنمية العامة.
Abstract
أنواع الأكسجين التفاعلية (ROS) هي جزيئات إشارات راسخة ، وهي مهمة في التطور الطبيعي ، وداء التوازن ، وعلم وظائف الأعضاء. من بين ROS مختلفة، بيروكسيد الهيدروجين (H2O2)يتميز أفضل فيما يتعلق بأدوار في الإشارات الخلوية. وقد تورط H2O2 خلال التنمية في عدة أنواع. فعلى سبيل المثال، تم الكشف عن زيادة عابرة في H2O2 في أجنة حمار وحشي خلال الأيام الأولى بعد الإخصاب. وعلاوة على ذلك، استنزاف مصدر الخلوية الهامة H2O2، NADPH oxidase (NOX)، يضعف تطور الجهاز العصبي مثل التمايز، والنمو المحوري، والتوجيه من خلايا العقدة الشبكية (RGCs) على حد سواء في الجسم الحي وفي المختبر. هنا ، نصف طريقة لتصوير مستويات H2O2 داخل الخلايا في الخلايا العصبية المستزرعة حمار وحشي ويرقات كاملة أثناء التطوير باستخدام جهاز الاستشعار الحيوي H2O2المشفر وراثيا ، roGFP2-Orp1. يمكن التعبير عن هذا المسبار بشكل عابر أو ثابت في يرقات حمار وحشي. وعلاوة على ذلك، يقلل قراءات قياس النسب من احتمال اكتشاف القطع الأثرية بسبب التعبير الجيني التفاضلي أو آثار الحجم. أولا، نحن نظهر كيفية عزل وزراعة RGCs المستمدة من أجنة حمار وحشي التي تعبر عن عابر roGFP2-Orp1. ثم نستخدم يرقات كاملة لمراقبة مستويات H2O2 على مستوى الأنسجة. وقد تم التحقق من صحة جهاز الاستشعار بإضافة H2O2. بالإضافة إلى ذلك، يمكن استخدام هذه المنهجية لقياس مستويات H2O2 في أنواع خلايا وأنسجة محددة عن طريق توليد معدلة وراثيا مع تعبير حساس حيوي خاص بالأنسجة. وبما أن سمك الحمار الوحشي يسهل التلاعب الجيني والتنموي، فإن النهج الذي يظهر هنا يمكن أن يكون بمثابة خط أنابيب لاختبار دور H2O2 أثناء التطور العصبي والجنيني العام في الفقاريات.
Introduction
أنواع الأكسجين التفاعلية (ROS) الإشارات ينظم تطوير وأداء الجهاز العصبي1. مصدر ROS الخلوية الهامة هي NADPH oxidases (NOX)، والتي هي بروتينات ترانسميمبرين توليد سوبر أكسيد وبيروكسيد الهيدروجين (H2O2)2. توجد إنزيمات NOX في جميع أنحاء الجهاز العصبي المركزي (CNS) ، ويساهم ROS المشتقة من NOX في تطوير الخلايا العصبية3و4و5و6. وقد ثبت صيانة وتمايز الخلايا الجذعية العصبية، وإنشاء قطبية الخلايا العصبية، و نمو نيوريت، و اللدونة متشابك تتطلب مستويات كافية من ROS7،8،9،10،11. من ناحية أخرى، إنتاج غير المنضبط من ROS بواسطة NOXes تسهم في الاضطرابات العصبية بما في ذلك مرض الزهايمر، والتصلب المتعدد، وإصابات الدماغالرضية 12،13،14. وبالتالي، فإن إنتاج ROS ذات الصلة من الناحية الفسيولوجية أمر بالغ الأهمية للحفاظ على ظروف صحية.
وقد سهل تطوير أجهزة الاستشعار البيولوجية المشفرة وراثيا الكشف عن ال ROS الخلوية بشكل كبير. ومن المزايا الهامة لأجهزة الاستشعار البيولوجية المشفرة وراثيا زيادة الاستبانة الزمنية والمكانية لإشارة ROS، حيث يمكن استهداف أجهزة الاستشعار هذه على وجه التحديد إلى مواقع متميزة. GFP الحساسة للأكسدة (roGFP) هو نوع واحد من هذه أجهزة الاستشعار الحيوية ROS. البديل roGFP2-Orp1 يكشف على وجه التحديد H2O2 من خلال مجالها Orp1، وهو بروتين الأسرة بيروكسيريدوكسيني الجلوتاثيون من الخميرة15،16. يتم نقل أكسدة البروتين Orp1 إلى roGFP2 لتغيير تشكيله (الشكل 1A). ويعرض المسبار قمتين للإثارة بالقرب من 405 نانومتر و480 نانومتر، وذروة انبعاث واحدة عند 515 نانومتر. عند الأكسدة ، تتغير كثافة الفلورسينس حول قمم الإثارة: في حين يزيد الإثارة 405 نانومتر ، ينخفض 480 نانومتر من الإثارة. وهكذا، roGFP2-Orp1 هو حساس حيوي نسبة، ويتم الكشف عن H2O2-levels بنسبة كثافة الفلورية متحمس في أطوال موجية مختلفة اثنين(الشكل 1B). عموما، roGFP2-Orp1 هو أداة متعددة الاستخدامات للتصوير ROS التي يمكن استخدامها بكفاءة في الجسم الحي.
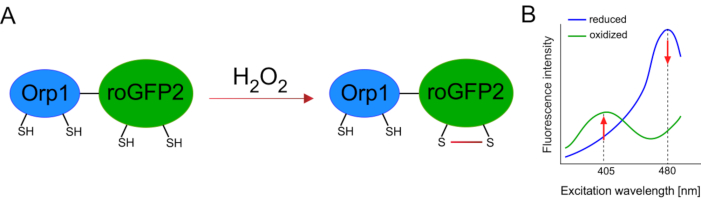
الشكل 1: التمثيل التخطيطي وأطياف الإثارة من roGFP2-Orp1. (A) نقل الأكسدة يحدث بين Orp1 و roGFP2 ردا على H2O2, مما يؤدي إلى تغييرات تشكيلية في roGFP2. (ب) تعرض أطياف الإثارة من roGFP2-Orp1 قمتين للإثارة عند 405 نانومتر و480 نانومتر وذروة انبعاث واحدة عند 515 نانومتر. عند الأكسدة بواسطة H2O2، يزيد الإثارة 405 نانومتر في حين ينخفض 480 نانومتر من الإثارة. ينتج عن ذلك قراءات معدلية لوجود H2O2. تم تعديل الرقم من بيلان وبيلوسوف (2017)16 ومورغان وآخرين (2011)25. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
نظام نموذج دانيو ريو (حمار وحشي) له العديد من المزايا لتطبيق أجهزة الاستشعار البيولوجية المشفرة وراثيا. الشفافية البصرية للأجنة واليرقات تمكن التصوير غير الغازي في الجسم الحي. ويجري تطوير أدوات التصوير الجديدة لتحقيق دقة أعلى وأعمق اختراق17. وعلاوة على ذلك، هناك أدوات راسخة للتلاعب الجيني (التعبير ميرنا خارج الرحم، Tol2 transgenesis، الخ) وتحرير الجينوم (TALENs، CRISPR/Cas9، الخ)، الذي يعزز جيل الحيوانات المعدلةوراثيا 18. كما تتطور أجنة حمار وحشي خارج الأم، وهذا النظام يسمح كذلك سهولة الوصول والتلاعب في الأجنة. على سبيل المثال، يمكن بسهولة حقن المرحلة من خلية واحدة والعلاجات الدوائية.
هنا، استخدمنا حمار وحشي للتعبير عن عابر H2O2-محددة الاستشعار الحيوي roGFP2-Orp1 عن طريق حقن في الحمض النووي الريبي المختبرة المنسوخة. ويمكن استخدام هذه الأجنة في كل من التصوير المختبري للخلايا العصبية المستزرعة والتصوير في الجسم الحي (الشكل 2). نحن نصف بروتوكولا لتشريح وصفيح خلايا العقدة الشبكية (RGCs) من أجنة حمار وحشي يليه تقييم H2O2-levels في الخلايا العصبية المستزرعة. ثم نقدم طريقة للتصوير الحي للأجنة واليرقات المعبرة عن roGFP2-Orp1 باستخدام المجهر البؤري. هذا النهج لا يسمح فقط لتحديد الفسيولوجية H2O2-مستويات ولكن أيضا التغيرات المحتملة التي تحدث في مراحل النمو المختلفة أو الظروف. بشكل عام، يوفر هذا النظام طريقة موثوقة للكشف عن H2O2 في الخلايا الحية والحيوانات لدراسة دور H2O2 في التنمية والصحة والمرض.
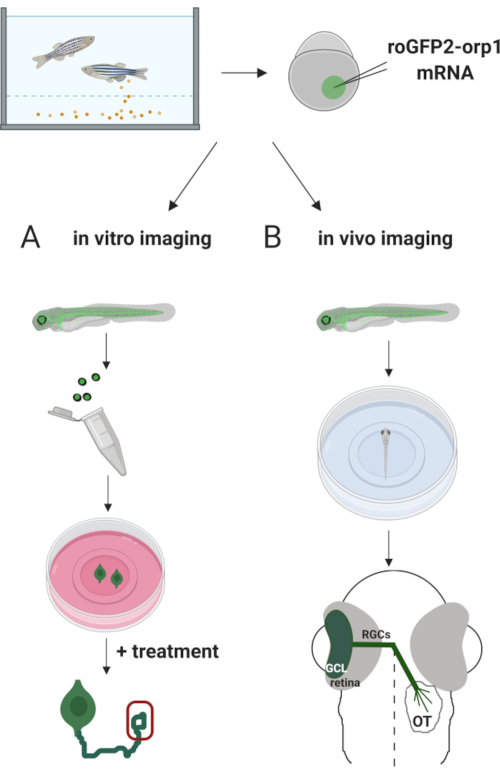
الشكل 2. الخطوط العريضة للنهج التجريبي. لفترة وجيزة، بعد جمع الأجنة، يتم حقن roGFP2-Orp1 مرنا في صفار من خلية واحدة مرحلة أجنة حمار وحشي. يمكن استخدام الأجنة النامية لكل من (أ) في المختبر و (ب) في التصوير الحي. (أ)تستخدم الأجنة الإيجابية GFP لتشريح شبكية العين لجمع RGC في 34 hpf. لوحات RGCs المفككة على أغطية مغلفة ب PDL/laminin في وسائط ZFCM (+). يمكن إجراء تصوير مخروط النمو حيث تقوم RGCs بتوسيع محاورها المحورية بعد 6-24 ساعة من الطلاء. يمكن أن تخضع الخلايا لعلاجات مختلفة لقياس التغيرات المحتملة في H2O2-levels. هنا، قمنا بقياس H2O2-مستويات في المخاريط نمو RGCs (الأحمر). (ب)تستخدم الأجنة الإيجابية GFP للتصوير في الجسم الحي. في العمر المطلوب، يمكن تخدير الأجنة وتركيبها على أطباق قاع زجاجية مقاس 35 ملم للتصوير البؤري. هنا، يتم تركيب الأجنة بطنية لتصوير الشبكية. التخطيطي يظهر تطور الشبكية في حمار وحشي. تشكل RGCs طبقة خلايا العقدة (GCL) ، وهي الطبقة الأعمق في شبكية العين. محاور RGC تتطور إلى العصب البصري لعبور خط الوسط، وتشكيل chiasm البصرية. ثم، محاور RGC تنمو ظهريا لجعل نقاط الاشتباك العصبي في استئصال البصرية في الدماغ المتوسط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
هناك العديد من الخطوات الحاسمة التي تحتاج إلى الاهتمام في جميع أنحاء هذا البروتوكول. ونعتقد أن النظر في هذه النقاط سيحسن التدفق التجريبي. بالنسبة لثقافة RGC الأولية ، فإن عقم ZFCM (-) مهم جدا ، نظرا لأن هذه الوسائط الثقافية لا تحتوي على المضادات الحيوية ويمكن أن يحدث التلوث قبل أو أثناء التصوير…
Divulgations
The authors have nothing to disclose.
Acknowledgements
وقد دعم هذا العمل المعاهد الوطنية للصحة (المنحة R01NS117701)، والمؤسسة الوطنية للعلوم (المنحة 1146944-IOS)، وصندوق أبحاث الحبل الشوكي وإصابات الدماغ في إنديانا (منحة 20000289)، ومؤسسة أبحاث بوردو (منحة 209911)، ومكتب نائب الرئيس التنفيذي للبحوث والشراكات في جامعة بوردو (منحة 210362). نشكر الدكتور كوري ج. ويفر وهايلي رودر على إنشاء بروتوكول ثقافة سمك الحمار الوحشي RGC. نشكر هالي رودر بالإضافة إلى ذلك على توفير بيانات الشكل 4. نشكر ليا بياسي وكيني نغوين على المساعدة في ثقافة RGC. نشكر جنتري لي لتحرير النص. نشكر الدكتور توبياس ديك لتوفير roGFP2-Orp1 والدكتور تشينغ دينغ لأجهزة الكمبيوتر 2 + ناقلات تحتوي على roGFP2-Orp1. يتم إنشاء الشكل 2 مع Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

