ROS Live Cell Imaging Under Neuronal Development
Summary
Denne protokol beskriver brugen af en genetisk kodet brintoverilte (H2O2)-biosensor i dyrkede zebrafisk neuroner og larver til vurdering af de fysiologiske signalroller af H2O2 under udvikling af nervesystemet. Det kan anvendes til forskellige celletyper og modificeres med eksperimentelle behandlinger for at studere reaktive iltarter (ROS) i generel udvikling.
Abstract
Reaktive iltarter (ROS) er veletablerede signalmolekyler, som er vigtige i normal udvikling, homøostase og fysiologi. Blandt de forskellige ROS er brintoverilte (H2O2) bedst karakteriseret med hensyn til roller i cellulær signalering. H2O2 har været impliceret under udviklingen i flere arter. For eksempel er der påvist en forbigående stigning i H2O2 i zebrafiskembryoner i de første dage efter befrugtningen. Desuden nedbryder en vigtig cellulær H2O2 kilde, NADPH oxidase (NOX), forringer nervesystemet udvikling såsom differentiering, axonal vækst, og vejledning af nethinde ganglion celler (RGCs) både in vivo og in vitro. Her beskriver vi en metode til billeddannelse intracellulær H2O2 niveauer i dyrkede zebrafisk neuroner og hele larver under udvikling ved hjælp af genetisk kodet H2O2-specifikbiosensor, roGFP2-Orp1. Denne sonde kan være forbigående eller stabilt udtrykt i zebrafisk larver. Desuden mindsker den ratiometriske udlæsning sandsynligheden for at opdage artefakter på grund af differentialgenudtryk eller volumeneffekter. For det første demonstrerer vi, hvordan man isolerer og dyrker RDC’er afledt af zebrafiskembryoner, der forbigående udtrykker roGFP2-Orp1. Derefter bruger vi hele larver til at overvåge H2O2-niveauer på vævsniveau. Sensoren er blevet valideret ved tilsætning af H2O2. Desuden kunne denne metode anvendes til at måle H2O2-niveauer i specifikke celletyper og væv ved at generere transgene dyr med vævsspecifik biosensorudtryk. Da zebrafisk fremmer genetiske og udviklingsmæssige manipulationer, kan den fremgangsmåde, der demonstreres her, tjene som en rørledning til at teste H 2 O2’srolle under neuronal og generel embryonal udvikling i hvirveldyr.
Introduction
Reaktive iltarter (ROS) signalering regulerer udviklingen og funktionen af nervesystemet1. En vigtig cellulær ROS-kilde er NADPH-oxider (NOX), som er transmembranproteiner, der genererer superoxid og hydrogenperoxid (H2O2)2. NOX enzymer findes i hele centralnervesystemet (CNS), og NOX-afledt ROS bidrager til neuronal udvikling3,4,5,6. Vedligeholdelse og differentiering af neurale stamceller, etablering af neuronal polaritet, neuritvækst og synaptisk plasticitet har vist sig at kræve passende niveauer af ROS7,8,9,10,11. På den anden side bidrager ukontrolleret produktion af ROS af NOX’er til neurodegenerative lidelser, herunder Alzheimers sygdom, multipel sklerose og traumatisk hjerneskade12,13,14. Derfor er produktion af fysiologisk relevant ROS afgørende for at opretholde sunde forhold.
Udvikling af genetisk kodede biosensorer lettede detektionen af cellulær ROS meget. En vigtig fordel ved genetisk kodede biosensorer er den øgede tidsmæssige og rumlige opløsning af ROS-signalet, da disse sensorer specifikt kan målrettes mod forskellige steder. Redox-følsomme GFP (roGFP) er en type af sådanne ROS biosensorer. Den roGFP2-Orp1 variant specifikt registrerer H2O2 gennem sin Orp1 domæne, som er en glutathion peroxiredoxin familie protein fra gær15,16. Oxidationen af Orp1-proteinet overføres til roGFP2 for at ændre dets kropsbygning (Figur 1A). Sonden udviser to excitation toppe nær 405 nm og 480 nm, og en enkelt emission peak på 515 nm. Ved oxidation ændres fluorescensintensiteten omkring excitationstoppene: mens 405 nm excitation øges, falder 480 nm excitation. RoGFP2-Orp1 er således en ratiometrisk biosensor, og H2O2-niveaueropdages ved forholdet mellem fluorescensintensiteter, der er ophidset ved to forskellige bølgelængder (figur 1B). Samlet set roGFP2-Orp1 er et alsidigt værktøj til ROS billedbehandling, der kan udnyttes effektivt in vivo.
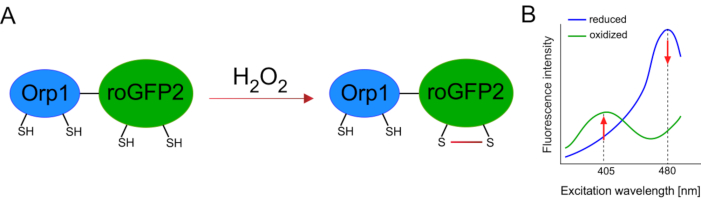
Figur 1: Skematisk repræsentation og excitationsspektre af roGFP2-Orp1. (A) Oxidantoverførsel finder sted mellem Orp1 og roGFP2 som svar på H2O2, hvilket fører til konformationsmæssige ændringer i roGFP2. (B) Den excitation spektre af roGFP2-Orp1 udviser to excitation toppe på 405 nm og 480 nm og enkelt emission peak på 515 nm. Ved oxidation med H2O2øges 405 nm excitationen, mens 480 nm excitation falder. Dette resulterer i en ratiometrisk udlæsning for H2O2 tilstedeværelse. Tallet er blevet ændret fra Bilan og Belousov (2017)16 og Morgan et al. (2011)25. Klik her for at se en større version af dette tal.
Danio rerio (zebrafisk) modelsystemet har flere fordele ved at anvende genetisk kodede biosensorer. Den optiske gennemsigtighed af embryoner og larver muliggør ikke-invasiv in vivo-billeddannelse. Der udvikles nye billedbehandlingsværktøjer for at opnå højere opløsning og dybere gennemtrængning17. Desuden findes der etablerede værktøjer til genmanipulation (ektopisk mRNA-ekspression, Tol2-transgenese osv.) og genomredigering (TALEN’er, CRISPR/Cas9 osv.), som fremmer generering af transgene dyr18. Efterhånden som zebrafiskembryoner udvikler sig uden for moderen, giver dette system yderligere lettere adgang til og manipulation af embryonerne. For eksempel kan en-celle fase injektioner og medicinske behandlinger nemt gøres.
Her brugte vi zebrafisk til forbigående at udtrykke H2O2-specifikbiosensor roGFP2-Orp1 ved at injicere in vitro-transskriberet mRNA. Disse embryoner kan anvendes til både in vitro-billeddannelse af dyrkede neuroner og in vivo-billeddannelse (figur 2). Vi beskriver en protokol til dissekering og plating nethinde ganglion celler (RGCs) fra zebrafisk embryoner efterfulgt af en vurdering H2O2-niveaueri dyrkede neuroner. Derefter præsenterer vi en metode til in vivo-billeddannelse af roGFP2-Orp1-udtrykkende embryoner og larver ved hjælp af konfokal mikroskopi. Denne tilgang gør det ikke kun muligt at bestemme fysiologiske H2O2-niveauer,men også potentielle ændringer, der forekommer i forskellige udviklingsstadier eller forhold. Samlet set giver dette system en pålidelig metode til påvisning af H2O2 i levende celler og dyr til at studere H 2 O2’srolle inden for udvikling, sundhed og sygdom.
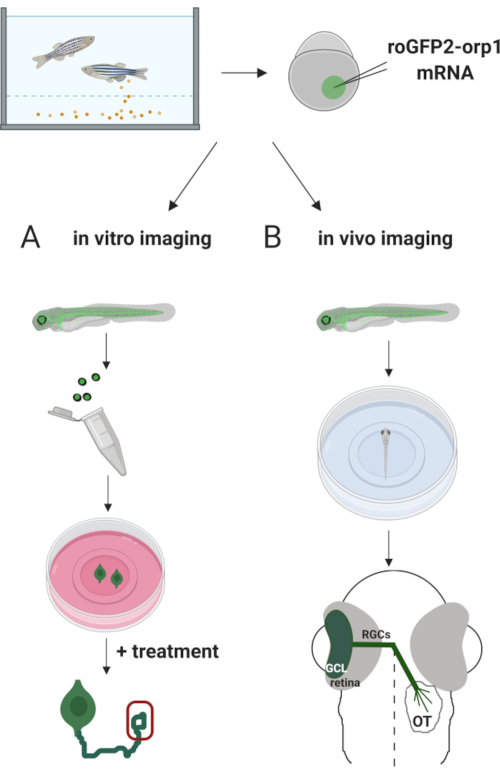
Figur 2. Oversigt over den eksperimentelle tilgang. Kort efter embryonindsamling injiceres roGFP2-Orp1 mRNA i æggeblommen på zebrafiskembryoner i en cellefase. Udvikling af embryoner kan anvendes til både (A) in vitro og (B) in vivo billeddannelse. (A) GFP-positive embryoner anvendes til dissekere nethinder til RGC-indsamling ved 34 hkf. Dissociated RGCs er belagt på PDL/laminin-coated coverslips i ZFCM (+) medier. Vækst kegle billeddannelse kan udføres som RGCs udvide deres axoner efter 6-24 timer af plating. Celler kan udsættes for forskellige behandlinger for at måle de potentielle ændringer i H2O2-niveauer. Her målte vi H2O2-niveauer i vækstkeglerne på RDC’er (rød). (B) GFP-positive embryoner anvendes til in vivo-billeddannelse. I den ønskede alder kan embryoner bedøves og monteres på 35 mm glasbundretter til konfokal billeddannelse. Her er embryoner monteret ventrally for nethinde billeddannelse. Skematisk viser nethinde udvikling i zebrafisk. RGCs danner ganglion cellelag (GCL), som er det inderste lag i nethinden. RGC axoner udvikler sig til synsnerve til at krydse midterlinjen og danner optisk chiasm. Derefter vokser RGC axoner dorsalt for at lave synapser i det optiske tectum i mellemskraben. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Der er flere kritiske trin, der kræver opmærksomhed i hele denne protokol. Vi mener, at overvejer disse punkter vil forbedre den eksperimentelle flow. For primær RGC-kultur er steriliteten af ZFCM(-) meget vigtig, da dette kulturmedie ikke indeholder antibiotika, og forurening kan forekomme før eller under billeddannelse. For at undgå det anbefaler vi kun at forberede og bruge ZFCM(-) inde i et biosikkerhedsskab og regelmæssigt lave friske ZFCM(-) medier (trin 1.5). Desuden bør lamininbestandene holdes på -80 °C…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af National Institutes of Health (Grant R01NS117701), National Science Foundation (Grant 1146944-IOS), Indiana Traumatic Spinal Cord and Brain Injury Research Fund (Grant 20000289), Purdue Research Foundation (Grant 209911) og kontoret for Executive Vice President for Research and Partnerships ved Purdue University (Grant 210362). Vi takker Dr. Cory J. Weaver og Haley Roeder for at etablere zebrafisk RGC kultur protokol. Vi takker Haley Roeder yderligere for at levere dataene i figur 4. Vi takker Leah Biasi og Kenny Nguyen for hjælpen med RGC-kulturen. Vi takker Gentry Lee for at redigere teksten. Vi takker Dr. Tobias Dick for at give roGFP2-Orp1 og Dr. Qing Deng for pCS2 + vektor, der indeholder roGFP2-Orp1. Figur 2 oprettes med Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

