ROS Imagerie des cellules vivantes au cours du développement neuronal
Summary
Ce protocole décrit l’utilisation d’un peroxyde d’hydrogène génétiquement codé (H2O2)-biocapteur dans les neurones et les larves de poisson zèbre cultivés pour évaluer les rôles physiologiques de signalisation deH2O2pendant le développement du système nerveux. Il peut être appliqué à différents types de cellules et modifié avec des traitements expérimentaux pour étudier les espèces réactives de l’oxygène (ROS) dans le développement général.
Abstract
Les espèces réactives de l’oxygène (ROS) sont des molécules de signalisation bien établies, qui sont importantes dans le développement normal, l’homéostasie, et la physiologie. Parmi les différents ROS,le peroxyde d’hydrogène (H2O2) est le mieux caractérisé en ce qui concerne les rôles dans la signalisation cellulaire. H2O2 a été impliqué lors du développement chez plusieurs espèces. Par exemple, une augmentation transitoire deH2O2 a été détectée chez les embryons de poissons zèbres au cours des premiers jours suivant la fécondation. En outre, l’épuisement d’une source cellulaire importante H2O2, NADPH oxydase (NOX), altère le développement du système nerveux tel que la différenciation, la croissance axonale, et le guidage des cellules ganglionnaires rétiniennes (RGCs) in vivo et in vitro. Ici, nous décrivons une méthode d’imagerie des niveaux intracellulaires deH2O2 dans les neurones de poissons zèbres cultivés et les larves entières pendant le développement en utilisant le biocapteur génétiquement codéH2 O2spécifique, roGFP2-Orp1. Cette sonde peut être exprimée de manière transitoire ou stable chez les larves de poissons zèbres. En outre, la lecture ratiométrique diminue la probabilité de détecter des artefacts en raison de l’expression génique différentielle ou des effets de volume. Tout d’abord, nous démontrons comment isoler et mettre en culture des GRC dérivés d’embryons de poissons zèbres qui expriment transitoirement roGFP2-Orp1. Ensuite, nous utilisons des larves entières pour surveiller les niveauxde H2O2au niveau des tissus. Le capteur a été validé par l’ajout deH2O2. De plus, cette méthodologie pourrait être utilisée pour mesurer les niveauxde H2O2dans des types de cellules et des tissus spécifiques en générant des animaux transgéniques avec une expression de biocapteur spécifique aux tissus. Comme les poissons zèbres facilitent les manipulations génétiques et développementales, l’approche démontrée ici pourrait servir de pipeline pour tester le rôle deH2O2 au cours du développement neuronal et embryonnaire général chez les vertébrés.
Introduction
La signalisation réactive des espèces de l’oxygène (ROS) régule le développement et le fonctionnement du système nerveux1. Une source importante de ROS cellulaires sont les oxydases NADPH (NOX), quisont des protéines transmembranaires générant du superoxyde et du peroxyde d’hydrogène (H2O2)2. Les enzymes NOX se trouvent dans tout le système nerveux central (SNC), et les ROS dérivés du NOX contribuent au développement neuronal3,4,5,6. Il a été démontré que le maintien et la différenciation des cellules souches neurales, l’établissement de la polarité neuronale, l’excroissance des neurites et la plasticité synaptique nécessitent des niveaux adéquats de ROS7,8,9,10,11. D’autre part, la production incontrôlée de ROS par les NEX contribue aux troubles neurodégénératifs, y compris la maladie d’Alzheimer, la sclérose en plaques et les lésions cérébrales traumatiques12,13,14. Par conséquent, la production de ROS physiologiquement pertinents est essentielle au maintien de conditions saines.
La mise au point de biocapteurs génétiquement codés a grandement facilité la détection des ROS cellulaires. Un avantage important des biocapteurs génétiquement codés est l’augmentation de la résolution temporelle et spatiale du signal ROS, car ces capteurs peuvent être spécifiquement ciblés à des endroits distincts. Le GFP sensible aux redox (roGFP) est l’un des types de ces biocapteurs ROS. La variante roGFP2-Orp1 détecte spécifiquement H2O2à travers son domaine Orp1, qui est une protéine de la famille des glutathion peroxiredoxin de levure15,16. L’oxydation de la protéine Orp1 est transférée dans roGFP2 pour modifier sa conformation(figure 1A). La sonde présente deux pics d’excitation proches de 405 nm et 480 nm, et un seul pic d’émission à 515 nm. Lors de l’oxydation, l’intensité de fluorescence autour des pics d’excitation change: alors que l’excitation de 405 nm augmente, l’excitation de 480 nm diminue. Ainsi, roGFP2-Orp1 est un biocapteur ratiométrique,et les niveauxH2O2sont détectés par le rapport des intensités de fluorescence excitées à deux longueurs d’onde différentes(figure 1B). Dans l’ensemble, roGFP2-Orp1 est un outil polyvalent pour l’imagerie ROS qui peut être utilisé efficacement in vivo.
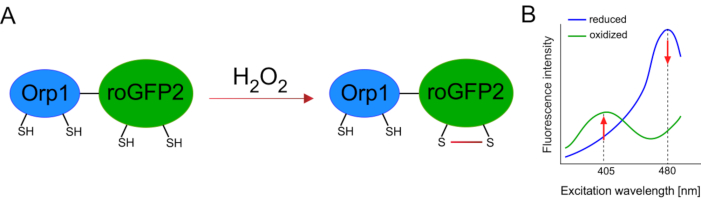
Figure 1: Spectres schématiques de représentation et d’excitation de roGFP2-Orp1. (A) Le transfert d’oxydant se produit entre Orp1 et roGFP2 en réponse àH2O2,conduisant à des changements conformationnels dans roGFP2. (B) Les spectres d’excitation du roGFP2-Orp1 présentent deux pics d’excitation à 405 nm et 480 nm et un pic d’émission unique à 515 nm. Lors de l’oxydation parH2O2,l’excitation de 405 nm augmente tandis que l’excitation de 480 nm diminue. Il en résulte une lecture ratiométrique pour la présenceH2O2. Le chiffre a été modifié à partir de Bilan et Belousov (2017)16 et Morgan et coll. (2011)25. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Le système modèle Danio rerio (poisson zèbre) présente plusieurs avantages pour l’application de biocapteurs génétiquement codés. La transparence optique des embryons et des larves permet une imagerie in vivo non invasive. De nouveaux outils d’imagerie sont en cours de développement pour atteindre une résolution plus élevée et une pénétration plus profonde17. En outre, il existe des outils établis pour la manipulation génétique (expression ectopique de l’ARNm, transgénèse Tol2, etc.) et l’édition du génome (TALENs, CRISPR/Cas9, etc.), qui favorisent la génération d’animaux transgéniques18. Au fur et à mesure que les embryons de poisson zèbre se développent à l’extérieur de la mère, ce système facilite l’accès et la manipulation des embryons. Par exemple, les injections au stade unicellulaire et les traitements médicamenteux peuvent facilement être effectués.
Ici, nous avons utilisé le poissonzèbre pour exprimer transitoirement le biocapteur roGFP2-Orp1 spécifique àH2O2en injectant de l’ARNm transcrit in vitro. Ces embryons peuvent être utilisés à la fois pour l’imagerie in vitro de neurones cultivés et pour l’imagerie in vivo (figure 2). Nous décrivons un protocole pour disséquer et plaquer les cellules rétiniennes de ganglion (RGCs) des embryons de poisson zèbre suivis d’évaluer H2O2– niveaux dans les neurones cultivés. Ensuite, nous présentons une méthode d’imagerie in vivo d’embryons et de larves exprimant roGFP2-Orp1 à l’aide de la microscopie confocale. Cette approche permet non seulement de déterminer les niveaux physiologiques deH2O2-mais aussi les changements potentiels survenant à différents stades ou conditions de développement. Dans l’ensemble, ce système fournit une méthode fiable pour détecterH2O2dans les cellules vivantes et les animaux pour étudier le rôle de H2O2 dans le développement, la santé et la maladie.
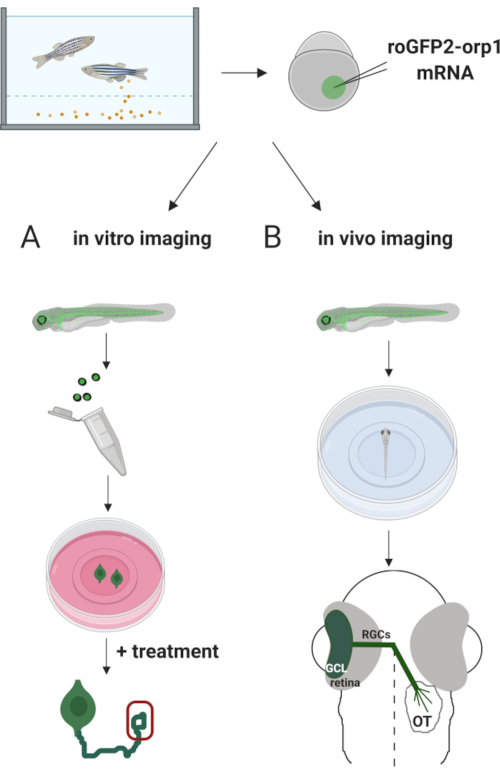
Figure 2. Aperçu de l’approche expérimentale. En bref, après le prélèvement d’embryons, l’ARNm roGFP2-Orp1 est injecté dans le jaune d’embryons de poisson zèbre au stade cellulaire. Les embryons en développement peuvent être utilisés à la fois pour l’imagerie in vitro (A)et(B) in vivo. (A) Les embryons GFP-positifs sont utilisés pour disséquer des rétines pour la collecte de RGC à 34 hpf. Les RGCs dissociés sont plaqués sur des lamaux de couverture enduits de PDL/laminine dans des milieux ZFCM (+). L’imagerie du cône de croissance peut être effectuée car les RGCs étendent leurs axones après 6-24 h de placage. Les cellules peuvent être soumises à différents traitements pour mesurer les changements potentiels des niveaux deH2O2. Ici, nous avons mesuréles niveaux deH2O2dans les cônes de croissance des RGCs (rouge). (B) les embryons positifs à la GFP sont utilisés pour l’imagerie in vivo. À l’âge souhaité, les embryons peuvent être anesthésiés et montés sur des plats à fond de verre de 35 mm pour l’imagerie confocale. Ici, les embryons sont montés ventralement pour l’imagerie rétinienne. Le schéma montre le développement rétinien chez le poisson zèbre. Les RGCs forment la couche cellulaire ganglionnaire (GCL), qui est la couche la plus interne de la rétine. Les axones de RGC se développent en nerf optique pour croiser le midline, formant le chiasm optique. Ensuite, les axones RGC se développent dorsalement pour faire des synapses dans le tectum optique dans le mécérine. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
Il y a plusieurs étapes critiques qui nécessitent une attention particulière tout au long de ce protocole. Nous pensons que la prise en compte de ces points améliorera le flux expérimental. Pour la culture primaire de RGC, la stérilité du ZFCM(-) est très importante, car ce milieu de culture ne contient pas d’antibiotiques et la contamination peut survenir avant ou pendant l’imagerie. Pour l’éviter, nous vous conseillons de préparer et d’utiliser ZFCM(-) uniquement à l’intérieur d’une armoire de b…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par les National Institutes of Health (Grant R01NS117701), la National Science Foundation (Grant 1146944-IOS), l’Indiana Traumatic Spinal Cord and Brain Injury Research Fund (Grant 20000289), la Purdue Research Foundation (Grant 209911) et le Bureau du vice-président exécutif pour la recherche et les partenariats à l’Université Purdue (Subvention 210362). Nous remercions le Dr Cory J. Weaver et Haley Roeder d’avoir établi le protocole d’élevage du poisson zèbre RGC. Nous remercions également Haley Roeder d’avoir fourni les données de la figure 4. Nous remercions Leah Biasi et Kenny Nguyen pour leur aide à la culture RGC. Nous remercions Gentry Lee d’avoir édité le texte. Nous remercions le Dr Tobias Dick d’avoir fourni roGFP2-Orp1 et le Dr Qing Deng pour le vecteur pCS2+ contenant roGFP2-Orp1. La figure 2 est créée avec Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

